Diferencia entre revisiones de «Trimiristina»
m Mantenimiento de Control de autoridades |
Sin resumen de edición |
||
| Línea 1: | Línea 1: | ||
{{referencias|t=20141001|química}} |
|||
{{Ficha de compuesto químico |
{{Ficha de compuesto químico |
||
|nombre = Trimiristina |
|nombre = Trimiristina |
||
| Línea 8: | Línea 7: | ||
|tamaño de imagen2 = |
|tamaño de imagen2 = |
||
|pie de imagen2 = |
|pie de imagen2 = |
||
|IUPAC = 1,3- |
|IUPAC = tetradecanoato de 1,3-di(tetradecanoiloxi)propan-2-ilo |
||
|otros nombres = |
|otros nombres = Trimiristato de glicerol; tritetradecanoato de glicerol; 1,2,3-Tritetradecanoil glicerol |
||
|símbolo = |
|símbolo = |
||
|fórmula1 = |
|fórmula1 = |
||
| Línea 34: | Línea 33: | ||
}} |
}} |
||
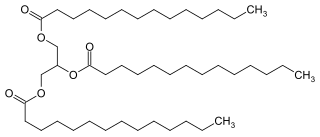
La '''trimiristina''' es el [[triglicérido]] (o triacilglicérido) del [[ácido mirístico]]. Un triglicérido es un éster compuesto por tres moléculas de ácidos grasos (iguales o diferentes) y una de glicerol (1,2,3-propanotriol). |
La '''trimiristina''' es el [[triglicérido]] (o triacilglicérido) del [[ácido mirístico]]. Un triglicérido es un éster compuesto por tres moléculas de ácidos grasos (iguales o diferentes) y una de [[glicerol]] (1,2,3-propanotriol).Como todos los [[lípido]]s, es un sólido blanco a gris-amarillento que es insoluble en agua, pero soluble en [[etanol]], [[benceno]], [[cloroformo]], [[diclorometano]] y [[éter]]. |
||
== Presencia == |
|||
Como todos los [[lípido]]s, es insoluble en agua pero soluble en solventes orgánicos poco polares como [[etanol]], [[benceno]], [[cloroformo]], [[diclorometano]] y [[éter]]. |
|||
La trimiristina se puede encontrar naturalmente en muchas grasas y aceites vegetales. |
|||
[[File:Nutmeg seed.jpg|200px|thumb|left|Semilla de nuez moscada]] |
|||
La trimistina se puede encontrar en la nuez moscada y puede ser extraída muy sencillamente mediante el agregado de cloruro de metileno (CH<sub>2</sub>Cl<sub>2</sub>) y filtración rápida por gravedad (filtración simple con un embudo y algodón). El filtrado se recoge en un balón del cual se elimina el solvente por destilación en un [[rotavapor]]. |
|||
El aceite obtenido de la destilación se recristaliza de acetona o acetato de etilo y el producto es trimiristina cristalina ([[Punto de fusión]]: 55-56 ºC). |
|||
| ⚫ | Para obtener el ácido mirístico a partir de la trimiristina se puede realizar una saponificación. La |
||
El aislamiento de la trimiristina de la [[nuez moscada]] en polvo es un experimento de [[química orgánica]] universitaria a nivel introductorio bastante común.Es una extracción de productos naturales poco común porque el aceite de nuez moscada generalmente contiene más del ochenta por ciento de trimiristina. Constituye entre el 20-25% de la masa total de la nuez moscada molida seca. Se suele realizar generalmente por una [[destilación por arrastre de vapor]] y posteriormente una [[extracción orgánica]] con éter dietílico o diclorometano, evaporando el disolvente orgánico volátil en un [[rotavapor]]. El experimento se incluye con frecuencia en los planes de estudio, tanto por su relativa facilidad como para proporcionar instrucción en estas técnicas.<ref>{{Cite journal | doi = 10.1021/ed048p255| title = Trimyristin from nutmeg| journal = Journal of Chemical Education| volume = 48| issue = 4| pages = 255| year = 1971| last1 = Frank| first1 = Forrest| last2 = Roberts| first2 = Theodore| last3 = Snell| first3 = Jane| last4 = Yates| first4 = Christy| last5 = Collins| first5 = Joseph}}</ref><ref>{{Cite journal | doi = 10.1021/ed067p274| title = Isolation of trimyristin and cholesterol: Two microscale extractions for one laboratory period| journal = Journal of Chemical Education| volume = 67| issue = 3| pages = 274| year = 1990| last1 = Vestling| first1 = Martha M}}</ref><ref>{{Cite journal | doi = 10.1021/ed079p94| title = Soap from Nutmeg: An Integrated Introductory Organic Chemistry Laboratory Experiment| journal = Journal of Chemical Education| volume = 79| pages = 94| year = 2002| last1 = De Mattos| first1 = Marcio C. S| last2 = Nicodem| first2 = David E}}</ref> El aceite obtenido de la destilación se puede recristalizar con acetona o acetato de etilo, obteniendo como producto la trimiristina cristalina ([[Punto de fusión]]: 55-56 ºC). |
|||
== Reactividad == |
|||
| ⚫ | Para obtener el ácido mirístico a partir de la trimiristina se puede realizar una [[saponificación]]. La saponificación es una [[hidrólisis]] alcalina de los triglicéridos, y uno de sus productos es el jabón (la sal de sodio o la de potasio del ácido graso), pudiéndose separar del medio acuoso por adición de una [[sal]] como el [[cloruro de sodio|NaCl]]. Para purificar el [[cristal]] obtenido del aceite, se puede agregar una disolución de [[hidróxido de potasio|KOH]] al 7% en etanol y poner a reflujo. Luego, se añade [[ácido clorhídrico|HCl]] concentrado y se filtra el precipitado obtenido, el [[ácido mirístico]] (Punto de fusión: 53-54[[Celsius|ºC]]). |
||
== Referencias == |
== Referencias == |
||
Revisión del 19:59 11 abr 2020
| Trimiristina | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| tetradecanoato de 1,3-di(tetradecanoiloxi)propan-2-ilo | ||
| General | ||
| Otros nombres | Trimiristato de glicerol; tritetradecanoato de glicerol; 1,2,3-Tritetradecanoil glicerol | |
| Fórmula molecular | C45H86O6 | |
| Identificadores | ||
| Número CAS | 555-45-3[1] | |
| ChemSpider | 10675 | |
| PubChem | 11148 | |
| UNII | 18L31PSR28 | |
| Propiedades físicas | ||
| Apariencia | polvo blanco amarillento | |
| Densidad | 885 kg/m³; 0885 g/cm³ | |
| Masa molar | 72 316 g/mol | |
| Punto de fusión | 57 °C (330 K) | |
| Punto de ebullición | 311 °C (584 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La trimiristina es el triglicérido (o triacilglicérido) del ácido mirístico. Un triglicérido es un éster compuesto por tres moléculas de ácidos grasos (iguales o diferentes) y una de glicerol (1,2,3-propanotriol).Como todos los lípidos, es un sólido blanco a gris-amarillento que es insoluble en agua, pero soluble en etanol, benceno, cloroformo, diclorometano y éter.
Presencia
La trimiristina se puede encontrar naturalmente en muchas grasas y aceites vegetales.

El aislamiento de la trimiristina de la nuez moscada en polvo es un experimento de química orgánica universitaria a nivel introductorio bastante común.Es una extracción de productos naturales poco común porque el aceite de nuez moscada generalmente contiene más del ochenta por ciento de trimiristina. Constituye entre el 20-25% de la masa total de la nuez moscada molida seca. Se suele realizar generalmente por una destilación por arrastre de vapor y posteriormente una extracción orgánica con éter dietílico o diclorometano, evaporando el disolvente orgánico volátil en un rotavapor. El experimento se incluye con frecuencia en los planes de estudio, tanto por su relativa facilidad como para proporcionar instrucción en estas técnicas.[2][3][4] El aceite obtenido de la destilación se puede recristalizar con acetona o acetato de etilo, obteniendo como producto la trimiristina cristalina (Punto de fusión: 55-56 ºC).
Reactividad
Para obtener el ácido mirístico a partir de la trimiristina se puede realizar una saponificación. La saponificación es una hidrólisis alcalina de los triglicéridos, y uno de sus productos es el jabón (la sal de sodio o la de potasio del ácido graso), pudiéndose separar del medio acuoso por adición de una sal como el NaCl. Para purificar el cristal obtenido del aceite, se puede agregar una disolución de KOH al 7% en etanol y poner a reflujo. Luego, se añade HCl concentrado y se filtra el precipitado obtenido, el ácido mirístico (Punto de fusión: 53-54ºC).
Referencias
- ↑ Número CAS
- ↑ Frank, Forrest; Roberts, Theodore; Snell, Jane; Yates, Christy; Collins, Joseph (1971). «Trimyristin from nutmeg». Journal of Chemical Education 48 (4): 255. doi:10.1021/ed048p255.
- ↑ Vestling, Martha M (1990). «Isolation of trimyristin and cholesterol: Two microscale extractions for one laboratory period». Journal of Chemical Education 67 (3): 274. doi:10.1021/ed067p274.
- ↑ De Mattos, Marcio C. S; Nicodem, David E (2002). «Soap from Nutmeg: An Integrated Introductory Organic Chemistry Laboratory Experiment». Journal of Chemical Education 79: 94. doi:10.1021/ed079p94.
