Diferencia entre revisiones de «Malaria»
Sin resumen de edición |
Revertidos los cambios de 200.123.81.226 a la última edición de Ptbotgourou usando monobook-suite |
||
| Línea 1: | Línea 1: | ||
Del [[idioma italiano|italiano]] "malaria", mala-aria (mal aire), también denominada '''fiebre palúdica''' o '''paludismo''', es una enfermedad producida por parásitos del género ''[[Plasmodium]]''. Es la primera en importancia de entre las enfermedades debilitantes, con más de 200 millones de casos cada año en todo el mundo. |
Del [[idioma italiano|italiano]] "malaria", mala-aria (mal aire), también denominada '''fiebre palúdica''' o '''paludismo''', es una enfermedad producida por parásitos del género ''[[Plasmodium]]''. Es la primera en importancia de entre las enfermedades debilitantes, con más de 200 millones de casos cada año en todo el mundo. |
||
El Día [[africano]] de lucha contra el se celebra el 25 de abril,<ref>[http://portal.unesco.org/education/es/ev.php-URL_ID=30616&URL_DO=DO_TOPIC&URL_SECTION=201.html UNESCO | Education - Día africano de lucha contra el paludismo : un futuro sin paludismo, el tema del Día Africano del Paludismo de este año<!-- Título generado por un bot -->]</ref> ya que es en este continente donde más común es esta enfermedad. |
El Día [[africano]] de lucha contra el paludismo se celebra el 25 de abril,<ref>[http://portal.unesco.org/education/es/ev.php-URL_ID=30616&URL_DO=DO_TOPIC&URL_SECTION=201.html UNESCO | Education - Día africano de lucha contra el paludismo : un futuro sin paludismo, el tema del Día Africano del Paludismo de este año<!-- Título generado por un bot -->]</ref> ya que es en este continente donde más común es esta enfermedad. |
||
| ⚫ | La enfermedad puede ser causada por una o varias de las diferentes especies de ''[[Plasmodium]]'': ''[[Plasmodium falciparum]]'', ''[[Plasmodium vivax]]'', ''[[Plasmodium malariae]]'' o ''[[Plasmodium ovale]]''. Los vectores de esta enfermedad son diversas especies del género ''[[Anopheles]]''. Como es sabido, tan sólo las hembras de [[mosquito]]s son las que se alimentan de sangre para poder madurar los huevos y por tanto los machos no pican y no pueden transmitir enfermedades ya que únicamente se alimentan de néctares y jugos vegetales. |
||
La única forma posible de contagio directo entre humanos es que una mujer embarazada lo transmita por vía trasplacentaria al feto. O bien, por la transmisión directa a través de la picadura de un mosquito. |
|||
La enfermedad puede ser causada por una |
|||
| ⚫ | |||
Los síntomas son muy variados, empezando con fiebre 8 a 30 días después de la infección, acompañada, o no, de dolor de cabeza, dolores musculares, diarrea, decaimiento y tos. |
Los síntomas son muy variados, empezando con fiebre 8 a 30 días después de la infección, acompañada, o no, de dolor de cabeza, dolores musculares, diarrea, decaimiento y tos. |
||
| Línea 14: | Línea 16: | ||
{{VT|Corteza de quina|Teoría miasmática de la enfermedad}} |
{{VT|Corteza de quina|Teoría miasmática de la enfermedad}} |
||
La malaria ha infectado a los humanos durante más de 50.000 años, y puede que haya sido un [[patógeno]] |
La malaria ha infectado a los humanos durante más de 50.000 años, y puede que haya sido un [[patógeno]] humano durante la historia entera de nuestra especie.<ref>{{cita publicación| autor= Joy D, Feng X, Mu J, ''et al'' | título= Early origin and recent expansion of Plasmodium falciparum. | revista= Science | volumen= 300 | número= 5617 | páginas= 318-21 | año= 2003 | pmid = 12690197}} [http://www.ncbi.nlm.nih.gov/sites/entrez?cmd=Retrieve&db=pubmed&dopt=AbstractPlus&list_uids=12690197]</ref> De cierto, especies cercanas a los parásitos humanos de la malaria se han encontrado en los [[Pan (animal)|chimpancés]], pariente ancestral de los humanos.<ref>{{cita publicación| autor= Escalante A, Freeland D, Collins W, Lal A | título= The evolution of primate malaria parasites based on the gene encoding cytochrome b from the linear mitochondrial genome. | url=http://www.pnas.org/cgi/content/full/95/14/8124 | revista= Proc Natl Acad Sci U S A | volumen= 95 | número= 14 | páginas= 8124-9 | año= 1998 | pmid = 9653151}} [http://www.ncbi.nlm.nih.gov/sites/entrez?cmd=Retrieve&db=pubmed&dopt=AbstractPlus&list_uids=9653151]</ref> Se encuentran referencias de las peculiares fiebres periódicas de la malaria a lo largo de la historia, comenzando desde 2700 [[a. C.]] en [[China]].<ref>{{cita publicación| autor= Cox F | título= History of human parasitology. | url=http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=12364371 | revista= Clin Microbiol Rev | volumen= 15 | número= 4 | páginas= 595-612 | año= 2002 | pmid = 12364371}} [http://www.ncbi.nlm.nih.gov/sites/entrez?cmd=Retrieve&db=pubmed&dopt=AbstractPlus&list_uids=12364371]</ref> |
||
El término ''malaria'' proviene del [[idioma italiano|italiano]] de la [[edad media]]: ''mala aria'' — "[[Teoría miasmática de la enfermedad|mal aire]]"; y se le llamó también ''paludismo'', del [[idioma latín|latín]] "palus" (pantano). |
El término ''malaria'' proviene del [[idioma italiano|italiano]] de la [[edad media]]: ''mala aria'' — "[[Teoría miasmática de la enfermedad|mal aire]]"; y se le llamó también ''paludismo'', del [[idioma latín|latín]] "palus" (pantano). |
||
Revisión del 23:47 27 abr 2009
Del italiano "malaria", mala-aria (mal aire), también denominada fiebre palúdica o paludismo, es una enfermedad producida por parásitos del género Plasmodium. Es la primera en importancia de entre las enfermedades debilitantes, con más de 200 millones de casos cada año en todo el mundo.
El Día africano de lucha contra el paludismo se celebra el 25 de abril,[1] ya que es en este continente donde más común es esta enfermedad.
La enfermedad puede ser causada por una o varias de las diferentes especies de Plasmodium: Plasmodium falciparum, Plasmodium vivax, Plasmodium malariae o Plasmodium ovale. Los vectores de esta enfermedad son diversas especies del género Anopheles. Como es sabido, tan sólo las hembras de mosquitos son las que se alimentan de sangre para poder madurar los huevos y por tanto los machos no pican y no pueden transmitir enfermedades ya que únicamente se alimentan de néctares y jugos vegetales.
La única forma posible de contagio directo entre humanos es que una mujer embarazada lo transmita por vía trasplacentaria al feto. O bien, por la transmisión directa a través de la picadura de un mosquito.
Los síntomas son muy variados, empezando con fiebre 8 a 30 días después de la infección, acompañada, o no, de dolor de cabeza, dolores musculares, diarrea, decaimiento y tos.
En regiones donde la malaria es altamente endémica, las personas son tan a menudo infectadas que desarrollan la "inmunidad adquirida", es decir que son portadores más o menos asintomáticos del parásito.
La primera vacuna fue desarrollada por el doctor Manuel Elkin Patarroyo, médico colombiano, y tiene una efectividad del 99.9%
Historia
La malaria ha infectado a los humanos durante más de 50.000 años, y puede que haya sido un patógeno humano durante la historia entera de nuestra especie.[2] De cierto, especies cercanas a los parásitos humanos de la malaria se han encontrado en los chimpancés, pariente ancestral de los humanos.[3] Se encuentran referencias de las peculiares fiebres periódicas de la malaria a lo largo de la historia, comenzando desde 2700 a. C. en China.[4] El término malaria proviene del italiano de la edad media: mala aria — "mal aire"; y se le llamó también paludismo, del latín "palus" (pantano).
Los estudios científicos sobre la malaria hicieron su primer avance de importancia en 1880, cuando el médico militar francés Charles Louis Alphonse Laveran, trabajando en Argelia, observó parásitos dentro de los glóbulos rojos de personas con malaria. Propuso por ello que la malaria la causaba un protozoario, la primera vez que se identificó a un protozoario como causante de una enfermedad.[5] Por este y otros descubrimientos subsecuentes, se le concedió el Premio Nobel en Fisiología o Medicina en 1907. Al protozoario en cuestión se le llamó Plasmodium, por los científicos italianos Ettore Marchiafava y Angelo Celli.[6] Un año después, Carlos Finlay, un médico cubano que trataba pacientes con fiebre amarilla en la Habana, sugirió que eran los mosquitos quienes transmitían la enfermedad de un humano a otro. Posteriormente, fue el británico Sir Ronald Ross, trabajando en la India, quien finalmente demostró en 1898 que la malaria era transmitida por los mosquitos. Lo probó al mostrar que ciertas especies del mosquito transmitían la malaria a pájaros y aislando los parásitos de las glándulas salivales de mosquitos que se alimentaban de aves infectadas.[7] Por su aporte investigador, Ross recibió el premio Nobel de Medicina en 1902. Después de renunciar al Servicio Médico de la India, Ross trabajó en la recién fundada Liverpool School of Tropical Medicine y dirigió los esfuerzos por controlar la malaria en Egipto, Panamá, Grecia y Mauricio.[8] Los hallazgos de Finlay y Ross fueron confirmados luego por un comité médico dirigido por Walter Reed en 1900, y sus recomendaciones implementadas por William C. Gorgas en medidas de salud adoptadas durante la construcción del Canal de Panamá. Este trabajo salvó la vida de miles de trabajadores y ayudó a desarrollar los métodos usados en campañas de salúd pública contra la malaria.
El primer tratamiento eficaz para la malaria fue la corteza del árbol Cinchona, que contiene el alcaloide quinina. Este árbol crece en las colinas de los Andes, en particular en Perú. Los habitantes del Perú usaban el producto natural para controlar la malaria, y los Jesuitas introdujeron esta práctica en Europa durante los años 1640, donde fue aceptada con rapidez.[9] Sin embargo, no fue sino hasta 1820 cuando la quinina, el ingrediente activo, fue extraída de la corteza y nombrada por los químicos franceses Pierre Joseph Pelletier y Jean Bienaime Caventou.[10]
A comienzos del siglo XX, antes de los antibióticos, los pacientes con sífilis eran intencionalmente infectados con malaria para crear una fiebre, siguiendo las investigaciones de Julius Wagner-Jauregg. Al controlar la fiebre con quinina, los efectos tanto de la sífilis como la malaria podían ser minimizados. Algunos de los pacientes murieron por la malaria, pero el riesgo era preferible por encima de la casi segura muerte por sífilis.[11]
A pesar de que en el estadio sanguíneo y en el mosquito del ciclo de vida de la malaria se estableció en el siglo XIX y a comienzos del siglo XX, solo en 1980 se observó la forma latente hepática del parásito. Este descubrimiento explicó finalmente por qué daba la impresión de que algunas personas se curaban de la enfermedad, para recaer años después de que el parásito hubiese desaparecido de su circulación sanguínea.[12][13]
Epidemiología
La malaria causa unos 400–900 millones de casos de fiebre y aproximadamente 1-3 millones de muertes anuales[14], lo que representa una muerte cada 30 segundos. La gran mayoría de los casos ocurre en niños menores de 5 años;[15] las mujeres embarazadas son también especialmente vulnerables.[16] A pesar de los esfuerzos por reducir la transmisión e incrementar el tratamiento, ha habido muy poco cambio en las zonas que se encuentran en riesgo de la enfermedad desde 1992.[17] De hecho, si la prevalencia de la malaria continúa en su curso de permanente aumento, la tasa de mortalidad puede duplicarse en los próximos veinte años.[14] Las estadísticas precisas se desconocen porque muchos casos ocurren en áreas rurales, donde las personas no tienen acceso a hospitales o a recursos para garantizar cuidados de salud. Como consecuencia, la mayoría de los casos permanece indocumentada.[14]
Aunque la co-infección de VIH con malaria ha incrementado la mortalidad, sigue siendo un problema menor que la combinación de VIH-tuberculosis.
Mecanismo de transmisión y ciclo biológico de Plasmodium
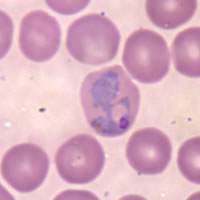
La hembra del Anopheles infectada es portadora de los esporozoítos del Plasmodium en sus glándulas salivares. Si pica a una persona, los esporozoitos entran en la persona a través de la saliva del mosquito y migran al hígado, donde se multiplican rápidamente dentro de las células hepáticas (los hepatocitos) mediante una división asexual múltiple, y se transforman en merozoitos que entran en el torrente sanguíneo. Allí infectan los eritrocitos y siguen multiplicándose, dando lugar a unas formas iniciales típicamente anulares (trofozoítos), formas en división asexual múltiple (merotes) y finalmente un número variable de merozoítos según la especie de Plasmodium, que provoca la ruptura del eritrocito. Algunos merozoítos se transforman en unas células circulares relativamente grandes que son gametocitos femeninos y masculinos y dejan de multiplicarse, aunque en P. falciparum son más grandes que el propio eritrocito y tienen forma de boomerang, lo que también ocasiona su ruptura. Una hembra de Anopheles no infectada pica a un enfermo y adquiere los gametocitos, y así se inicia el ciclo sexual del Plasmodium. Con la unión de los gametos en su intestino, la formación de un huevo, que es móvil, y que dará origen a un Ooquiste que volverá a dividirse y dar esporozoitos listos para infectar nuevamente, al llegar a las glándulas salivales del mosquito.
En los humanos, las manifestaciones clínicas se deben a:
La ruptura de glóbulos rojos, que liberan merozoitos, que liberan sustancias que estimulan el hipotálamo, ocasionando repentinas crisis febriles, muy intensas, cada dos o tres días (al completarse el ciclo eritrocitico o asexual de Plasmodium), seguidas al cabo de unas horas de una brusca vuelta a una aparente normalidad. Este proceso va dejando al organismo exhausto, y en el caso de los niños pequeños hay una gran probabilidad de un desenlace fatal en ausencia de tratamiento.
El parásito evita el sistema inmunitario al permanecer intracelularmente en los hepatocitos y eritrocitos, aunque muchos eritrocitos parasitados se eliminan en el bazo. Para evitarlo, el parásito produce ciertas proteínas que se expresan en la superficie del eritrocito y causan su adherencia al endotelio vascular, especialmente en Plasmodium falciparum: este es el factor principal de las complicaciones hemorrágicas de la malaria. Dichas proteínas son además altamente variables, y por lo tanto el sistema inmunitario no puede reconocerlas de forma efectiva, ya que cuando elabora un número de anticuerpos suficiente (al cabo de dos semanas o más), estos serán inútiles porque el antígeno ha cambiado.
El ciclo continúa cuando un mosquito ingiere sangre de un enfermo o portador, y con ello algunos gametocitos. En el intestino del mosquito estos se transforman en macrogametos (femenino) y microgametos (masculinos), que se fusionan dando un cigoto móvil u oocineto. Este finalmente formará los esporozoítos que migran a las glándulas salivares del mosquito, completando el ciclo vital.
Las mujeres gestantes son especialmente atractivas para los mosquitos y la malaria en ellas es especialmente nefasta, dada la sensibilidad del feto (que no tiene un sistema inmunitario desarrollado) a la infección.
Síntomas
Se caracteriza por escalofríos, que duran de 15 minutos a una hora, comenzando cuando una nueva generación de parásitos rompe los eritrocitos huésped y escapan hacia la sangre. En este momento es común que haya náuseas, vómito y cefalea. La siguiente etapa caliente, que dura varias horas, se acompaña de fiebres en aguja que en ocasiones alcanza 40° C o más. Durante esta fase es posible que los parásitos invadan otros eritrocitos. Con la tercera etapa o de sudación termina el episodio. En infecciones por P. vivax (paludismo terciario benigno), P. Ovale o Falciparum (paludismo terciario maligno) se rompen los eritrocitos y hay paroxismos cada 48 horas. En infecciones por P. Malariae (paludismo cuartano) los ciclos duran 72 horas. A medida que progresa la enfermedad se presenta esplenomegalia y en menor grado hepatomegalia. La infección por P. Falciparum tiene mayor importancia, ya que a diferencia de las otras infecciones, ésta tiene con mayor frecuencia complicaciones graves o mortales. También es la más difícil de identificar clínicamente, ya que a menudo se presenta como una enfermedad del tipo influenza, con síntomas inespecíficos de fiebre, cefaleas, mialgias, náuseas, diarrea o dolor y molestias abdominales. La fiebre puede ser de tipo febrícula, continua, o con agujas diarias, y ocurrir sin escalofríos ni sacudidas. En ocasiones es difícil identificar los parásitos en frotis de sangre.
Vacuna
El primero en descubrir una vacuna sintética contra la malaria fue el doctor Manuel Elkin Patarroyo, de origen colombiano. Entre 1986 y 1988 la vacuna sintética (SPf66) fue creada y probada en una colonia de micos de la región amazónica, los Aotus trivirgatus, y en un grupo de jóvenes bachilleres voluntarios que prestaban su servicio militar. Sin embargo, allí comenzaron los problemas, pues los intereses económicos en juego entorpecieron la aplicación masiva de la vacuna.
La vacuna se probó en más de 41.000 voluntarios en América Latina, donde a principios de 1994 fueron inoculados 45 voluntarios que demostraron que la vacuna induce una fuerte respuesta inmunitaria (entre un 40 y un 60% en los adultos, y hasta un 77% en los niños) contra la malaria, sin provocar efectos colaterales. Finalmente, luego de ser evaluada en Gambia, Tanzania y Tailandia, la vacuna demostró no tener la efectividad aspirada por el doctor Patarrollo, por lo cual se detuvo el proceso de fabricación y vacunación con la SPF66.A partir de este momento los laboratorios del Dr. Patarrollo se han dedicado a estudiar la vacuna con el objetivo de tener un 99.9% de efectividad en todos los casos.la SPF66 se convirtió en la vacuna más efectiva contra la malaria hasta hoy desarrollada.
Las vacunas para la malaria están en desarrollo, no completamente con una vacuna eficaz disponible todavía. Los primeros estudios prometedores que demuestran la posibilidad de una vacuna contra el paludismo se realizaron en 1967 por la inmunización de ratones con esporozoitos atenuados por radiación, que brindan protección a alrededor del 60% de los ratones posterior a la inyección con normal, viable esporozoitos. Desde la decada de 1970, Se ha producido un considerable esfuerzo para desarrollar estrategias de vacunación similares en los seres humanos. Se determinó que una persona puede protegerse de una infección por P. falciparum si recibe picaduras de más de 1000 mosquitos infectados por irradación. En general, se ha aceptado que no es práctico proporcionar a las personas de riesgo, con esta estrategia de vacunación, pero que ha sido recientemente cuestionado con el trabajo que está realizando el doctor Stephen Hoffman, de Sanaria, uno de los principales investigadores que originalmente secuencio el genoma de Plasmodium Falciparum. Su trabajo más reciente ha girado en torno a la solución del problema de logística de la preparación y aislamiento de los parásitos a 1000 equivalente a los mosquitos irradiados para el almacenamiento masivo y la inoculación de los seres humanos. La compañía ha recibido recientemente varias multimillonarias subvenciones de la Fundación Bill y Melinda Gates y el gobierno de los EE.UU. a principios de comenzar los estudios clínicos en 2007 y 2008. El Instituto de Investigación Biomédica de Seattle (SBRI), financiado por la Vacuna contra la Malaria Iniciativa, asegura a los posibles voluntarios que "el [2009] ensayos clínicos no será un riesgo para la vida la experiencia. Si bien muchos voluntarios [en Seattle] realmente contraen la enfermedad, la cepa clonada utilizada en los experimentos se puede curar, y no Causar una forma recurrente de la enfermedad. "Algunos de los participantes obtendrá drogas experimentales o de las vacunas, mientras que otros recibirán placebo."
En lugar de ello, mucho trabajo se ha realizado para intentar comprender los procesos de la inmunológicos que brindan protección después de la inmunización con esporozoitos irradiados. Después del estudio del ratón de vacunación en 1967, [95] es la hipótesis de que los esporozoitos se inyectan a sí mismos se están reconocidos por el sistema inmune, que es a su vez la creación de anticuerpos contra el parásito. Se determinó que el sistema inmunológico estaba creando anticuerpos contra la proteína circumsporozoite (CSP), que el esporozoitos revestidos. [99] Además, los anticuerpos contra la CSP han impedido el esporozoitos de invadir hepatocitos. CSP [100], por lo tanto, fue elegida como la más prometedora de la proteína Que para desarrollar una vacuna contra la malaria esporozoitos. Es por estas razones históricas que las vacunas basadas en CSP son las más numerosas de todas las vacunas contra la malaria.
Actualmente, existe una gran variedad de vacunas sobre la mesa. Vacunas pre-eritociticas (vacunas que se dirigen a los parásitos antes de que llegue a la sangre), en particular, las vacunas basadas en CSP, forman el mayor grupo de investigación de la vacuna contra la malaria. Otras vacunas: las que tratan de inducir inmunidad a la sangre etapas de la infección, las que tratan de evitar las patologías más severas de la malaria mediante la prevención de la adhesión del parásito a la sangre y la placenta vénulas, y la transmisión de bloqueo de las vacunas que detienen el desarrollo del parásito en el mosquito justo después de que el mosquito ha tomado un poco de sangre de una persona infectada. [101] Es de esperar que la secuenciación del genoma de P. falciparum proporcionará objetivos para nuevos medicamentos o vacunas. [102]
La primera vacuna desarrollada que ha sido objeto de ensayos de campo, es la SPf66, desarrollada por Manuel Elkin Patarroyo, en 1987. Presenta una combinación de antígenos de el esporozoito (utilizando CS repite) y de parásitos de merezoite. Durante los ensayos fase I de un 75% la tasa de eficacia se demostró y la vacuna parece ser bien tolerada por los temas y el inmunogénicas. La fase IIb y III ensayos fueron menos prometedor, con la eficacia a la caída de entre 38,8% y 60,2%. Un ensayo se llevó a cabo en Tanzania en 1993 demuestran la eficacia de ser el 31% después de un año de seguimiento, sin embargo la más reciente (aunque controvertida) en el estudio de Gambia no mostró ningún efecto. A pesar de los relativamente largos períodos de prueba y el número de estudios realizados, aún no se conoce la forma en que la vacuna SPf66 confiere inmunidad, por lo que sigue siendo una improbable solución a la malaria. El PEC fue la siguiente vacuna desarrollada que inicialmente parecía suficiente como para someterse a los ensayos. También se basa en la circumsporozoite proteínas, pero, además, tiene la recombinante (Asn-Ala-Pro15Asn-Val-Asp-Pro) 2-Leu-Arg (R32LR) proteína covalentemente a una toxina purificada Pseudónimas eruginosa (A9). Sin embargo en una fase temprana de una falta total de protección de la inmunidad se demuestra en los inoculados. El grupo de estudio utilizado en Kenia tuvo un 82% de incidencia de la parasitemia, mientras que el grupo de control sólo había un 89% de incidencia. La vacuna contra la intención de provocar un aumento de linfocitos T en la respuesta de los que están expuestos, esta tampoco fue observada.
La eficacia de la vacuna de Patarroyo ha estado en disputa con EE.UU. algunos científicos concluyeron en la revista The Lancet (1997) que "la vacuna no es eficaz y debe suprimirse", mientras que el colombiano acusó de "arrogancia" poner a sus afirmaciones sobre el hecho de que él vino De un país en desarrollo.
La RTS, S/AS02A es la vacuna más candidata , a lo largo de los ensayos de vacunas. Está siendo desarrollado por una alianza entre la PATH Malaria Vaccine Initiative (un concesionario de la Fundación Gates), la empresa farmacéutica GlaxoSmithKline, y el Walter Reed Army Institute of Research [103] en la vacuna, una parte de CSP se ha fundido A la inmunogenicidad "S antígeno" de los virus de la hepatitis B; esta proteína recombinante se inyecta junto a la potente adyuvante AS02A. [101] En octubre de 2004, la RTS, S/AS02A investigadores anunciaron los resultados de un ensayo de fase IIb, con indicación de la vacuna redujo Riesgo de infección en aproximadamente un 30% y la gravedad de la infección en más de un 50%. El estudio examinó más de 2.000 niños de Mozambique. [104] Un más reciente ensayo de la RTS, S/AS02A, la vacuna se ha centrado en la seguridad y la eficacia de su gestión anterior en la infancia: En octubre de 2007, los investigadores anunciaron los resultados de una fase I / IIb juicio realizado sobre 214 lactantes de Mozambique entre las edades de 10 y 18 meses en los que el pleno de tres dosis de la vacuna llevado a un 62% de reducción de la infección sin efectos secundarios graves salvo algo de dolor en el punto de inyección. [ 105] se demora adicional a la investigación de esta vacuna lanzamiento comercial hasta alrededor de 2011. [106]
La revista The Lancet publicó el 16 de octubre de 2004 los resultados iniciales del mayor ensayo clínico de una vacuna contra la malaria en África, en un artículo cuyo autor principal es Pedro Alonso, profesor del Departamento de Salud Pública de la Facultad de Medicina de la Universidad de Barcelona y titular de la Cátedra Unesco del Medio Ambiente y Desarrollo Sostenible en dicha universidad.
Otros métodos
La técnica de los insectos estériles se está perfilando como un posible método de control de mosquitos. El progreso hacia transgénicos, o genéticamente modificados, insectos sugieren que las poblaciones de mosquitos silvestres podrían hacerse resistentes a la malaria. La investigación en el Imperial College de Londres creó el primer mosquito transgénico paludismo, [107] con la primera Plasmodium especies resistentes anunciado por un equipo de la Case Western Reserve University en Ohio, en 2002. [108] El éxito de la sustitución de las poblaciones existentes con poblaciones genéticamente modificados, Se basa en un mecanismo de transmisión, como los elementos trasladables para permitir mendelianos de la herencia de genes de interés.
Educación en el reconocimiento de los síntomas de la malaria ha reducido el número de casos en algunas zonas del mundo en desarrollo tanto como el 20%. Reconocer la enfermedad en las primeras etapas también puede detener la enfermedad se convierta en un asesino. La educación también puede informar a la gente para cubrir más áreas de stagnant, por ejemplo, todavía el agua Tanques de agua, que son caldo de cultivo ideal para el parásito y el mosquito, por lo tanto, reduciendo el riesgo de la transmisión entre las personas. Se trata de poner en la práctica la mayoría en las zonas urbanas donde hay grandes centros de población en un espacio y la transmisión sería más probable es que en estas áreas.
El 22 de diciembre de 2007, la publicación PLoS Patógenos estudio encontró que los pepinos de mar bloquean la transmisión del parásito de la malaria, ya que producen la proteína, lecitina (que retarda el crecimiento de los parásitos). [109]
Antes de DDT, la malaria se ha erradicado o controlado también en varias zonas tropicales mediante la eliminación de la intoxicación o la cría de los mosquitos o de los hábitats acuáticos de las etapas de la larva, por ejemplo, o la aplicación de llenado de aceite a los lugares con agua estancada. Estos métodos han visto poca aplicación en África durante más de medio siglo. [110]
Otra vía para atajar la malaria en el tercer mundo que se ha utilizado extensamente en el pasado para combatir al vector de transmisión es la utilización de insecticidas, como las piretrinas o el DDT. Se prohibió el uso de este último por sus posibles efectos en la salud y en la fauna, pero un grupo de científicos cree que debería revisarse esta prohibición tan estricta.[18] Se considera ahora que un uso medido con fines sanitarios, distinto del uso masivo con fines económicos de que fue objeto en el pasado, es una buena opción para el control o erradicación de la malaria bajo condiciones muy controladas, limitándose al interior de las casas y tejados en las zonas donde esta enfermedad es endémica, según la OMS. Algunos grupos ambientalistas, como la Pesticide Action Network no están de acuerdo con esta medida.[19]
Referencias
- ↑ UNESCO | Education - Día africano de lucha contra el paludismo : un futuro sin paludismo, el tema del Día Africano del Paludismo de este año
- ↑ Joy D, Feng X, Mu J, et al (2003). «Early origin and recent expansion of Plasmodium falciparum.». Science 300 (5617): 318-21. PMID 12690197. [1]
- ↑ Escalante A, Freeland D, Collins W, Lal A (1998). «The evolution of primate malaria parasites based on the gene encoding cytochrome b from the linear mitochondrial genome.». Proc Natl Acad Sci U S A 95 (14): 8124-9. PMID 9653151. [2]
- ↑ Cox F (2002). «History of human parasitology.». Clin Microbiol Rev 15 (4): 595-612. PMID 12364371. [3]
- ↑ «Biography of Alphonse Laveran». The Nobel Foundation. Consultado el 15 de junio de 2007. ] Nobel foundation. Accessed 25 Oct 2006
- ↑ «Ettore Marchiafava». Consultado el 15 de junio de 2007.
- ↑ «Biography of Ronald Ross». The Nobel Foundation. Consultado el 15 de junio de 2007.
- ↑ «Ross and the Discovery that Mosquitoes Transmit Malaria Parasites». CDC Malaria website. Consultado el 15 de junio de 2007.
- ↑ Kaufman T, Rúveda E (2005). «The quest for quinine: those who won the battles and those who won the war.». Angew Chem Int Ed Engl 44 (6): 854-85. PMID 15669029.
- ↑ Kyle R, Shampe M (1974). «Discoverers of quinine». JAMA 229 (4): 462. PMID 4600403.
- ↑ Raju T (2006). «Hot brains: manipulating body heat to save the brain.». Pediatrics 117 (2): e320-1. PMID 16452338.
- ↑ Krotoski W, Collins W, Bray R, et al (1982). «Demonstration of hypnozoites in sporozoite-transmitted Plasmodium vivax infection.». Am J Trop Med Hyg 31 (6): 1291-3. PMID 6816080.
- ↑ Meis J, Verhave J, Jap P, Sinden R, Meuwissen J (1983). «Malaria parasites--discovery of the early liver form.». Nature 302 (5907): 424-6. PMID 6339945.
- ↑ a b c Breman J (2001). «The ears of the hippopotamus: manifestations, determinants, and estimates of the malaria burden.». Am J Trop Med Hyg 64 (1-2 Suppl): 1-11. PMID 11425172.
|year=y|año=redundantes (ayuda) - ↑ Greenwood BM, Bojang K, Whitty CJ, Targett GA (2005). «Malaria». Lancet 365: 1487-1498. PMID 15850634.
- ↑ Rodriguez-Morales AJ, Sanchez E, Vargas M, Piccolo C, Colina R, Arria M, Franco-Paredes C (2006). «Pregnancy outcomes associated with Plasmodium vivax malaria in northeastern Venezuela». Am J Trop Med Hyg 74: 755-757. PMID 16687675.
- ↑ Hay S, Guerra C, Tatem A, Noor A, Snow R (2004). «The global distribution and population at risk of malaria: past, present, and future.». Lancet Infect Dis 4 (6): 327-36. PMID 15172341.
- ↑ [Boseley] Comprueba el valor del
|enlaceautor=(ayuda) (30 de agosto). «Malaria fears over planned DDT ban». The Guardian. Consultado el 27 de julio de 2008. - ↑ [Boseley] Comprueba el valor del
|enlaceautor=(ayuda) (16 de septiembre de 2006). «Banned pesticide backed for malaria control» (artículo periodístico). The Guardian. Consultado el 27 de julio de 2008.
Bibliografía
- Rodríguez Ocaña E, Ballester Añón R, Perdiguero E, Medina Doménech RM, Molero Mesa J. (2003) La acción médico-social contra el paludismo en la España metropolitana y colonial del siglo XX. Madrid: Consejo Superior de Investigaciones Científicas.
- Cueto, Marcos (2007). Cold war, deadly fevers : malaria eradication in Mexico, 1955-1975 / Marcos . Washington, D.C. : Woodrow Wilson Center Press ; Baltimore : Johns Hopkins University Press, c2007.
Enlaces externos
- En MedlinePlus hay más información sobre Malaria
- Malaria Atlas Project
- Posibles vacunas contra la malaria
- Nature Science Update Especial Malaria
- Historia del descubrimiento del vector
- Historia del descubrimiento de la malaria
- OMS-Malaria
- Nuevas vacunas aumentan la esperanza
- Malaria y Embarazo en Latinoamérica
- Colección PlOS de Malaria
- www.malariacontrol.net
- www.malaria.org
- Malaria no more