Usuario:Adriana Raoa/Barrera hematoencefálica
La barrera hematoencefálica (BBB por sus siglas en inglés) es una barrera de permeabilidad altamente selectiva que separa la sangre que circula en el fluido extracelular cerebral (ECF) en el sistema nervioso central (SNC). La barrera hematoencefálica está formada por células cerebrales endoteliales que están conectadas por uniones estrechas con una muy alta resistividad eléctrica de al menos 0.1 Ω⋅m.[1] Ésta barrera permite el paso del agua, algunos gases, y moléculas solubles en lípidos por medio de difusión pasiva, así como el transporte selectivo de moléculas tales como glucosa y aminoácidos que son cruciales para la función neuronal. Por otra parte, la barrera hematoencefálica puede impedir la entrada de lipófilicos, neurotoxinas potenciales, por medio de un mecanismo de transporte activo mediado por la glicoproteína P. Los astrocitos son necesarios para crear ésta barrera. Un pequeño número de regiones en el cerebro, incluyendo los órganos circuventriculares (CVOs), no tienen barrera hematoencefálica.
La barrera hematoencefálica se produce a lo largo de todos los capilares y se compone de uniones estrechas alrededor de los capilares que no existen en la circulación normal.[2] Las células endoteliales restringen la difusión de objetos microscópicos (por ejemplo, bacterias) y moléculas grandes o hidrófilos en el líquido cefalorraquídeo (LCR), al mismo tiempo permiten la difusión de pequeñas moléculas o hidrófobos (O2, CO2, hormonas).[3] Las células de la barrera transportan activamente productos metabólicos tales como la glucosa a través de la barrera con proteínas específicas.[4]
Estructura[editar]
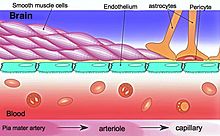
Esta "barrera" resulta de la selectividad de las uniones estrechas entre las células endoteliales en los vasos del sistema nervioso central que restringe el paso de solutos. En la interfaz entre la sangre y el cerebro, las células endoteliales se conectan entre sí por estas uniones estrechas que están compuestos por subunidades más pequeñas, con frecuencia dímeros bioquímicos, que son proteínas transmembranales, tales como la ocludina, claudina, la molécula de adhesión de unión (JAM) y ESAM.[4] Cada una de estas proteínas transmembranales están ancladas a las células endoteliales por medio de otros complejos proteicos como el ZO-1 y otras proteínas asociadas[4]
La barrera hematoencefálica está compuesta de células de alta densidad que restringen el paso de sustancias del torrente sanguíne mucho más de lo que lo hacen las células endoteliales capilares en otras partes del cuerpo. Los pies de astrocito (también conocidos como "limitans glia") rodean las células endoteliales de la BBB, proporcionando apoyo bioquímico a éstas células.[5] La BBB es distinta de la barrera sangre-líquido cefalorraquídeo, que es una función de las células de la coroides del plexo coroide y de la barrera sangre-retina, que se puede considerar una parte de todo el reino de tales barreras.[6]
Varias áreas del cerebro humano no están en el lado del cerebro de la BBB. Algunos ejemplos de estos son los órganos circuventriculares, el techo del tercer y cuarto ventrículo, los capilares de la glándula pineal en el techo del diencéfalo y la glándula pineal. La glándula pineal segrega la hormona melatonina "directamente en la circulación sistémica",[7] por tanto, la melatonina no se ve afectada por la barrera hematoencefálica.[8]
Desarrollo[editar]
Originalmente, los experimentos en la década de 1920 parecían mostrar que la barrera hematoencefálica (BBB) era inmadura en los recién nacidos. La razón de este error fue una falla en la metodología (la presión osmótica era demasiado alta y los delicados vasos capilares embrionarios sufrieron daños parciales). Se informó que con una concentración plasmática elevada en el recién nacido, sustancias naturales tales como la albúmina, α-1-fetoproteína o la transferrina no pudieron ser detectadas fuera de las células en el cerebro. El transportador de la glicoproteína P ya existe en el endotelio embrionario.[9]
Función[editar]
La barrera hematoencefálica actúa de manera eficaz al proteger al cerebro de la mayoría de los patógenos. Por lo tanto, las infecciones del cerebro son muy raras, graves y difíciles de tratar. Los anticuerpos son demasiado grandes para cruzar la BBB, y sólo ciertos antibióticos son capaces de traspasarla.[10] En algunos casos, un fármaco tiene que ser administrado directamente en el líquido cefalorraquídeo (CSF), para que así pueda entrar en el cerebro mediante el cruce de la barrera sangre-líquido cefalorraquídeo.[11][12] Sin embargo, no todos los medicamentos que se entregan directamente en el LCR pueden penetrar eficazmente la barrera CSF y entrar al cerebro. La barrera hematoencefálica es más permeable durante la inflamación. Esto permite a algunos antibióticos y fagocitos moverse a través de la barrera hematoencefálica. Sin embargo, esto también permite que las bacterias y los virus puedan infiltrarse.[10][13]
También hay algunos venenos bioquímicos que se componen de moléculas grandes que no pueden pasar a través de la barrera hematoencefálica. Esto fue especialmente importante en tiempos primitivos, cuando la gente a menudo comía alimentos contaminados. Neurotoxinas tales como botulinia en los alimentos pueden afectar a los nervios periféricos, pero la barrera hematoencefálica a menudo evita que este tipo de toxinas lleguen al sistema nervioso central donde puedencausar daños graves o fatales.[14]
Importancia clínica[editar]
Fármaco objetivo[editar]
La barrera hematoencefálica (BBB) está formada por endotelio capilar cerebral y excluye del cerebro ~ 100% de grandes moléculas neuroterapeuticas y más del 98% de todos los fármacos de moléculas pequeñas.[15] El superar la dificultad de la administración de agentes terapéuticos a regiones específicas del cerebro presenta un reto importante para el tratamiento de la mayoría de los trastornos cerebrales. En su papel neuroprotector, las funciones de la barrera hematoencefálica obstaculizan el suministro de muchos agentes de diagnóstico y terapéuticos potencialmente importantes para el cerebro. Moléculas y anticuerpos terapéuticos que de otro modo podrían ser eficaces en el diagnóstico y terapia no atraviesan la barrera hematoencefálica en cantidades adecuadas.
Mecanismos de focalización de farmácos en el cerebro implican ya sea ir "hacia" o "detrás" de la BBB. Modalidades para la administración de fármacos en ciertas dosis a través de la BBB implican su traspaso por medio osmótico; bioquímicamente por el uso de sustancias vasoactivas tales como la bradiquinina; o incluso por la exposición localizada de ultrasonido focalizado de alta intensidad (HIFU).[16] Otros métodos utilizados para atravesar la BBB implican el uso de sistemas de transporte endógenos, incluyendo transportadores portadores tales como los portadores de glucosa y aminoácidos; mediados por el receptor de transcitosis para insulina o transferrina; y el bloqueo de transportadores de salida activos, tales como la glicoproteína P. Sin embargo, los vectores de orientación de transportadores de BBB, tales como el receptor de la transferrina, se ha encontrado que permanecen atrapados en las células endoteliales de los capilares del cerebro, en vez de ser transportado a través de la BBB en el parénquima cerebral.[17][18] Los métodos para la administración de fármacos detrás de la BBB incluyen la implantación intracerebral (por ejemplo, con agujas) y la distribución potenciada por convección. El manitol se puede utilizar en pasar por la barrea hematoencefálica.
Péptidos[editar]
Los péptidos son capaces de cruzar la barrera hematoencefálica través de diversos mecanismos, lo que ha permitido la apertura de nuevas vías de diagnóstico y terapias.[19] Sin embargo, sus datos de transporte a la BBB se encuentran dispersos en la literatura en diferentes tipos de disciplinas, utilizando metodologías diversas e informes de distintos aspectos de afluencia o salida. Por lo tanto, una base de datos integral de péptidos BBB (Brainpeps) fue construida para recopilar los datos de BBB disponibles en la literatura. La base de datos es una herramienta útil para priorizar las opciones de los péptidos para evaluar diferentes respuestas de BBB o estudiar de manera cuantitativa y estructural las propiedades (BBB comportamiento) de las relaciones de péptidos. Debido a que una multitud de métodos se han utilizado para evaluar el comportamiento de los compuestos de la BBB, se han clasificado estos métodos y sus respuestas. Por otra parte, las relaciones entre los diferentes métodos de transporte de BBB se han aclarado y visualizado.[20]
Enfermedades[editar]
Meningitis[editar]
La meningitis es una inflamación de las membranas que rodean el cerebro y la médula espinal (estas membranas son conocidas como meninges). La meningitis es causada por infecciones por varios patógenos, los ejemplos son Streptococcus pneumoniae y Haemophilus influenzae. Cuando se inflaman las meninges, la barrera hematoencefálica puede ser fracturada.[10] Esta fractura puede aumentar la penetración de varias sustancias (incluyendo cualquier tipo toxina o antibiótico) al cerebro. Los antibióticos que se utilizan para tratar la meningitis pueden agravar la respuesta inflamatoria del sistema nervioso central mediante la liberación de neurotoxinas de las paredes celulares de las bacterias como los lipopolisacáridos (LPS). Dependiendo del patógeno causal, ya sea bacterias, hongos o protozoos se suscribe un tratamiento ya sea de la tercera generación o cuarta generación de cefalosporina oral de anfotericina B.[21]
Absceso cerebral[editar]
Un absceso cerebral al igual que otros abscesos es causado por la inflamación, recolección de células linfáticas y material infeccioso que se originan a partir de una infección local o remota. El absceso cerebral es una enfermedad poco frecuente y potencialmente mortal. Las fuentes locales pueden incluir infecciones del oído, la cavidad bucal, dientes, los senos paranasales, o un absceso epidural. Las fuentes remotas incluyen infecciones en el pulmón, el corazón o el riñón. Un absceso cerebral también puede ser causado por un trauma en la cabeza o por la complicación de una cirugía. En los niños los abscesos cerebrales suelen estar vinculados a una enfermedad cardíaca congénita. [22] En la mayoría de los casos se requiere una terapía antibacteriana de 8-12 semanas.[10]
Epilepsia[editar]
La epilepsia es una enfermedad neurológica común que se caracteriza por convulsiones recurrentes y en ocasiones intratables. Varios datos clínicos y experimentales han implicado el fracaso de la función de barrera hematoencefálica en el desencadenamiento de las convulsiones crónicas o agudas.[23][24][25][26][27] Algunos estudios relacionan a esto la interacción entre una proteína común de la sangre (albúmina) y los astrocitos.[28] Estos hallazgos sugieren que las convulsiones son una consecuencia previsible de la fractura de la BBB ya sea por mecanismos artificiales o inflamatorias. Además, la expresión de moléculas resistentes a fármacos y transportadores en la BBB son un mecanismo importante en la resistencia a los comúnmente usados fármacos antiepilépticos.[29][30]
Esclerosis múltiple[editar]
La esclerosis múltiple (MS) se considera un trastorno autoinmune y neurodegenerativo en el cual el sistema inmune ataca a la mielina que protege y aísla eléctricamente las neuronas del sistemas nerviosos central y periférico. Normalmente, el sistema nervioso de una persona sería inaccesible para las células blancas de la sangre debido a la barrera hematoencefálica. Sin embargo, la resonancia magnética ha demostrado que cuando una persona está pasando por un ataque MS, la barrera sangre-cerebro se ha desglosado en una sección del cerebro o médula espinal, lo que permite a los glóbulos blancos denominados linfocitos T que se crucen y ataquen la mielina. En ocasiones se ha sugerido que en lugar de ser una enfermedad del sistema inmune, la MS es una enfermedad de la barrera hematoencefálica.[31] El debilitamiento de la barrera hematoencefálica puede ser el resultado de una alteración en las células endoteliales en el interior de los vasos sanguíneos, debido a que la producción de la glicoproteína P no está funcionando de manea correcta.[32]
Neuromielitis óptica[editar]
La neuromielitis óptica también conocida como la enfermedad de Devic, es similar a la esclerosis múltiple y a menudo se confunde. Entre otras diferencias se ha identificado un objetivo diferente de la respuesta autoinmune. Los pacientes con neuromielitis óptica tienen altos niveles de anticuerpos contra una proteína llamada acuaporina 4 (un componente de los procesos de los pies de astrocitos en la barrera hematoencefálica).[33]
Enfermedad De Vivo[editar]
La enfermedad de Vivo (también conocido como síndrome de deficiencia de GLUT1) es una enfermedad rara causada por el transporte inadecuado de la glucosa de la azúcar a través de la barrera hematoencefálica, dando lugar a retrasos en el desarrollo y otros problemas neurológicos. Los defectos genéticos en el transportador de glucosa tipo 1 (GLUT1) parece ser la causa primaria de la enfermedad De Vivo.[34][35]
Encefalitis por VIH[editar]
Se cree [36] que el VIH latente puede cruzar la barrera hematoencefálica dentro de monocitos circulantes en el torrente sanguíneo ("teoría caballo de Troya") dentro de los primeros 14 días de la infección. Una vez dentro, estos monocitos se activan y se transforman en macrófagos. Los macrófagos activados liberan viriones en el tejido cerebral en la proximidad de los microvasos cerebrales. Estas partículas virales probablemente atraen la atención de la microglia centinela del cerebro y los macrófagos perivasculares inician una cascada inflamatoria que puede causar una señalización intracelular en las células endoteliales microvasculares del cerebro y así dañar la integridad funcional y estructural de la BBB.[37]
Inflamación sistemática[editar]
La inflamación en el cuerpo puede dar lugar a efectos en el cerebro a través de la barrera hematoencefálica (BBB). Durante la inflamación sistémica ya sea en forma de infección o inflamación estéril, la BBB puede sufrir cambios que pueden ser perjudiciales o no disruptivos.[38] Tales cambios pueden ser parte de una respuesta del huésped a la inflamación sistemática o pueden conducir a consecuencias perjudiciales en el sistema nervioso central. Estos cambios en la BBB probablemente juegan un papel en la generación de los comportamientos de la enfermedad durante la infección sistemática (por lo que nos sentimos "mal" cuando tenemos una infección).
Historia[editar]
Paul Ehrlich era un bacteriólogo que estudio la tinción, un procedimiento que se utiliza en muchos estudios microscópicos para hacer visibles estructuras biológicas finas usando tintes químicos. Ehrlich inyectaba algunos de estos colorantes (en particular los tintes de anilina, que luego fueron utilizados ampliamente), el colorante teñía todos los órganos de algunos tipos de animales a excepción de sus cerebros. En ese momento, Ehrlich atribuyó esta falta en la tinción a que el cerebro simplemente no recopilaba la cantidad suficiente tinte.[39]
Sin embargo, en un experimento posterior en 1913, Edwin Goldmann (uno de los estudiantes de Ehrlich) inyectó directamente el colorante en los fluidos cerebro-espinal de los cerebros de los animales. Encontró que en este caso el cerebro se tiñó, pero el resto del cuerpo no. Esto demostró claramente la existencia de algún tipo de compartimiento entre los dos. En ese momento, se pensó que los mismos vasos sanguíneos eran los responsables de la barrera, ya que obviamente no se pudo encontrar la membrana. El concepto de la BBB (a continuación denominada barrera hematoencefálica) fue propuesto por un médico de Berlín, Lewandowsky, en 1900.[40] No fue hasta la introducción del microscopio electrónico de barrido en la década de 1960 que la membrana real fue observada y comprobada como tal.
Véase también[editar]
Referencias[editar]
- ↑ Arthur M. Butt, Hazel C. Jones, and N. Joan Abbott (1990). «Electrical resistance across the blood–brain barrier in anaesthetized rats: a developmental study». Journal of Physiology 429: 47-62. PMID 2277354. doi:10.1113/jphysiol.1990.sp018243.
- ↑ Helga E. de Vries, Johan Kuiper, Albertus G. de Boer, Theo J. C. Van Berkel and Douwe D. Breimer (1997). «The Blood-Brain Barrier in Neuroinflammatory Diseases». Pharmacological Reviews 49 (2): 143-156. PMID 2277354. doi:10.1113/jphysiol.1990.sp018243.
- ↑ «About». Blood Brain Barrier. Johns Hopkins University. Consultado el 7 de mayo de 2013.
- ↑ a b c Stamatovic, SM (2008). «Brain Endothelial Cell-Cell Junctions: How to "Open" the Blood Brain Barrier». Current Neuropharmacology 6 (3): 179-192. PMC 2687937. PMID 19506719. doi:10.2174/157015908785777210.
- ↑ Joan Abbott, N.; Rönnbäck, Lars; Hansson, Elisabeth (2006). «Astrocyte-endothelial interactions at the blood–brain barrier». Nature Reviews Neuroscience 7: 41-53. doi:10.1038/nrn1824.
- ↑ Hamilton RD, Foss AJ, Leach L (2007). «Establishment of a human in–vitro model of the outer blood–retinal barrier». Journal of Anatomy 211 (6): 707-16. PMC 2375847. PMID 17922819. doi:10.1111/j.1469-7580.2007.00812.x.
- ↑ Pritchard, Thomas C.; Alloway, Kevin Douglas (1999). Medical Neuroscience (Google books preview). Hayes Barton Press. pp. 76-77. ISBN 1-889325-29-5. Consultado el 8 de febrero de 2009.
- ↑ Gilgun-Sherki, Yossi; Melamed, Eldad; Offen, Daniel (2001). «Oxidative stress induced-neurodegenerative diseases: the need for antioxidants that penetrate the blood brain barrier». Neuropharmacology 40 (8): 959-975. ISSN 0028-3908. PMID 11406187. doi:10.1016/S0028-3908(01)00019-3.
- ↑ Tsai, C.E.; Daood, M.J.; Lane, R.H.; Hansen, T.W.R; Gruetzmacher, E.M.; Watchko, J.F. (2002). «P-Glycoprotein Expression in Mouse Brain Increases with Maturation». Neonatology 81 (1): 58-64. doi:10.1159/000047185.
- ↑ a b c d Raza, MW; Shad, A; Pedler, SJ; Karamat, KA (2005). «Penetration and activity of antibiotics in brain abscess». Journal of the College of Physicians and Surgeons--Pakistan : JCPSP 15 (3): 165-7. PMID 15808097.
- ↑ Pardridge, William M (2011). «Drug transport in brain via the cerebrospinal fluid». Fluids Barriers CNS 8: 7. PMC 3042981. PMID 21349155. doi:10.1186/2045-8118-8-7.
- ↑ Chen, Y (2013). «Novel modified method for injection into the cerebrospinal fluid via the cerebellomedullary cistern in mice». Acta Neurobiologiae Experimentalis 73 (2): 304-11. PMID 23823990.
- ↑ Tortora, Gerard J.; Berdell R. Funke; Christine L. Case (2010). Microbiology: An Introduction. San Francisco: Benjamin Cummings. p. 439,611. ISBN 0-321-55007-2.
- ↑ Tortora, Gerard J.; Berdell R. Funke; Christine L. Case (2010). Microbiology: An Introduction. San Francisco: Benjamin Cummings. pp. 616-618. ISBN 0-321-55007-2.
- ↑ Pardridge, William M. - The Blood-Brain Barrier: Bottleneck in Brain Drug Development - 2 January 2005. Retrieved 5 February 2014.
- ↑ McDannold, Nathan; Vykhodtseva, Natalia; Hynynen, Kullervo (May 2008). «Blood–brain barrier disruption induced by focused ultrasound and circulating preformed microbubbles appears to be characterized by the mechanical index». Ultrasound in Medicine and Biology (Elsevier) 34 (5): 834-840. PMC 2442477. PMID 18207311. doi:10.1016/j.ultrasmedbio.2007.10.016.
- ↑ Wiley, Devin (2013). «Transcytosis and brain uptake of transferrin-containing nanoparticles by tuning avidity to transferrin receptor.». Proc Natl Acad Sci U S A 110 ((21)): 8662-7. PMC 3666717. PMID 23650374. doi:10.1073/pnas.1307152110.
- ↑ Paris-Robidas S, Emond V, Tremblay C, Soulet D, Calon F (July 2011). «In vivo labeling of brain capillary endothelial cells after intravenous injection of monoclonal antibodies targeting the transferrin receptor». Molecular Pharmacology 80 (1): 32-9. PMID 21454448. doi:10.1124/mol.111.071027.
- ↑ Van Dorpe, S; Bronselaer, A; Nielandt, J; Stalmans, S; Wynendaele, E; Audenaert, K; Wiele, C; Burvenich, C; Peremans, K; Hsuchou, H; Tré, G; Spiegeleer, B (2012). «Brainpeps: The blood–brain barrier peptide database». Brain structure & function 217 (3): 687-718. PMID 22205159. doi:10.1007/s00429-011-0375-0.
- ↑ «Transport at the Blood Brain Barrier». Davis Lab. Consultado el 5 January 2015.
- ↑ Tortora, Gerard J.; Berdell R. Funke; Christine L. Case (2010). Microbiology: An Introduction. San Francisco: Benjamin Cummings. p. 615. ISBN 0-321-55007-2.
- ↑ Nordqvist, Christian (16 de abril de 2010). «What Is A Brain Abscess (Cerebral Abscess)?». MNT Knowledge Center. Medical News Today. Archivado desde el original el 18 de abril de 2010.
- ↑ Oby, Emily; Janigro, Damir (2006). «The Blood–Brain Barrier and Epilepsy». Epilepsia 47 (11): 1761-1774. ISSN 0013-9580. PMID 17116015. doi:10.1111/j.1528-1167.2006.00817.x.
- ↑ Marchi, Nicola; Angelov, Lilyana; Masaryk, Thomas; Fazio, Vincent; Granata, Tiziana; Hernandez, Nadia; Hallene, Kerri; Diglaw, Tammy; Franic, Linda; Najm, Imad; Janigro, Damir (2007). «Seizure-Promoting Effect of Blood?Brain Barrier Disruption». Epilepsia 48 (4): 732-42. PMID 17319915. doi:10.1111/j.1528-1167.2007.00988.x.
- ↑ Seiffert, E.; Dreier, JP; Ivens, S; Bechmann, I; Tomkins, O; Heinemann, U; Friedman, A (2004). «Lasting Blood-Brain Barrier Disruption Induces Epileptic Focus in the Rat Somatosensory Cortex». Journal of Neuroscience 24 (36): 7829-36. PMID 15356194. doi:10.1523/JNEUROSCI.1751-04.2004.
- ↑ Uva, L.; Librizzi, L.; Marchi, N.; Noe, F.; Bongiovanni, R.; Vezzani, A.; Janigro, D.; De Curtis, M. (2008). «Acute induction of epileptiform discharges by pilocarpine in the in vitro isolated guinea-pig brain requires enhancement of blood–brain barrier permeability». Neuroscience 151 (1): 303-12. PMC 2774816. PMID 18082973. doi:10.1016/j.neuroscience.2007.10.037.
- ↑ Van Vliet, E. A.; Da Costa Araujo, S.; Redeker, S.; Van Schaik, R.; Aronica, E.; Gorter, J. A. (2007). «Blood–brain barrier leakage may lead to progression of temporal lobe epilepsy». Brain 130 (2): 521-534. doi:10.1093/brain/awl318.
- ↑ Ivens, S.; Kaufer, D.; Flores, L. P; Bechmann, I.; Zumsteg, D.; Tomkins, O.; Seiffert, E.; Heinemann, U. et al. (2007). «TGF-beta receptor-mediated albumin uptake into astrocytes is involved in neocortical epileptogenesis». Brain 130 (Pt 2): 535-47. PMID 17121744. doi:10.1093/brain/awl317.
- ↑ Awasthi, Sanjay; Hallene, Kerri L; Fazio, Vince; Singhal, Sharad S; Cucullo, Luca; Awasthi, Yogesh C; Dini, Gabriele; Janigro, Damir (2005). «RLIP76, a non-ABC transporter, and drug resistance in epilepsy». BMC Neuroscience 6: 61. PMC 1249579. PMID 16188027. doi:10.1186/1471-2202-6-61.
- ↑ Löscher, Wolfgang; Potschka, Heidrun (2005). «Drug resistance in brain diseases and the role of drug efflux transporters». Nature Reviews Neuroscience 6 (8): 591-602. PMID 16025095. doi:10.1038/nrn1728.
- ↑ Waubant, Emmanuelle (2006). «Biomarkers indicative of blood–brain barrier disruption in multiple sclerosis». Disease Markers 22 (4): 235-44. PMC 3850823. PMID 17124345. doi:10.1155/2006/709869.
- ↑ Schinkel AH (April 1999). «P-Glycoprotein, a gatekeeper in the blood–brain barrier». Advanced Drug Delivery Reviews 36 (2-3): 179-194. PMID 10837715. doi:10.1016/S0169-409X(98)00085-4.
- ↑ Lennon, V. A.; Kryzer, TJ; Pittock, SJ; Verkman, AS; Hinson, SR (August 2005). «IgG marker of optic-spinal multiple sclerosis binds to the aquaporin-4 water channel». J. Exp. Med. 202 (4): 473-7. PMC 2212860. PMID 16087714. doi:10.1084/jem.20050304.
- ↑ Pascual, J.; Wang, D; Lecumberri, B; Yang, H; Mao, X; Yang, R; De Vivo, DC (May 2004). «GLUT1 deficiency and other glucose transporter diseases». European journal of endocrinology 150 (5): 627-33. PMID 15132717. doi:10.1530/eje.0.1500627.
- ↑ Klepper, Jörg; Voit, Thomas (June 2002). «Facilitated glucose transporter protein type 1 (GLUT1) deficiency syndrome: impaired glucose transport into brain—a review». European journal of pediatrics 161 (6): 295-304. PMID 12029447. doi:10.1007/s00431-002-0939-3.
- ↑ Williams, Kenneth C.; Hickey, William F. (2002). «CENTRALNERVOUSSYSTEMDAMAGE, MONOCYTES ANDMACROPHAGES, ANDNEUROLOGICALDISORDERS INAIDS». Annual Review of Neuroscience 25 (1): 537-562. ISSN 0147-006X. PMID 12052920. doi:10.1146/annurev.neuro.25.112701.142822.
- ↑ Ivey, Nathan S; MacLean, Andrew G; Lackner, Andrew A (2009). «AIDS and the Blood Brain Barrier». Journal of Neurovirology 2 (2): 111-122. PMC 2744422. PMID 19306229. doi:10.1080/13550280902769764.
- ↑ Varatharaj, Aravinthan; Galea, Ian (16 de marzo de 2016). «The blood-brain barrier in systemic inflammation». Brain, Behavior, and Immunity. ISSN 1090-2139. PMID 26995317. doi:10.1016/j.bbi.2016.03.010.
- ↑ «History of Blood-Brain Barrier». Davis Lab. Consultado el 5 January 2015.
- ↑ «History of Blood-Brain Barrier». The Davis Lab. University of Arizona. Archivado desde el original el 25 de abril de 2012. Consultado el 1 de marzo de 2014.
Otras lecturas[editar]
- Interlandi, Jeneen (2013). «"Messing With" the Blood-Brain Barrier May Be Key to Treating a Host of Diseases». Scientific American 2013 (June). Consultado el 6 June 2013.
- Shityakov, S., Salvador, E., Förster, C. In silico, in vitro, and in vivo methods to analyse drug permeation across the blood–brain barrier: A critical review. OA Anaesthetics 2013, 1(2):13. [1]
- Derricott, Caitlin (2015). «Using water–solvent systems to estimate in vivo blood–tissue partition coefficients». Chemistry Central 9 (58). Consultado el 16 October 2015.
