Reacción de inserción
Una reacción de inserción es una reacción química donde una entidad química (una molécula o fragmento molecular) se inserta en un enlace existente dando una segunda entidad química:
- A + B–C → B–A–C
El término sólo se refiere al resultado de la reacción y no sugiere un mecanismo. Se encuentran reacciones de inserción en la química orgánica, inorgánica y organometálica. En los casos en los que haya un enlace metal-ligando en un complejo de coordinación, estas reacciones son típicamente organometálicas e involucran un enlace entre un metal de transición y un carbono o hidrógeno.[1] Por lo general se reserva para el caso en que el número de coordinación y el estado de oxidación del metal permanecen sin cambios.[2] Cuando estas reacciones son reversibles, la eliminación de la pequeña molécula a partir de la unión de metal-ligando se denomina extrusión o eliminación.

Hay dos geometrías de inserción comunes (1,1 y 1,2 en la foto). Además, la molécula de inserción puede actuar ya sea como un nucleófilo o como un electrófilo frente al complejo de metal.[2] Estos comportamientos se discutirán con más detalle para el CO, de comportamiento nucleófilo.
Química orgánica[editar]
Las reacciones de homologación como la homologación éster de Kowalski[3] proporcionan ejemplos simples del proceso de inserción en la síntesis orgánica. En la reacción de Arndt-Eistert,[4][5] una unidad de metileno se inserta en el enlace carbono-carboxilo del ácido carboxílico para formar el siguiente ácido en la serie homóloga. Organic Syntheses proporciona el ejemplo:[6]
La (S)-fenilalanina (ácido 2-amino-3-fenilpropanoico) protegida con un grupo t-Boc se hacen reaccionar secuencialmente con trietilamina, cloroformiato de etilo, y diazometano para producir el α-diazocetona, que luego se hace reaccionar con trifluoroacetato de plata/trietilamina en disolución acuosa para generar la forma protegida t-BOC de ácido (S)-3-amino-4-fenilbutanoico.
Una transformación similar es la reacción de Nierenstein en la que se inserta un grupo metileno de un diazometano en el enlace carbono-cloro de un cloruro de ácido para generar una cetona α-clorometílica.[7][8] Un ejemplo, publicado en 1924, ilustra la reacción en un sistema de cloruro de benzoilo sustituido:[9]
La transposición de Beckmann[10][11] es otro ejemplo de una reacción de expansión de anillo en la que se inserta un heteroátomo en un enlace carbono-carbono. La aplicación más importante de esta reacción es la conversión de ciclohexanona a su oxima, que luego se reordena en condiciones ácidas para proporcionar la ε-caprolactama,[12] materia prima para la fabricación de Nylon-6. La producción anual de caprolactama es superior a los 2.000 millones de kilogramos.[13]
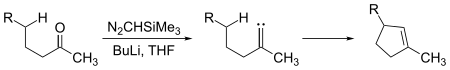
Los carbenos se someten tanto a las reacciones de inserción intermoleculares como intramoleculares. Fragmentos de ciclopenteno pueden generarse a partir de cetonas de cadena suficientemente larga por reacción con trimetilsilildiazometano, (CH3)3Si–CHN2:
Aquí, el intermedio carbeno se inserta en un enlace carbono-hidrógeno para formar el enlace carbono-carbono necesario para cerrar el anillo de ciclopenteno. Las inserciones de carbeno en enlaces carbono-hidrógeno también pueden ocurrir intermolecularmente:
Química organometálica[editar]
Inserción de carbeno a M-H o M-X[editar]
Las inserciones a enlaces metal-carbono (M-C) se evitan, ya que las inserciones a enlaces metal-hidrógeno (M-H) o metal-halógeno (M-X) están fuertemente favorecidas:[14]
Inserción migratoria[editar]
Muchas de las reacciones en la química organometálica implican la inserción de un ligando en un enlace metal-hidruro (M-H) o metal-alquilo/arilo (M-R). Generalmente es el grupo hidruro, alquilo, o arilo (L) el que migra a un CO, un alqueno, o un alquino.
Carbonilaciones[editar]
La inserción de monóxido de carbono en enlaces metal-carbono (M-C) es una reacción ampliamente conocida con importantes aplicaciones industriales.[14][15]

Inserción de olefinas[editar]
La inserción de olefinas a enlaces M-C o M-H es ampliamente conocida. Cabe destacar la inserción de etileno y propileno en alquilos de titanio, que es la piedra angular de la catálisis de Ziegler-Natta, de la síntesis industrial de polietileno y polipropileno. Esta tecnología consiste principalmente en catalizadores heterogéneos, pero en general se asume que los principios y observaciones sobre sistemas homogéneos son aplicables a las versiones de estado sólido. Tecnologías relacionadas incluyen el Proceso SHOP que produce precursores detergentes.[16] la olefina puede ser coordinada con el metal antes de la inserción. Dependiendo de la densidad del ligando del metal, para la disociación de éste puede ser necesario proporcionar un sitio o hueco de coordinación para la olefina.[17]

Referencias[editar]
- ↑ Douglas, McDaniel, and Alexander (1994). Concepts and Models of Inorganic Chemistry 3rd Ed. John Wiley & Sons, Inc. ISBN 978-0-471-62978-8.
- ↑ a b J.J. Alexander (1985). Hartley and Patai, ed. Insertions into transition metal-carbon bonds. John Wiley & Sons.
- ↑ (1993) "Ethyl 1-Naphthylacetate: Ester Homologation Via Ynolate Anions". Org. Synth. 71: 146; Coll. Vol. 9: 426.
- ↑ Arndt, F.; Eistert, B. (1935). «Ein Verfahren zur Überführung von Carbonsäuren in ihre höheren Homologen bzw. deren Derivate». Ber. Dtsch. Chem. Ges. (en alemán) 68 (1): 200-208. doi:10.1002/cber.19350680142.
- ↑ Ye, T.; McKervey, M. A. (1994). «Organic Synthesis with α-Diazo Carbonyl Compounds». Chem. Rev. 94 (4): 1091-1160. doi:10.1021/cr00028a010.
- ↑ (2002) "(S)-3-(tert-Butyloxycarbonylamino)-4-phenylbutanoic acid". Org. Synth. 79; Coll. Vol. 10: 194.
- ↑ Clibbens, D. A.; Nierenstein, M. (1915). «The Action of Diazomethane on some Aromatic Acyl Chlorides». J. Chem. Soc., Trans. 107: 1491-1494. doi:10.1039/CT9150701491.
- ↑ Bachmann, W. E.; Struve, W. S. (1942). «The Arndt-Eistert Reaction». Org. React. 1: 38.
- ↑ Nierenstein, M.; Wang, D. G.; Warr, J. C. (1924). «The Action of Diazomethane on some Aromatic Acyl Chlorides II. Synthesis of Fisetol». J. Amer. Chem. Soc. 46 (11): 2551-2555. doi:10.1021/ja01676a028.
- ↑ Beckmann, E. (1886). «Zur Kenntniss der Isonitrosoverbindungen». Ber. Dtsch. Chem. Ges. (en alemán) 19: 988-993. doi:10.1002/cber.188601901222.
- ↑ Gawley, R. E. (1988). «The Beckmann Reactions: Rearrangement, Elimination-Additions, Fragmentations, and Rearrangement-Cyclizations.». Org. React. 35: 14-24. doi:10.1002/0471264180.or035.01.
- ↑ (1939) "ε-Benzoylaminocaproic acid". Org. Synth. 19; Coll. Vol. 2: 76.
- ↑ Ritz, J.; Fuchs, H.; Kieczka, H.; Moran, W. C. (2000). «Caprolactam». Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a05_031.
- ↑ a b Elschenbroich, C. ”Organometallics” (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ↑ Hartwig, J. F. Organotransition Metal Chemistry, from Bonding to Catalysis; University Science Books: New York, 2010. ISBN 1-891389-53-X
- ↑ Crabtree, R. H. (2009). The Organometallic Chemistry of the Transition Metals. John Wiley and Sons. p. 19–25. ISBN 978-0-470-25762-3.
- ↑ Kissin, Y. V. (2008). «Synthesis, Chemical Composition, and Structure of Transition Metal Components and Cocatalysts in Catalyst Systems for Alkene Polymerization». Alkene Polymerization Reactions with Transition Metal Catalysts. Amsterdam: Elsevier. pp. 207-290. ISBN 978-0-444-53215-2.