Morfolina
| Morfolina | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| morfolina | ||
| General | ||
| Otros nombres |
Óxido de dietilenimida 1,4-oxazinano tetrahidro-1,4-oxazina Dietileno imidóxido Dietileno oximida Tetrahidro-p-oxazina | |
| Fórmula estructural |
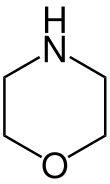 | |
| Fórmula molecular | C4H9NO | |
| Identificadores | ||
| Número CAS | 110-91-8[1] | |
| Número RTECS | QD6475000 | |
| ChEBI | 34856 | |
| ChEMBL | 276518 | |
| ChemSpider | 13837537 | |
| DrugBank | 13669 | |
| PubChem | 8083 | |
| UNII | 8B2ZCK305O | |
| KEGG | C14452 | |
|
C1CNCCO1
| ||
| Propiedades físicas | ||
| Olor | Ligeramente amoniacal | |
| Densidad | 1007 kg/m³; 1,007 g/cm³ | |
| Masa molar | 87,068 g/mol | |
| Punto de fusión | −5 °C (268 K) | |
| Punto de ebullición | 129 °C (402 K) | |
| Propiedades químicas | ||
| Acidez | 8.36[2] (o del ácido conjugado) pKa | |
| Peligrosidad | ||
| Frases R | R10; R20/21/22; R34 | |
| Frases S | S1/2; S23; S36; S45 | |
| Riesgos | ||
| LD50 |
1220 mg/kg (mamífero, oral) 525 mg/kg (ratón, oral) 1050 mg/kg (rata, oral) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La morfolina es un compuesto químico orgánico de fórmula O(CH
2CH
2)
2NH. Este heterociclo, cuya imagen se muestra a la derecha, contiene tanto el grupo funcional amino como el éter. Debido a la posesión del grupo amina, la morfolina es una base; su conjugado ácido recibe el nombre de morfolinio. Por ejemplo, el tratamiento de morfolina con ácido clorhídrico da la sal de cloruro de morfolinio.
Síntesis[editar]
La morfolina puede sintetizarse por la deshidratación de la dietanolamina con ácido sulfúrico: [3]
Usos[editar]
Aplicaciones industriales[editar]
La morfolina es un aditivo común, que se añade a concentraciones de partes por millón (ppm), para ajustar el pH tanto en combustibles fósiles como en sistemas de vapor de las centrales nucleares. El uso de morfolina se debe a que su volatilidad es similar a las del agua, de forma que, una vez añadido al agua, su concentración se distribuye ampliamente en las dos fases líquida y gaseosa del agua. Sus cualidades para ajuste del pH hacen que se utilice en plantas de vapor para prevenir la corrosión.
La morfolina es a menudo utilizado junto con bajas concentración de hidracina o amoníaco en tratamientos químicos de compresión de compuestos volátiles para prevenir la corrosión de sistemas de vapor en dichas plantas. La morfolina se descompone con relativa lentitud en ausencia de oxígeno a altas temperaturas y presiones en estos sistemas de vapor.
Síntesis orgánica[editar]
La morfolina puede sufrir la mayoría de las reacciones químicas típicas de aminas secundarias, aunque la presencia del oxígeno del grupo éter atrae los electrones del nitrógeno, dejándolo menos nucleofílico y menos básico que aminas secundarias estructuralmente similares como la piperidina. Por este motivo forma una cloramina estable (CAS#23328-69-0).[4]
Es comúnmente utilizado para generar enaminas.[5]
La morfolina es ampliamente usado en síntesis orgánica. Por ejemplo, es un compuesto de síntesis de partida en la preparación del antibiótico linezolid, el agente anticancerígeno gefitinib (Iressa) y el analgésico dextromoramida.
En investigación e industria, el bajo coste y la polaridad de la morfolina hacen que un uso común sea el de solvente de reacciones químicas.
Productores[editar]
La mayoría (como se muestra arriba) están extendidos por Europa y Estados Unidos; de acuerdo con ellos, puede cubrir tanto el mercado propio como el de exportación.
Agricultura[editar]
Como cubierta protectora de fruta[editar]
La morfolina se usa como emulsificante químico el proceso de encerado de fruta. De forma natural, las frutas fabrican ceras para protegerse contra los insectos y los hongos, pero puede perderse al ser limpiada. Una pequeña cantidad de cera se le aplica para reemplazar a la cera natural. La morfolina se usa también como emulsificante y solubilizante de la laca que se utiliza como cera para fruta. [6]
Referencias[editar]
- ↑ Número CAS
- ↑ Hall, H.K. (1957). J. Am. Chem. Soc. 79 (20): 5441. doi:10.1021/ja01577a030.
- ↑ Klaus Weissermel, Hans-Jürgen Arpe, Charlet R. Lindley, Stephen Hawkins (2003). «Chap. 7. Oxidation Products of Ethylene». Industrial Organic Chemistry. Wiley-VCH. pp. 159-161. ISBN 3-527-30578-5.
- ↑ Lindsay Smith, J. R.; McKeer, L. C.; Taylor, J. M. (1993). "4-Chlorination of Electron-Rich Benzenoid Compounds: 2,4-Dichloromethoxybenzene". Org. Synth.; Coll. Vol. 8: 167.
- ↑ Noyori, R.; Yokoyama, K.; Hayakawa, Y. (1988). "Cyclopentenones from α,α'-Dibromoketones and Enamines: 2,5-Dimethyl-3-Phenyl-2-Cyclopenten-1-one". Org. Synth.; Coll. Vol. 6: 520.
- ↑ Raymond G. McGuire; Dimitrios A. Dimitroglou (1999). «Evaluation of Shellac and Sucrose Ester Fruit Coating Formulations that Support Biological Control of Post-harvest Grapefruit Decay». Bio-control Science and Technology 9 (1): 53-65.
