Isocianato de metilo
| Isocianato de metilo | ||
|---|---|---|
  | ||
 | ||
| Nombre IUPAC | ||
| isocianato de metilo | ||
| General | ||
| Otros nombres | éster metílico del ácido isociánico, metil isocianato | |
| Fórmula estructural | CH3NCO | |
| Fórmula molecular | C2H3NO | |
| Identificadores | ||
| Número CAS | 624-83-9[1] | |
| Número RTECS | NQ9450000 | |
| ChEBI | 59059 | |
| ChEMBL | CHEMBL1608558 | |
| ChemSpider | 11727 | |
| DrugBank | 12765 | |
| UNII | C588JJ4BV9 | |
| Propiedades físicas | ||
| Apariencia | incoloro | |
| Densidad | 960 kg/m³; 0,96 g/cm³ | |
| Masa molar | 57,052 g/mol | |
| Punto de fusión | −80/273,15 K (−353/0 °C) | |
| Punto de ebullición | 39/273,15 K (−234/0 °C) | |
| Estructura cristalina | p | |
| Propiedades químicas | ||
| Solubilidad en agua | reacciona con el agua | |
| Peligrosidad | ||
| Punto de inflamabilidad | −7/273 K (−280/0 °C) | |
| NFPA 704 |
3
4
2
| |
| Temperatura de autoignición | 535/273 K (262/0 °C) | |
| Frases R | R12-R23/24/25-R36/37/38 | |
| Frases S | S1/2-S9-S30-S43-S45 | |
| Riesgos | ||
| Ingestión | Dolor abdominal, sensación de quemazón, shock o colapso. | |
| Inhalación | Tos, dificultad respiratoria, jadeo, dolor de garganta, vómitos. | |
| Piel | Puede absorberse. Enrojecimiento, dolor, sensación de quemazón. | |
| Ojos | Dolor, enrojecimiento, pérdida de visión. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El isocianato de metilo (MIC) es un compuesto orgánico con fórmula molecular C2H3NO. Su principal uso industrial es la fabricación de pesticidas.
Producción[editar]
El isocianato de metilo es normalmente sintetizado a partir de la reacción de monometilamina y fosgeno. Para una producción a gran escala es conveniente combinar los reactivos a altas temperaturas en fase gaseosa. Una mezcla de metil isocianato y dos moles de ácido clorhídrico forma cloruro de N-metilcarbamoil (MCC). Esta mezcla es condensada, dejando un mol de ácido clorhídrico como gas.
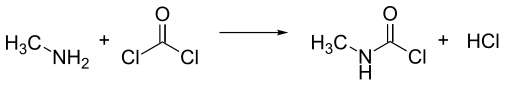
El isocianato de metilo se obtiene por tratamiento del MCC con una amina terciaria, como dimetilanilina o piridina. También se puede obtener por separación utilizando algunas técnicas de destilación.

Reacciones químicas[editar]
El isocianato de metilo reacciona rápidamente con muchas sustancias que contienen grupos N-H u O-H. Con agua, forma 1,3-dimetilurea y dióxido de carbono con la evolución del calor (1358,5 julios, o 325 calorías, por gramo de MIC):

A 25 °C, en exceso de agua, la mitad del MIC se consume en 9 minutos;[2] si el calor no se elimina de manera eficiente de la mezcla de reacción, la velocidad de la reacción aumentará y hará que el MIC hierva rápidamente. Tal reacción desencadenó el desastre de Bhopal después de que accidentalmente se introdujera agua en un tanque de almacenamiento de MIC durante la operación de limpieza de una tubería adyacente sin cerrar la válvula de aislamiento adecuada del depósito. La consecuencia del proceso exotérmico fuera de control fue una reacción descontrolada y la liberación directa de 42 toneladas de MIC a la atmósfera.
Si el MIC está en exceso, se forma 1,3,5-trimetilbiuret junto con dióxido de carbono.[3] Los alcoholes y fenoles, que contienen un grupo O-H, reaccionan lentamente con MIC, pero la reacción puede ser catalizada por trialquilaminas o dicarboxilato de dialquilestaño. Las oximas, las hidroxilaminas y los enoles también reaccionan con MIC para formar metilcarbamatos.[3] Estas reacciones producen los productos que se describen a continuación.
El amoníaco y las aminas primarias y secundarias reaccionan rápidamente con MIC para formar ureas sustituidas. Otros compuestos de N-H, como las amidas y las ureas, reaccionan mucho más lentamente con el MIC.[4]
También reacciona consigo mismo para formar un trímero o polímeros de mayor peso molecular. En presencia de catalizadores, el MIC reacciona consigo mismo para formar un trímero sólido, isocianurato de trimetilo o un polímero de mayor peso molecular:

El metóxido de sodio, la trietilfosfina, el cloruro férrico y algunos otros compuestos metálicos catalizan la formación del trímero MIC, mientras que ciertas trialquilaminas catalizan la formación del polímero de alto peso molecular. Dado que la formación del trímero MIC es exotérmica (1246 julios o 298 calorías por gramo de MIC), la reacción puede provocar una ebullición violenta del MIC. El polímero de alto peso molecular se hidroliza en agua caliente para formar el isocianurato de trimetilo. Dado que las sales de metales catalíticos pueden formarse a partir de impurezas en acero y MIC de grado comercial, este producto no debe almacenarse en tambores o tanques de acero.[12][3]
Toxicidad[editar]
El isocianato de metilo (MIC en inglés) es extremadamente tóxico y el valor límite de exposición según la ACGIH es de 0.02 ppm. El MIC es tóxico por inhalación, ingesta y al contacto en concentraciones mínimas, incluso 0.4 ppm. Los síntomas de exposición son tos, dolor en el pecho, disnea, asma, irritación de los ojos, nariz y garganta, así como daño en la piel. Niveles de exposición elevados, superiores a 21 ppm, pueden causar en bronquitis, edema, enfisema y hemorragias en los pulmones, así como la muerte. Si bien olor del isocianato de metilo no es perceptible para la mayoría de la gente en concentraciones de 5 ppm, la irritación de ojos, ya que el MIC es un potente agente lacrimógeno, es un excelente signo de su presencia en el aire, en concentraciones de 2-4 ppm, y a 21 ppm las personas son incapaces de tolerarlo.[5]
El isocianato de metilo se debe almacenar con sumo cuidado ya que se polimeriza de forma exotérmica con facilidad y tiene una sensibilidad similar a la del agua. Por seguridad, solo se deben usar contenedores de acero inoxidable o vidrio; el MIC se tiene que almacenar a temperaturas menores a 40 C.
Accidentes asociados a este compuesto[editar]
Debido a un error humano (se ignoró la inversión en equipos de mantenimiento) se produjo un accidente en Bhopal, India, en donde Union Carbide tenía una planta en la que tenía tanques de almacenamiento subterráneos de los que se fugaron 42 000 kg de isocianato de metilo y otros gases en un área poblada el 3 de diciembre de 1984. La toxicidad del MIC se hizo evidente tras el desastre de 1984. 3500 personas murieron inmediatamente, 8000 en las primeras 48 horas y 15 mil más en los siguientes años. 200 mil personas tuvieron complicaciones a largo plazo por el desastre.[6][7]
Referencias[editar]
- ↑ Número CAS
- ↑ Castro EA, Moodie RB, Sansom PJ (1985). «The kinetics of hydrolysis of methyl and phenyl isocyanates». Journal of the Chemical Society, Perkin Transactions 2 1985 (5): 737-742. doi:10.1039/P29850000737.
- ↑ a b c Union Carbide Corporation "Methyl Isocyanate" Product Information Publication, F-41443, November 1967.
- ↑ March J (1985). Advanced Organic Chemistry (3rd edición). New York: John Wiley & Sons. p. 802.
- ↑ Kimmerle, G; Eben, A (1964). «Toxizität von Methylisocyanat und dessen quantitativer Bestimmung in der Luft». Archiv für Toxikologie 20 (4): 235-241. doi:10.1007/bf00577897.
- ↑ Varma, Daya; Mulay, Shree (2015). «Methyl Isocyanate: The Bhopal Gas». Handbook of Toxicology of Chemical Warfare Agents: 287-299.
- ↑ «Bhopal trial: Eight convicted over India gas disaster». BBC News. 7 de junio de 2010. Archivado desde el original el 7 de junio de 2010. Consultado el 7 de junio de 2010.

