Hidrosililación
La hidrosililación, también llamado hidrosilación catalítica, describe la adición de enlaces Si-H a través de enlaces insaturados. Normalmente la reacción se lleva a cabo catalíticamente y por lo general los sustratos insaturados son compuestos orgánicos. Los alquenos y los alquinos dan alquilos y silanos de vinilo; aldehídos y cetonas dan éteres de sililo. La hidrosililación se ha llamado la "aplicación más importante de platino en catálisis homogénea".[1] El proceso fue reportado por vez primera en la literatura científica en 1947[2] y fue anunciada por primera vez en 1972.[3]

Ámbito de aplicación y el mecanismo
La transformación catalítica representa un importante método para la preparación de compuestos orgánicos de silicio. Una transformación idealizada se ilustra mediante la adición de trietilsilano a difenilacetileno:[4]
- Et3SiH + PhC≡CPh → Et3Si(Ph)C=CH(Ph)
La reacción se relaciona mecánicamente a hidrogenación , y catalizadores similares se emplean a veces para los dos procesos catalíticos. En la industria "catalizador de Speier," ácido cloroplatínico (H2PtCl6) es importante.[5] El mecanismo por lo general supone un complejo de metal intermedio que contiene un hidruro, un enlace sililo (R3 Si), y el alqueno o alquino del sustrato.
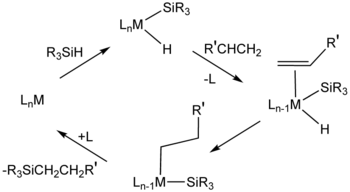
Estas reacciones también puede ser catalizada utilizando catalizadores a base de nanomaterial.
hidrosililación asimétrica
Usando fosfinas quirales como espectador ligando s, catalizadores se han desarrollado para hidrosilación asimétrica catalítica. Una reacción bien estudiado es la adición de triclorosilano al estireno para dar 1-fenil-1-(triclorosilil) etano:
- Cl3SiH + PhCHCH2 → (Ph)(CH3)CHSiCl3
Se puede lograr una casi perfecta enantioselectividades (ee) utilizando catalizadores de paladio soportados por binaftilo sustituidos con enlaces monofosfina.[6]
Hidrosililación de superficie
Las obleas de silicio se pueden grabar con ácido fluorhídrico (HF) para eliminar el óxido nativo, y forman una superficie de silicio terminado en hidrógeno. A continuación, las superficies terminadas en hidrógeno puede reaccionar con compuestos insaturados (tales como alquenos y alquinos terminales), para formar una monocapa estable sobre la superficie. Por ejemplo:
H:Si(100) + CH=CH(CH2)7CH3 → Si(100)-(CH2)9CH3
La reacción de hidrosililación se puede iniciar con luz UV a temperatura ambiente, o con aplicando calor (temperatura de reacción típica de 120-200 grados C), en virtud de las condiciones de humedad y del oxígeno libre.[7][8]
La monocapa resultante es estable e inerte, y evitar la oxidación de la capa de silicio base. La superficie de este tipo podría encontrar aplicaciones en áreas como la electrónica molecular, bioquímica y sensores electrónicos directos de biomoléculas.[9][10][11][12]
Referencias
- ↑ Renner, H.; Schlamp, G.; Kleinwächter, I.; Drost, E.; Lüschow, H. M.; Tews, P.; Panster, P.; Diehl, M.; Lang, J.; Kreuzer, T.; Knödler, A.; Starz, K. A.; Dermann, K.; Rothaut, J.; Drieselman, R. (2002). «Platinum group metals and compounds». Ullmann's Encyclopedia of Industrial Chemistry. Wiley. doi:10.1002/14356007.a21_075.
- ↑ Sommer, L.; Pietrusza, E.; Whitmore, F. «Peroxide-catalyzed addition of trichlorosilane to 1-octene». J. Amer. Chem. Soc. 69 (1): 188. doi:10.1021/ja01193a508.
- ↑ Ojima, I.; Nihonyanagi, M.; Nagai, Y. "Rhodium Complex Catalysed Hydrosilylation of Carbonyl Compounds" J. Chem. Soc., Chem. Commun. 1972, 938a. doi 10.1039/C3972000938A
- ↑ James L. Fry, Ronald J. Rahaim Jr., Robert E. Maleczka Jr. "Triethylsilane", Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons, 2007. doi 10.1002/047084289X.rt226.pub2
- ↑ C. Elschenbroich, Organometallics (2006) Wiley and Sons-VCH: Weinheim. ISBN 978-3-527-29390-2
- ↑ T. Hayashi and K. Yamasaki, "C–E Bond Formation through Asymmetric Hydrosilylation of Alkenes", Comprehensive Organometallic Chemistry III, Robert H. Crabtree and D. Michael P. Mingos, Editors. Amsterdam: Elsevier, 2007
- ↑ "Photoreactivity of Unsaturated Compounds with Hydrogen-Terminated Silicon (111)," R. L. Cicero, M. R. Linford, C. E. D. Chidsey, Langmuir 16, 5688-5695 (2000)
- ↑ "Alkyl Monolayers on Silicon Prepared from 1-Alkenes and Hydrogen-Terminated Silicon," M. R. Linford, P. Fenter, P. M. Eisenberger and C. E. D. Chidsey, J. Am. Chem. Soc. 117, 3145-3155 (1995).
- ↑ "Synthesis and characterization of DNA-modified Si(111) Surfaces," T. Strother, W. CAi, X. Zhao, R.J. Hamers, and L.M. Smith, J. Am. Chem. Soc. 122, 1205-1209 (2000).
- ↑ "T. Strother, R.J. Hamers, and L.M. Smith, "Surface Chemistry of DNA Covalent Attachment to the Silicon(100) Surface". Langmuir, 2002, 18, 788-796.
- ↑ Covalently Modified Silicon and Diamond Surfaces: Resistance to Non-Specific Protein Adsorption and Optimization for Biosensing," T.L. Lasseter, B.H. Clare, N.L. Abbott, and R.J. Hamers. J. Am. Chem. Soc. 2004, 126, 10220-10221.
- ↑ "Direct electrical detection of DNA Hybridization at DNA-modified silicon surfaces," W.Cai, J. Peck, D. van der Weide, and R.J. Hamers, Biosensors and Bioelectronics 19, 1013-1019 (2004).
