Estereoisomería
La estereoisomería es una propiedad de algunas sustancias químicas (véase isómero) que consiste en que presentan la misma fórmula molecular y cuadrícula, la misma secuencia de átomos enlazados, con los mismos enlaces entre sus átomos, pero la orientación tridimensional de éstos en el espacio es diferente.[1][2] Se diferencian, por tanto, de los isómeros estructurales, en los cuales los átomos están enlazados en un orden diferente dentro de la molécula.[3]
Clasificación[editar]
- Isómeros conformacionales, confórmeros o rotámeros, fácilmente interconvertibles entre sí por la rotación en torno a enlaces.[4]
- Se puede presentar en compuestos con cadenas abiertas, y en anillos.
- Isómeros configuracionales, solo interconvertibles entre sí mediante ruptura de enlaces.
- Estos, a su vez, se pueden clasificar en:
- Estereoisómeros quirales: No son superponibles con su imagen en el espejo. Pueden ser enantiómeros y diastereoisómeros.[5]
- Enantiómeros, que son imágenes especulares no superponibles entre sí. Si una molécula tiene un isómero especular no superponible se dice que es una molécula quiral, que posee quiralidad o que es ópticamente activa.
- Diastereoisómeros o disterómeros, que son los demás estereoisómeros, los que no son enantiómeros, o sea, no son imágenes especulares entre sí.
- Un compuesto puede tener como máximo un enantiómero pero puede tener varios diastereoisómeros.

- Estereoisómeros no quirales: Son superponibles con su imagen en el espejo. Difieren en su mayor parte en la ordenación de los átomos en el plano. Pueden ser formas meso, isómeros cis-trans, isómeros sin-anti, isómeros E-Z, isómeros endo-exo, e isómeros in-out.[5]
- Los isómeros configuracionales son aislables, ya que es necesaria una gran cantidad de energía para interconvertirlos (energía necesaria para la ruptura de enlaces), mientras que los isómeros conformacionales generalmente no son aislables, debido a la facilidad de interconversión aún a temperaturas relativamente bajas. La rama de la estereoquímica que estudia los isómeros conformacionales que son aislables (la mayoría derivados del bifenilo) se llama atropoisomería.
Isómeros conformacionales o confórmeros[editar]

La isomería conformacional es una forma de isomería que describe el fenómeno de las moléculas con la misma fórmula estructural que tienen formas diferentes debido a las rotaciones sobre uno o más enlaces. Las conformaciones diferentes pueden tener diferentes energías, por lo general se pueden convertir internamente con facilidad, y son muy raramente aislables. Por ejemplo, el ciclohexano puede existir en una variedad de conformaciones diferentes, incluyendo una conformación en silla y una conformación en bote, pero para el ciclohexano, estos isómeros nunca pueden ser separados. La conformación en bote presenta un máximo de energía (y no es un estado de transición) en el itinerario de transformación entre las dos formas silla equivalentes.
Hay algunas moléculas que pueden ser aisladas en varias conformaciones, debido a las grandes barreras de energía entre las diferentes conformaciones. Los 2,6,2',6'-bifenilos tetrasustituidos pueden encajar en esta última categoría.
Isómeros configuracionales[editar]
Un estereoisómero configuracional es un estereoisómero de una molécula de referencia que tiene configuración opuesta en un estereocentro (por ejemplo, R-vs-S o E-vs-Z). Esto significa que los isómeros configuracionales solo puede interconvertirse mediante la ruptura de enlaces covalentes del estereocentro, por ejemplo, invirtiendo las configuraciones de algunos o de todos los estereocentros o centros quirales de un compuesto.
El número de estereoisómeros de un compuesto depende del número de centros quirales que posee. La (+)-glucosa posee cuatro carbonos asimétricos y posee, por tanto, 24 = 16 estereoisómeros. Uno de ellos, la α-D-glucosa es la unidad estructural del almidón; la β-D-glucosa, otro estereoisómero, es la unidad estructural de la celulosa. Pueden ser de dos tipos según sean o no sean imágenes especulares entre sí: enantiómeros y diastereoisómeros.
Estereoisómeros quirales[editar]
Enantiómeros[editar]

Los enantiómeros son estereoisómeros que se relacionan entre sí por una reflexión: son imágenes especulares entre sí, y no son superponibles. Las manos humanas son un ejemplo macroscópico de estereoisomería. Todos los centros estereogénicos o estereocentros en un isómero tienen la configuración opuesta en el otro. Dos compuestos que son enantiómeros entre sí tienen las mismas propiedades físicas, a excepción de la dirección en que giran la luz polarizada. También tienen las mismas propiedades químicas, excepto el modo en que interactúan con diferentes isómeros ópticos de otros compuestos. Por esta razón, los enantiómeros puros exhiben el fenómeno de la actividad óptica y pueden ser separados solo con el uso de un agente quiral. En la naturaleza, solo está presente uno de los dos enantiómeros de la mayoría de los compuestos biológicos quirales, tales como los aminoácidos (excepto la glicina, que es aquiral).
Como resultado, los diferentes enantiómeros de un compuesto pueden tener efectos biológicos muy diferentes.[6] Por ejemplo, un estereoisómero de la cloromicetina es un antibiótico mientras el otro no muestra esa propiedad.


El ácido tartárico posee dos carbonos asimétricos que actúan como estereocentros. Cada uno de ellos puede tener configuración R o configuración S, según las reglas de Cahn-Ingold-Prelog. El ácido (R,R)-tartárico (o ácido L(+)-tartárico) es imagen especular del ácido (S,S)-tartárico (o ácido D(-)-tartárico) y por tanto son enantiómeros entre sí. Cuando el ácido tartárico se forma como producto o subproducto entre sustancias de origen biológico, solo obtenemos la forma dextro.
Estereoisómeros no quirales[editar]
Diastereoisómeros o diasterómeros[editar]
Los diastereoisómeros o diasterómeros son estereoisómeros que no están relacionados a través de una operación de reflexión. O sea, no son imágenes especulares uno del otro. Entre ellos se incluyen los isómeros cis-trans (E-Z), y los isómeros ópticos no enantioméricos. Los diastereoisómeros de un compuesto rara vez tienen las mismas propiedades físicas, a diferencia de los enantiómeros que tienen las mismas propiedades en cualquier entorno no quiral (en ausencia de luz polarizada). Sus propiedades químicas son similares pero no iguales.[7]
Formas meso o estructura meso[editar]
Las estructuras meso, compuestos meso o formas meso son compuestos superponibles a su imagen especular, a pesar de poseer centros quirales. En el ejemplo que se muestra a continuación, la forma meso del ácido tartárico forma un par de diastereoisómeros tanto con la forma levo o con la forma dextro del ácido tartárico; estas últimas forman un par de enantiómeros entre sí. Las dos estructuras meso representadas en realidad son superponibles y forman una sola y única estructura.
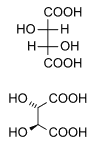
|

| |
|
ácido tartárico (natural) |
ácido D-(-)-tartárico |
ácido mesotartárico |
|
Mezcla (1:1) |
||
Debe tenerse en cuenta aquí que las etiquetas D-y L- presentes en los isómeros de arriba no significan igual que las etiquetas d- y l-, observadas con mayor frecuencia, explicando por qué esto puede parecer contradictorio a los que solo conocen esta última nomenclatura. Por favor, consulte el artículo sobre quiralidad para obtener más información acerca de las etiquetas D-y L-.
Isomería cis-trans[editar]

La estereoisomería cis-trans está habitualmente ligada a la presencia de dobles enlaces C=C porque la rotación alrededor del doble enlace está restringida, manteniendo los sustituyentes posiciones fijas respecto a los otros. Si los sustituyentes en un carbono del doble enlace son los mismos, entonces no existirá este tipo de isomería.
Tradicionalmente, los estereoisómeros ligados al doble enlace se notan como cis (en latín, de este lado) o trans (del latín, cruzado), en referencia a la posición relativa de los sustituyentes a cada lado de un doble enlace. Los ejemplos más simples de isomería cis-trans son los etenos 1,2-disustituidos, como el 1,2-dicloroeteno (C2H2Cl2), cuyos isómeros se muestran a continuación.
Isomería E-Z[editar]

La molécula I es cis-1,2-dicloroeteno y la molécula II es trans-1,2-dicloroeteno. Debido a ocasional ambigüedad, la IUPAC ha adoptado un sistema más riguroso en el que a los sustituyentes de cada extremo del doble enlace se le asigna una prioridad en función de su número atómico. Si los sustituyentes de alta prioridad están en el mismo lado del doble enlace, al compuesto se le asigna la letra Z (del alemán, zusammen, juntos). Si están en lados opuestos del enlace, se le asigna la letra E (del alemán, entgegen, enfrentados). En el ejemplo anterior, el cloro tiene un número atómico mayor que el hidrógeno, y por ello es el grupo de mayor prioridad. Utilizando esta notación para nombrar las moléculas anteriores, la molécula I es (Z)-1,2-dicloroeteno y la molécula II es (E)-1,2-dicloroeteno. No siempre Z y cis (o bien, E y trans) son intercambiables. Veamos la molécula siguiente de fluorometilpenteno:

El nombre correcto de esta molécula es, o bien, trans-2-fluoro-3-metilpent-2-eno, porque los grupos alquilo que forman la cadena principal (es decir, los grupos metilo y etilo) se encuentran en lados opuestos del doble enlace, o bien, (Z)-2-fluoro-3-metilpent-2-eno, porque los grupos de mayor prioridad que hay a cada lado del doble enlace están en el mismo lado del doble enlace. El átomo de flúor es el grupo de mayor prioridad en el lado izquierdo del doble enlace, y el grupo etilo es el de mayor prioridad en el lado derecho de la molécula.
Los términos cis y trans se usan también para describir la posición relativa de dos sustituyentes de un anillo: cis, si están del mismo lado; trans, si están en lados diferentes.

Isomería sin-anti[editar]
Es una isomería similar a la isomería geométrica cis-trans, pero en vez de doble enlace C=C, tenemos otros dobles enlaces diferentes, como C=N; N=N o N=S.[8]
Es típica de iminas, oximas, azocompuestos. Se denomina sin al isómero cuyos grupos de mayor prioridad están juntos, y anti en el caso en que dichos grupos de mayor prioridad están opuestos.
Isomería endo-exo[editar]

Los isómeros endo-exo se presentan en compuestos bicíclicos como el 2-norborneol. El puente actúa como uno de los grupos. Si dejamos el puente en una posición fija y nos fijamos en la posición del otro sustituyente, se pueden presentar dos situaciones: que esté del mismo lado (isómero exo, que sería similar a cis), o del lado opuesto (isómero endo, similar a trans).
Isomería in-out[editar]
La isómeros in-out también se presenta en el caso de anillos cuando una cadena actúa como grupo sustituyente a ambos lados. Por ejemplo en las diaminas tricíclicas con el átomo de nitrógeno como cabeza de puente a ambos lados y cadenas largas actuando como puente.[9]
Enlaces externos[editar]
 Wikimedia Commons alberga una categoría multimedia sobre Estereoisomería.
Wikimedia Commons alberga una categoría multimedia sobre Estereoisomería.
Referencias[editar]
- ↑ IUPAC Gold Book, Compendium of Chemical Terminology, 2ª ed. ("Gold Book") (1997). Versión en línea corregida: (2006-) título = stereoisomerism | fichero = S05983}}
- ↑ Columbia. "Stereoisomers" en Encyclopedia.com, n.l., 2005, Enlace, 7 de diciembre de 2005.
- ↑ Química orgánica. Norman L. Allinger. Editorial Reverté, 1979. ISBN 8429170154. Pág. 151
- ↑ Química orgánica. Robert Thornton Morrison, Robert Neilson Boyd. Editorial Pearson Educación, 1998. ISBN 9684443404. Pág. 78
- ↑ a b Estereoquimica. Pedro Antonio García Ruiz. EDITUM. Universidad de Murcia. Pág. 12
- ↑ Grazia, Piizzi; Hardinger, Steve. «Stereochemistry: an introduction.» (en inglés). Archivado desde el original el 5 de septiembre de 2012. Consultado el 29 de marzo de 2023.
- ↑ Distereómeros.. En: Química orgánica. Robert Thornton Morrison, Robert Neilson Boyd. Editorial Pearson Educación, 1998. ISBN 9684443404. Pág. 143
- ↑ Isomería sin-anti. En: Estereoquimica. Pedro Antonio García Ruiz. EDITUM. Universidad de Murcia. Pág. 24
- ↑ Isomería in-out. En: Estereoquimica. Pedro Antonio García Ruiz. EDITUM. Universidad de Murcia. Pág. 24

