CPEB4
La proteína CPEB4 (Cytoplasmic polyadenylation element-binding protein 4), pertenece a la familia CPEB de las proteínas elemento de unión de poliadenilación citoplasmática. Estas son las encargadas de controlar la traducción de los ARN mensajeros mediante la regulación de la longitud de la cola de poliadenina de los mismos, proceso conocido como poliadenilación. También desarrolla un papel destacado en la meiosis de las células germinales, en la respuesta a proteínas desplegadas y su síntesis se adecúa a los ciclos circadianos celulares. Además, está relacionada con diversas enfermedades, entre las cuales destacan el cáncer, el autismo y las patologías hepáticas.
| CPEB4 | |
|---|---|
| Nombre sistemático | Cytoplasmic polyadenylation element-binding protein 4 |
| Números de identificación | Uniprot: Q17RY0
Taxonomic identifier: 9606 |
| Tipo de proteína | Fosfoproteína |
| Número de aminoácidos | 729 |
| Peso Molecular | 80,152 kDa |
| Organismo | Homo Sapiens (Humano) |
| Localización | Cromosoma 5: gen CPEB4 |
Historia[editar]
Esta proteína fue descubierta por Joel Richter y su grupo de investigadores. Estudiando los oocitos de Xenopus y su desarrollo embrionario, advirtieron que los segmentos de ARNm, poliadenizados en el citoplasma de los oocitos en maduración, contenían un secuencia rica en uridina, esencial para la elongación de la cola poly(A) y la activación de la traducción.[1]
Denominaron esta secuencia con el nombre de CPE (cytoplasic polyadenylation element) y predijeron que iba a interactuar con proteínas involucradas en el proceso de poliadenilación. A estas proteínas las llamaron CPEB.[2]
Localización celular[editar]
El gen que codifica la proteína CPEB4 se encuentra localizado en el Cromosoma 5 (humano), concretamente en la banda citogenética q35.2.

Aunque la poliadenilación regulada por CPEB4 tiene lugar en el citosol durante la embriogénesis temprana, y ocurre justo después del proceso de transcripción de un gen, la proteína puede ser observada también tanto en la zona nuclear como en la perinuclear. Es decir, específicamente, en el retículo endoplasmático y en el aparato de Golgi y, en menor grado, en la membrana plasmática y en las dendritas y axones de las células nerviosas.[3]
Estructura[editar]

Arriba: Estructura primaria de CPEB4, (en naranja RRM-1) y (en gris RRM-2).
Centro: Dominios proteicos RRM-1 (en naranja izquierda) y RRM-2 (en gris derecha).
Abajo: Estructura terciaria.
CPEB4, como su nombre indica, es una proteína que pertenece a la familia de proteínas [1] CPEB, es decir, proteínas que se unen al ARN mensajero y promueven el alargamiento de la cola de poliadenina de este. Estas proteínas se caracterizan por tener dominios proteicos RRM que permiten el reconocimiento de la molécula de ARN.
Estructura primaria[editar]
CPEB4 es una fosfoproteína formada por 729 aminoácidos y unida a dos iones zinc.
Regiones[editar]
- La primera de ellas, formada por 375 aminoácidos (posición 1 a la 375), se caracteriza por una baja complejidad estructural en la cual hay una gran cantidad de histidinas y glicinas.
- La segunda región, formada por 3 aminoácidos (posición 541 a 543), corresponde a la zona donde la proteína se une al ARN.
Dominios[editar]
En particular, esta proteína está constituida por un dominio N-terminal, dos dominios RRM y un dominio "ZZ".
- Dominios RRM. El primero, RRM1, está compuesto por 92 aminoácidos (posición 472 a 563) y el segundo, RRM2, por 83 aminoácidos (posición 580 a 662).

- Cuando estos dominios RRM están libres, es decir, no asociados con el ARN, presentan una estructura compacta, en forma de V y constituida por una lámina beta de 4 hebras flanqueadas por dos hélices alfa. La parte denominada "inter-dominio", esto es la zona que une los dos dominios, actúa como bisagra para fijar la orientación espacial.[4]
-Sin embargo, la estructura de los dos dominios RRM es distinta cuando interactúan con el ARN, ya que contiene CPE (elemento rico en uracilo que permite la poliadenilación citoplasmática). Mientras que el dominio RRM1 es el que presenta más afinidad con el ARN y permite la unión de los primeros cuatro nucleótidos (C1, U2, U3 y U4), el dominio RRM2 solo permite la unión con el nucleótido A5.[5]
- El dominio N-terminal se encuentra en uno de los extremos del dominio RRM1 y es el responsable de la formación de una de las cuatro hebras de la lámina beta.
- El dominio "ZZ" es el encargado de coordinar los dos iones de zinc y también está implicado en la interacción con otras proteínas. Además, aumenta la afinidad de los dos dominios RRM ya que tiene cierta similitud con los [2] CPE. Como consecuencia se forma una interfaz polar entre los dos dominios.[6]
Estructura secundaria[editar]
La proteína consta de 6 regiones de hélice alfa, 16 láminas beta y dos zonas de giros.

Estructura cuaternaria[editar]
En su estructura cuaternaria interactúa con las proteínas TOB1 que regulan la proliferación.


Cuando la proteína se encuentra en estructura cuaternaria realiza su función principal. Su actividad durante la meiosis, viene determinada y regulada por la fosforilación. Concretamente, este proceso tiene lugar gracias a que las quinasas añaden grupos fosfato a doce residuos que están localizados en la mitad N-terminal desordenada (falta de estructura tridimensional). Los únicos aminoácidos que se pueden fosforilar son la serina (S), la tirosina (Y) y la treonina (T). En caso de que este proceso no se realice, no se podrá llevar a cabo la poliadenilación citoplasmática del ARN mensajero. Además, la fosforilación del dominio desordenado coordina el grado de agregación. Por tanto, el CPEB4 no fosforilado forma agregados que reprimen el ARN mensajero, mientras que el CPEB4 fosforilado participa en el proceso de poliadenilación citoplásmica.[5]
Isoformas de CPEB4[editar]
Existen tres isoformas de esta proteína:[6]
-Isoforma 1: es la secuencia canónica, es decir, la principal. En general la información que hay en esta entrada se refiere a ella.
-Isoforma 2: es una secuencia parecida a la canónica pero difiere de esta por la pérdida de los aminoácidos en posición 403 a la 419.
-Isoforma 3: es una secuencia que difiere de la secuencia canónica por la pérdida de los aminoácidos en posición 1 a la 382 y de la posición 404 a la 428.
Mecanismo y función[editar]
CPEB4 en células germinales[editar]
La principal función de la proteína CPEB4 (así como la del resto de CPEBs) es la poliadenilación citosólica, que consiste en la elongación de una cola de poly(A), segmento de ARN formado exclusivamente de adenosín monofosfatos, al extremo 3' de un ARN mensajero. Por lo general, el ARNm sintetizado en el núcleo cuenta con una cola de poly(A), de unos 20 nucleótidos de Adeninas o menos, que se elonga en el citosol hasta 80-150 nucleótidos.[7]
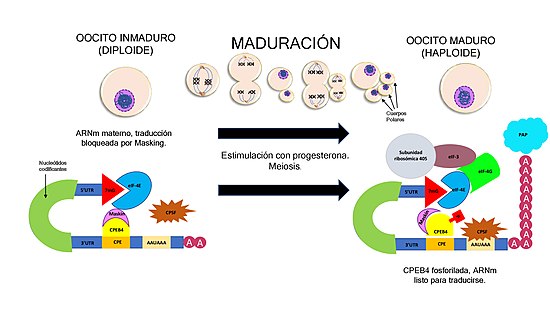
En concreto, la proteína CPEB4 es la encargada de regular la traducción mediante la poliadenilación durante la segunda división meiótica. Este proceso es clave ya que, para que la meiosis pueda progresar, es necesaria la activación traduccional de los ARNm maternos. Este ARNm materno queda "enmascarado" (el proceso de masking bloquea la traducción) para que las proteínas sean sintetizadas según la necesidad.[1]
En los oocitos inmaduros, la CPEB4 se une a la señal de poliadenilación CPE (5'-UUUUUAU-3') que se encuentra en la 3'UTR (Untranslated Region) y a otra proteína denominada Maskin. Esta se une a su vez al factor de iniciación eIF-4E, impidiendo que este interactúe con otros factores de iniciación: la traducción está bloqueada.[8][2]
A medida que el embarazo avanza, el oocito madura y requiere proteínas adicionales. La estimulación con progesterona (cuyos niveles aumentan a lo largo del embarazo) provoca la fosforilación de los residuos fosforilables.[8]
En primer lugar, esto induce la unión de la Cleavage and Polyadenylation Specificity Factor (CPSF) a AAUAAA, una secuencia de 6 nucleótidos de la 3'UTR. A continuación, la CPSF atrae a la poly(A) polimerasa (poliadenilato-polimerasa o PAP) que elongará la cola de adeninas.[8][7]
En segundo lugar, la fosforilación provoca la disolución parcial del complejo CPEB4-Maskin-eIF-4E, quedando este último libre para interactuar con otro factor de iniciación: eIF-4G. Este atrae a eIF-3 y a la subunidad ribosómica de 40S. El ARNm está listo para ser traducido.[8]
Véase la siguiente imagen explicativa del texto anterior:
CPEB4 en células somáticas[editar]
La actividad de las CPEBs no está limitada a la regulación traduccional en células de la línea germinal sino que también interviene en el proceso de la mitosis y en la homeostasis.
Además, coordinan los mecanismos de poliadenilación citoplasmática de las células somáticas durante el ciclo celular. Las CPEB1, 2 y 4 desempeñan un papel secuencial durante la mitosis, en la Profase, la Metafase y la Citocinesis respectivamente. Las células carentes de CPEB4 muestran colas de poliadenina anormalmente largas, lo que se conoce como hiperpoliadenilación.[9]
CPEB4 tiene un papel fundamental en el mantenimiento de la homeostasis y en la prevención del comportamiento anómalo de lípidos y otras proteínas.[10]

Estudios realizados con ratones, modificados genéticamente para que carecieran de CPEB4, permitieron comprobar que tras 80 semanas los roedores desarrollaban esteatosis hepática. Se trata de una condición reversible en la que los hepatocitos acumulan en exceso vacuolas de triglicéridos y lipid droplet citosólicos, provocando un aumento del tamaño del hígado y la posibilidad de desarrollar fibrosis o cáncer hepático. Este exceso de lípidos se produce a causa de una disminución de la eficiencia de la β-oxidación de ácidos grasos en las mitocondrias de los ratones con deficiencia de CPEB4.[10]
Asimismo, CPEB4 permite la traducción de muchas proteínas residentes en el retículo endoplasmático, denominadas chaperonas. Estas estructuras son indispensables para el mantenimiento de la homeostasis, pues ayudan al plegamiento de las proteínas recién sintetizadas, permitiéndoles realizar su función e impiden que proteínas mal plegadas formen depósitos de material amiloide.[10]
Al contrario que para CPEB1 y CPEB3, no hay evidencia de intervención de CPEB4 en lo que hace referencia a aprendizaje, memoria y plasticidad sináptica.[11]
CPEB4 en la Respuesta a Proteínas Desplegadas (UPR)[editar]
El retículo endoplasmático (RE) cuenta con mecanismos para degradar proteínas que accidentalmente queden mal plegadas. Una disrupción de dichos mecanismos acaba provocando ER stress, literalmente estrés del RE, que no es capaz de eliminar las proteínas defectuosas. Frente a esta situación, el RE pone en marcha la Respuesta a Proteínas Desplegadas (UPR). Este proceso consiste en una reducción de la producción de proteínas, un aumento de la producción de chaperonas y, en caso de no funcionar, la apoptosis.[10]
CPEB4 participa en este proceso potenciando, o inhibiendo, la traducción de determinados ARNm durante la UPR. Concretamente, la regulación mediada por CPEB se manifiesta de forma tardía, pues en las primeras fases de la UPR son otros mecanismos, como los Upstream Open Reading Frame (uORFs), quienes se activan preferentemente.[10]
CPEB4 y los ciclos circadianos[editar]
Las características fisiológicas de los organismos varían a lo largo del día, siguiendo el mismo patrón cada 24 horas aproximadamente: se trata del ritmo circadiano. En células hepáticas, aunque los niveles de CPEB4 no son circadianos per se, los niveles de CPEB4-ARNm (que al traducirse sintetiza CPEB4) sí siguen un patrón circadiano. Por ello, la amplitud de la respuesta a proteínas desplegadas (UPR) varía durante el día siguiendo un ritmo circadiano.[12]
Enfermedades asociadas[editar]
Autismo
La proteína CPEB4 regula numerosos genes durante el desarrollo embrionario. Por tanto, se presenta como un posible nexo entre los factores ambientales que alteran el desarrollo del cerebro y los genes de predisposición al autismo.[13]
En concreto, CPEB4 se encarga de regular la transcripción de los genes ASD (Autism Spectrum Disorder), que son los causantes del autismo. Así pues, una proporción deficiente de CPEB4 o defectos en ella, pueden provocar una errónea expresión de estos genes asociados causando autismo.[14] Es por este motivo, que la proteína CPEB4 podría ser una nueva diana terapéutica para combatir el autismo.
Cáncer
Se ha podido observar que la proteína CPEB4 está relacionada con diversos tipos de cáncer, especialmente con el cáncer de mama,[15] el cáncer gástrico[16] y el carcinoma ductal de páncreas.[17] Además, esta proteína, juega un papel muy importante no solo en la proliferación, sino en la migración e invasión de estos tumores.
En tejidos cancerígenos, la presencia de la proteína CPEB4 es mayor que en tejidos normales. Gracias a estudios clínicos, se sabe que un exceso de CPEB4 es una de las causas que puede favorecer la metástasis. Sin embargo, hasta ahora, no se conoce con plena exactitud la manera en que esta proteína afecta a los tejidos cancerígenos.[15][16]
Cirrosis
A pesar de que un exceso de CPEB4 pueda ser perjudicial para algunas enfermedades, también es beneficiosa. El principal órgano beneficiado por esta proteína, es el hígado. Una condición patológica de este órgano es el hígado graso, que es causado por la excesiva acumulación de grasas en las células hepáticas y que se ha convertido en la principal enfermedad crónica del hígado. Sin CPEB4, el retículo endoplasmático es incapaz de activar la respuesta a estrés y los hepatocitos acumulan lípidos produciendo el hígado graso.[18]
La complicación más común del hígado graso es la cirrosis, que consiste en el mal funcionamiento del hígado causado por la aparición de nódulos fibrosos. Investigaciones recientes afirman que las proteínas CPEB4 son una nueva diana terapéutica. Interfiriendo en estas proteínas se puede inhibir la generación de nuevos vasos sanguíneos anómalos asociados a cirrosis y, por tanto, prevenir el cáncer de hígado.[19]
Enlaces externos[editar]
En caso de querer saber con más detalle la relación que existe entre la proteína CPEB4 y las enfermedades ya mencionadas, se pueden leer los siguientes artículos e investigaciones:
Relación CPEB4 y autismo. Nota de prensa CSIC
Relación entre CPEB4 y el autismo
Relación entre CPEB4 y el cáncer
Relación entre CPEB4 y las enfermedades hepáticas
Referencias[editar]
- ↑ a b >Richter JD (1999). «Cytoplasmic polyadenylation in development and beyond». Microbiol Mol Biol Rev. (revisión) 63 (2): 446-456.
- ↑ a b Lin, Ren-Jang (2010). «Maternal mRNA and the PolyA Tail in Oocytes». Nature Education 3(9):47.
- ↑ «Localización gen: CPEB4 HUMAN». GeneCards. Consultado el 14 de octubre de 2018.
- ↑ Lodish, Harvey (2005). «12». Biología celular y molecular. Editorial médica Panamericana. p. 495. ISBN 9789500606264. Consultado el 14 de octubre de 2018.
- ↑ a b Guillén Boixet, Jordina (4 de diciembre de 2015). «Post-translational regulation of CPEB4 in cell cycle». Universidad de Barcelona. Consultado el 14 de octubre de 2018.
- ↑ a b «UniProt: CPEB4 HUMAN». 11 de octubre de 2018.
- ↑ a b D'Ambrogio, Andrea (04/2013). «Translational control of cell growth and malignancy by the CPEBs». Nature Reviews Cancer, Volume 13. PMID 23446545. doi:10.1038/nrc3485.
- ↑ a b c d Stebbins, Barbara (December 1999). «Maskin Is a CPEB-Associated Factor that Transiently Interacts with eIF-4E». Cell Press, Volume 4, Issue 6. doi:10.1016/S1097-2765(00)80230-0.
- ↑ Giangarrà, Valeria (23 de septiembre de 2015). «Global Analysis of CPEBs Reveals Sequential and Non-Redundant Functions in Mitotic Cell Cycle». PLOS Journals. Consultado el 22 de octubre de 2018.
- ↑ a b c d e Maíllo, Carlos (02/2017). «Circadian- and UPR-dependent control of CPEB4 mediates a translational response to counteract hepatic steatosis under ER stress». Nature Cell Biology, Volume 19, pages 94-105. PMID 28092655. doi:10.1038/ncb3461.
- ↑ «UniProtKB - Q17RY0 (CPEB4_HUMAN)».
- ↑ Maíllo, Carlos (02/2017). «Circadian- and UPR-dependent control of CPEB4 mediates a translational response to counteract hepatic steatosis under ER stress». Nature Cell Biology, Volume 19, pages 94-105. PMID 28092655. doi:10.1038/ncb3461.
- ↑ CSIC, María González (2018). «Descubren una proteína clave en el desarrollo del autismo». Centro de Investigación Biomédica en Red sobre Enfermedades Neurodegenerativas (CIBERNED), Instituto de Investigación Biomédica (IRB Barcelona). Archivado desde el original el 19 de octubre de 2018. Consultado el 18 de octubre de 2018.
- ↑ Parras, Alberto; Anta, Héctor; Santos-Galindo, María; Swarup, Vivek; Elorza, Ainara; Nieto-González, José L.; Picó, Sara; Hernández, Ivó H. et al. (2018-08). «Autism-like phenotype and risk gene mRNA deadenylation by CPEB4 mis-splicing». Nature (en inglés) 560 (7719): 441-446. ISSN 0028-0836. doi:10.1038/s41586-018-0423-5. Consultado el 17 de octubre de 2018.
- ↑ a b Lu, Ran; Zhou, Zhiqiang; Yu, Wenfei; Xia, Yifu; Zhi, Xuting (2017-07). «CPEB4 promotes cell migration and invasion via upregulating Vimentin expression in breast cancer». Biochemical and Biophysical Research Communications 489 (2): 135-141. ISSN 0006-291X. doi:10.1016/j.bbrc.2017.05.112. Consultado el 12 de octubre de 2018.
- ↑ a b Cao, Gan; Chen, Dehu; Liu, Guiyuan; Pan, Yan; Liu, Qinghong (2018-09). «CPEB4 promotes growth and metastasis of gastric cancer cells via ZEB1-mediated epithelial-mesenchymal transition». OncoTargets and Therapy (en inglés). Volume 11: 6153-6165. ISSN 1178-6930. doi:10.2147/ott.s175428. Consultado el 12 de octubre de 2018.
- ↑ Tsai, Li-Yun; Chang, Yu-Wei; Lee, Ming-Che; Chang, Ying-Chen; Hwang, Pei-Ing; Huang, Yi-Shuian; Cheng, Ching-Feng (9 de mayo de 2016). «Biphasic and Stage-Associated Expression of CPEB4 in Hepatocellular Carcinoma». PLOS ONE (en inglés) 11 (5): e0155025. ISSN 1932-6203. PMID 27158894. doi:10.1371/journal.pone.0155025. Consultado el 12 de octubre de 2018.
- ↑ «Descubren una proteína protectora contra el hígado graso, la enfermedad hepática más común en los países occidentales» [14/10/2016].
- ↑ «Científicos de Barcelona descubren un posible tratamiento para la cirrosis».
