Aromaticidad
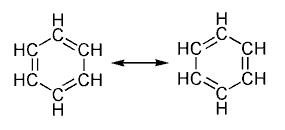
En química orgánica, la aromaticidad es una propiedad de hidrocarburos cíclicos conjugados en la que los electrones de los enlaces dobles, libres de poder circular alrededor de un enlace a otro, sea enlace doble o simple, confieren a la molécula una estabilidad mayor que la conferida si dichos electrones permanecieran fijos en el enlace doble.[1]
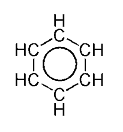
Eso quiere decir que al representar la molécula se dibujan los enlaces dobles en una configuración y, entre flechas, las demás configuraciones como oportunidades adicionales tengan los electrones de los enlaces dobles de formar otros enlaces alrededor del anillo aromático. La molécula de benceno, por ejemplo tiene varios estados de resonancia, de los cuales dos son representados aquí, que corresponden a los enlaces dobles alternándose con los enlaces simples.
Enlaces dobles del benceno
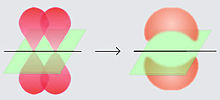
Un enlace doble está conformado por dos electrones situados en orbitales atómicos designados con la letra p. En el caso del benceno, los electrones de los dobles enlaces localizan uno de sus orbitales por encima del plano del anillo y otro por debajo de él.[2] Debido a la configuración circular del anillo del benceno, los electrones en el orbital p del doble enlace interactúan entre sí, orbitando libremente alrededor de la molécula por encima y por debajo del plano del anillo.
Eso quiere decir que en vez de estar comprometidos a un solo átomo de carbono, cada electrón (de cada doble enlace original) es compartido por los seis átomos de carbono en el benceno:

Resonancia

Como nos indica la teoría de la resonancia y sus diagramas donde se usa una flecha doble que significa que ninguna de las dos estructuras representadas son entidades diferentes sino, solamente entidades hipotéticas. Esto es, ninguna de las dos estructuras son una representación fiel y real del compuesto que puede ser así mejor representado mediante su híbrido de resonancia. Un enlace C=C es más corto que un enlace C-C, pero en el caso del benceno, C6H6 todos los enlaces carbono-carbono poseen la misma longitud de enlace, que es intermedia entre la longitud de un enlace simple y enlace doble.
Si no aplicamos el concepto de resonancia (ver los dos diagramas de la izquierda por separado), los enlaces simples C-H y C-C, (formados por compartición de un par de electrones entre un átomo de carbono y otro de hidrógeno, o entre dos átomos de carbono vecinos) son llamados enlaces σ. En cambio, los dobles enlaces C=C consisten de un enlace sigma y de un enlace pi, donde los enlaces pi se forman por superposición lateral de orbitales atómicos pz de los dos átomos de C que forman el doble enlace, como nos indica el Método de orbitales moleculares como una combinación lineal de orbitales atómicos que es parte a su vez de la Teoría de los orbitales moleculares.
Si aplicamos el concepto de resonancia (ver el diagrama de la derecha), no podremos diferenciar los enlaces C-C y C=C, pues en realidad los seis enlaces en el anillo hexagonal bencénico son iguales e intermedios entre un sencillo y un doble. Una mejor explicación de ese enlace intermedio consiste en la suma de un enlace σ entre cada dos átomos de C vecinos, más un enlace π circular en donde la densidad electrónica se encuentra distribuida uniformemente a través del anillo hexagonal tanto por encima como por debajo de él, por superposición lateral de los 6 orbitales atómicos pz y la consiguiente formación de un orbital molecular que cubre toda la molécula. Este modelo representa más apropiadamente la densidad electrónica dentro del anillo aromático.
La imagen siguiente nos muestra esos orbitales atómicos:

Aunque los mismos se encuentran por fuera del plano aun así pueden interactuar libremente entre ellos y de esta forma se produce deslocalización electrónica. De esta manera, podemos notar que no existen la cantidad de electrones suficientes para que se formen enlaces dobles en todos los enlaces, pero la deslocalización electrónica proporciona electrones "extra" que fortalecen igualmente todos los enlaces dando lugar a la simetría π del orbital molecular.
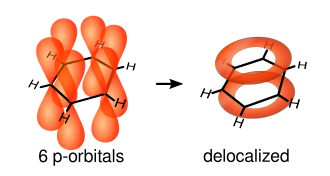
Historia
La primera vez que fue usado el término "aromático" como un término relativo a la química, aplicado a aquellos compuestos que contienen el radical fenilo ocurrió en un artículo hecho por August Wilhelm Hofmann en 1855.[3] Y aunque esta fue la más temprana introducción del término, es curioso que Hofmann no haya aclarado el porqué de haber introducido un adjetivo relativo al olfato para ser aplicado a un grupo de sustancias químicas; cuando solo algunos de ellos poseen aromas perceptibles. Esto es debido a que muchas de las sustancias químicas orgánicas conocidas con propiedades odoríferas son terpenos, los cuales no son aromáticos en el sentido químico. Pero los terpenos y los derivados del benceno poseen una característica química en común, la misma es que poseen índices de insaturación más altos que muchos compuestos alifáticos y aun así, Hofmann no realizó ninguna distinción entre ambas categorías. Respecto a su estructura, sabemos que la estructura del ciclohexatrieno para el benceno fue propuesta inicialmente por August Kekulé en 1865. Luego, durante las décadas siguientes, muchos químicos la aceptaron rápidamente ya que estaba justificada por muchas de las relaciones isoméricas de la química de los compuestos aromáticos. Sin embargo, seguía siendo enigmático que esta estructura propuesta, altamente insaturada, fuera tan poco reactiva frente a reacciones de adición.
El descubridor del electrón, J. J. Thomson, entre 1897 y 1906 ubicó tres electrones equivalentes entre cada átomo de carbono del benceno.
La explicación de la excepcional estabilidad del benceno se atribuye normalmente a Sir Robert Robinson, quien aparentemente fue el primero (en 1925)[4] en acuñar el término "sexteto aromático" como un grupo de seis electrones que resisten a ser alterados.
También, este concepto puede ser rastreado mediante Ernest Crocker en 1922,[5] hacia Henry Edward Armstrong, quien en 1890, en un artículo titulado The structure of cycloid hydrocarbons, donde escribió las afinidades céntricas (seis) actúan dentro de un círculo... el benceno, puede ser representado por un anillo doble (sic) ... y cuando se forma un compuesto de adición, el círculo interno de afinidad sufre una alteración, los átomos de carbono contiguos a los cuales nada había podido añadírseles, necesariamente adquieren un estado etilénico..[6]
Aquí, Armstrong describe al menos cuatro conceptos modernos. Primero, su "afinidad" por los electrones que es hoy en día mejor conocida, la cual fue puesta en evidencia siete años después por J. J. Thomson. Segundo, Armstrong describe la sustitución electrofílica aromática, que ocurre (tercero) a través del intermedio de Wheland, en el cual (cuarto) la conjugación del anillo se rompe. Introdujo el símbolo C centrado en el anillo como un símbolo que representaba el círculo interno, anticipándose de esta manera a la notación de Eric Clar. También, se discute si también anticipó la naturaleza de la mecánica ondulatoria, dado que reconoció que las afinidades eran dirigidas y no eran meramente partículas puntuales y colectivamente poseían una distribución que podía ser alterada mediante la introducción de sustituyentes al anillo bencénico (puesto que la distribución de la carga eléctrica en un cuerpo es alterada por el acercamiento de otro cuerpo).
El origén mecánico cuántico de esta estabilidad, o aromaticidad, fue formulado primero por Hückel en 1931. Hückel, fue el primero en separar los electrones enlazantes en electrones sigma y electrones pi.
Compuestos aromáticos
La aromaticidad es común en compuestos derivados del benceno, tales como el tolueno y los xilenos (configuraciones orto- y para-). Los compuestos heterocíclicos y policíclicos también son aromáticos. La aromaticidad se puede encontrar en ciertos compuestos iónicos. Muchos compuestos importantes de la vida son aromáticos. Las bases orgánicas de DNA son aromáticos. Algunos de los aminoácidos son aromáticos, y los compuestos clorofila y hemoglobina también.
Para que un compuesto sea aromático tiene que cumplir la llamada Regla de Hückel, que dice que la cantidad de electrones en los orbitales pi, tiene que ser múltiplo de 4n + 2 para n = 0, 1, 2, 3, .[7]
Índices de aromaticidad
Admitiendo que el benceno es el prototipo de compuesto aromático, se ha discutido si la aromaticidad es una propiedad única o si tiene sentido tratar de cuantificar la aromaticidad de otros compuestos que tienen algunas propiedades en común.[8] No hay consenso sobre una escala única para cuantificar la aromaticidad. Las principales escalas o índices que se han propuesto se basan en criterios bien energéticos, bien magnéticos, bien geométricos, que son esencialmente independientes entre sí.
Los criterios energéticos se basan en una extensión de la ley de Hess, suponiendo primero que los dobles enlaces de un compuesto sufren reacciones independientes, y nominando Energía de Estabilización Aromática a las desviaciones observadas. Como ejemplo más sencillo, si el benceno no tuviese aromaticidad esperaríamos que el calor de reacción de hidrogenación del benceno para obtener ciclohexano fuera el triple que la del ciclohexeno, el cicloalqueno análogo con un sólo enlace doble. Para poder hacer diferencias válidas, estas reacciones han de ser isodésmicas y homodesmóticas, esto es, que se mantenga entre ellas no sólo el número y tipo de enlaces total, sino también la hibridación de los átomos enlazados.
Los criterios magnéticos considera que en el benceno y en los hidrocarburos aromáticos se produce -en presencia de un campo magnético externo- una circulación de carga característica en la nube pi, que a su vez genera un campo. Esta circulación se refleja en el diamagnetismo del compuesto, esto es, se puede cuantificar con medidas de susceptibilidad magnética, y también en el desplazamiento químico de los hidrógenos vecinos, en experimentos de resonancia magnética nuclear.
Los criterios geométricos o estructurales se centran en otra de las manifestaciones de la aromaticidad: la uniformidad en las distancias de los enlaces implicados y la planaridad de la molécula.
Véase también
Referencias
- ↑ Universidad de Navarra. [1]
- ↑ Universidad Autónoma de Madrid. [2]
- ↑ A. W. Hofmann, "On Insolinic Acid," Proceedings of the Royal Society, 8 (1855), 1-3.
- ↑ "CCXI.—Polynuclear heterocyclic aromatic types. Part II. Some anhydronium bases" James Wilson Armit and Robert Robinson Journal of the Chemical Society, Transactions, 1925, 127, 1604–1618 Abstract.
- ↑ APPLICATION OF THE OCTET THEORY TO SINGLE-RING AROMATIC COMPOUNDS Ernest C. Crocker J. Am. Chem. Soc.; 1922; 44(8) pp 1618–1630; Abstract
- ↑ The structure of cycloid hydrocarbons Henry Edward Armstrong Proceedings of the Chemical Society (London), 1890, 6, 95 - 106 Abstract
- ↑ Universidad Nacional de Educación a Distancia. [3]
- ↑ Mercedes Alonso, Bernardo Herradón (2010). Anales de Química 106 (3): 173-182.
