Amonio

El amonio es un catión poliatómico cargado positivamente, de fórmula química NH4+. Tiene un peso molecular de 18,04 y se forma mediante la protonación del amoníaco (NH3).
El ion resultante tiene un pKa de 9,25. Los nombres amonio y aminio también son nombres para las aminas sustituidas protonadas o cargadas positivamente, y los cationes amonio cuaternario N+R4, donde uno o más átomos de hidrógeno son reemplazados por grupos alquilo (que pueden ser simbolizados como R).
Química

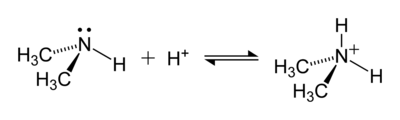
El amoníaco es una base débil: reacciona con ácidos de Brønsted (donantes de protones) para producir el ion amonio. Cuando se disuelve amoníaco en agua, una cantidad pequeña de él reacciona con los iones hidronio en el agua para producir iones amonio. El ion amonio resultante es un ácido conjugado comparativamente fuerte, y reacciona con cualquier base, regenerando la molécula de amoníaco neutra. En solución acuosa, el grado en que el amoníaco forma ion amonio depende del pH de la solución y de la concentración de amoniaco.
El par electrónico libre en el nitrógeno (N) en el amoníaco está representado como un par de puntos. Este par de electrones forma el enlace con el catión hidrógeno H+.
En el ion amonio, el átomo de nitrógeno forma cuatro enlaces covalentes, en vez de tres como en el amoníaco, formando una estructura que es isoelectrónica a la molécula de metano y, en consecuencia, es energéticamente favorable.
La formación de los compuestos de amonio también puede suceder en la fase de vapor; por ejemplo, cuando vapores de amoníaco entran en contacto con vapores de cloruro de hidrógeno, se forma una nube blanca de cloruro de amonio, que eventualmente se deposita como una capa delgada de sólido sobre las superficies. Los cationes amonio se asemejan a los metales alcalinos como el Na+ o el K+ y puede ser encontrado en sales como el bicarbonato de amonio, cloruro de amonio, y nitrato de amonio. Las sales de amonio más simples son muy solubles en agua.
La reducción del catión amonio libera gas amoníaco e hidrógeno:
Los radicales de amonio pueden disolverse en mercurio para formar una amalgama. Prácticamente puede llevarse a cabo mediante la electrólisis de una solución de amonio con un electrodo de mercurio.[1] Esta amalgama se descompone espontáneamente para producir amoníaco e hidrógeno.[2]
Grupos de radicales orgánicos
Dependiendo del grado de sustitución del hidrógeno por grupos alquílicos, el grupo se puede llamar catión de amonio primario, secundario, terciario, o cuaternario. Existen en equilibrio con su respectiva amina sustituida, dependiendo del pH.
Solo los cationes de amonio cuaternarios están cargados permanentemente. Estos cationes, vg. el catión tetra-n-butilamonio son usados algunas veces para reemplazar a los iones sodio o potasio e incrementar la solubilidad global de los compuestos en solventes orgánicos, basados en los principios HSAB. Las sales de amonio cuaternario son usados frecuentemente como catalizadores de transferencia de fase por la misma razón.
Un ejemplo de una reacción que forma un ion amonio es la que hay entre la dimetilamina, (CH3)2NH, con un ácido para producir el catión dimetilaminio, (CH3)2NH2+:
Biología
Los iones amonio son un producto tóxico de desecho del metabolismo en los animales. En los peces e invertebrados acuáticos, se excreta directamente en el agua. En mamíferos, tiburones, y anfibios, se convierte en el ciclo de la urea en urea, debido a que es menos tóxica y puede ser almacenada más eficientemente. En aves, reptiles y serpientes terrestres, el amonio metabólico es convertido en ácido úrico, que es sólido, y puede ser excretado con mínimas pérdidas de agua.[3]
El amonio es tóxico para los humanos en altas concentraciones, y puede causar daños en la mucosa que recubre los pulmones, o quemaduras alcalinas.[4]
Véase también
Referencias
- ↑ Pseudo-binary compounds
- ↑ «Ammonium Salts». VIAS Encyclopedia.
- ↑ Campbell, Neil A.; Reece, Jane B. (2002). «44». Biology (6th edition edición). San Francisco, California: Pearson Education, Inc. pp. 937-938. ISBN 0-8053-6624-5.
- ↑ «Ammonia Toxicity».