Diferencia entre revisiones de «Islotes pancreáticos»
Sin resumen de edición |
→Estructura: Secciones nivel 3 con Texto y Referencia |
||
| Línea 77: | Línea 77: | ||
[[File:Islote morfología capilares.png|thumb|220px |Capilares en un islote pancreático aislado. Se ven como bucles y ovillos blancos.]] |
[[File:Islote morfología capilares.png|thumb|220px |Capilares en un islote pancreático aislado. Se ven como bucles y ovillos blancos.]] |
||
Los islotes están irrigados por [[arteriolas]], procedentes del estroma. El tamaño del islote (entre 50-100{{esd}}[[Micrómetro|micrómetros (µm)]] determina el diámetro de la arteriola aferente. La arteriola al entrar en el islote se divide en [[Capilar sanguíneo#Capilares fenestrados o viscerales| capilares]]. El lecho capilar del islote pancreático muestra una disposición en ovillos y bucles cercanamente enrollados |
Los islotes están irrigados por [[arteriolas]], procedentes del estroma. El tamaño del islote (entre 50-100{{esd}}[[Micrómetro|micrómetros (µm)]] determina el diámetro de la arteriola aferente. La arteriola al entrar en el islote se divide en [[Capilar sanguíneo#Capilares fenestrados o viscerales| capilares]]. El lecho capilar del islote pancreático muestra una disposición en ovillos y bucles cercanamente enrollados |
||
=== Linfáticos en el islote === |
|||
Durante años se había considerado que los islotes carecían de vasos linfáticos funcionales.<br> |
|||
Los linfáticos peri-islotes e intra-islotes podrían participar en la regulación de la inflamación de los islotes. <br> |
|||
Los estudios muestran que los vasos linfáticos (en ratones NOD) están adyacentes a los islotes inflamados, y también se encuentra una red linfática funcional en los islotes trasplantados.<ref>{{Cita publicación |autor= Yin N.|autor2= Zhang N. |autor3= Lal G.|autor4= Xu J. |autor5= Yan M.|autor6= Ding Y. |autor7= Bromberg J.S.|año= 2011 |título= Lymphangiogenesis Is Required for Pancreatic Islet Inflammation and Diabetes |publicación= PLoS ONE|volumen= 6|número= 11|páginas= e28023 |url= https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0028367 |doi= 10.1371/journal.pone.0028023 |fechaacceso= 26 de setiembre de 2022}}[[File:CC-BY_icon.svg |65x65px|.]]</ref> |
|||
== Genética celular == |
== Genética celular == |
||
Revisión del 13:59 26 sep 2022
| Islotes pancreáticos | ||
|---|---|---|
 | ||
| Nombre y clasificación | ||
| Sinónimos |
| |
| Latín | [TA]: insulae pancreaticae | |
| TA | A05.9.01.019 | |
| Información anatómica | ||
| Sistema | Endócrino | |
| Arteria |
Arteria pancreaticoduodenal superior Ramas pancreáticas de la arteria esplénica Arteriolas insulares | |
|
| ||
Los islotes pancreáticos o islotes de Langerhans son estructuras de cúmulos de células del páncreas, con función exclusivamente endócrina, que se encargan de producir hormonas como la insulina y el glucagón. También secretan inmunoglobulinas.
Están formados por 1000-3000 células endócrinas de diferente
tipo que incluyen: células alfa (α), células beta (β), células delta (δ), células gama (γ), células G y células epsilon (ε).
Por el contrario, los acinos son las glándulas de secreción externa (exócrinas) del páncreas, encargadas de secretar enzimas hacia el tubo digestivo.
Estructura
Los acúmulos de células endócrinas del páncreas forman pequeños racimos o islotes, dispersos por todo el órgano. Estos islotes fueron descritos originalmente por el histólogo alemán Paul Langerhans, de donde deriva el nombre epónimo.
Hay más de un millón ( 1-3 × 106) de tales islotes en el páncreas humano normal.
Además los islotes están compuestos por células vasculares (células endoteliales, pericitos), eritrocitos, células del estroma (fibroblastos), células inmunitarias (granulocitos, linfocitos, macrófagos, células dendríticas) y células neurales (neuronas).
Microaquitectura
Los Islotes pancreáticos tienen un tamaño entre 100-500 micrómetros (μm) y cada uno agrupa 1000-3000 células endócrinas de diferente tipo.[1]

En los cortes teñidos con H&E, tienen el aspecto de islotes irregulares de color rosa pálido, distribuidos extensamente entre los acinos exocrinos de color más oscuro.
Para diferenciar las células insulares se necesitan métodos de tinción especial como el de Gomori o tinción inmunofluorescente mediante inmunohistoquímica.
En el Islote pancreático la proporción de las diferentes células endócrinas varía según la especie.
La localización tridimensional de las células dentro del Islote también es diferente. Los islotes humanos carecen de la arquitectura típica de núcleo y manto de los islotes de ratón/rata y las células β están entremezcladas con las células α, δ, G, γ y ε.[2] [3] [4]
| Células Alfa (α) glucagón |
Células beta (β) insulina |
Células delta (δ) somatostatina |
Células gama (γ, F, PP) polipéptido pancreático |
Células (G) gastrina |
Células epsilon (ε) grelina | |
|---|---|---|---|---|---|---|
| Murinos | 15% | 75% | 10% | 5% | - | 1% |
| Humano | 33-46% [2] 34.4 ±2.5% [3] |
48-60% 53.9 ±2.5% |
8-12% 10.4 ±0.9% |
2%[4] - |
- - |
- - |
Gran parte de estas células endócrinas son células β (beta) relativamente pequeñas y de color azul.
En grupos pequeños alrededor de las células beta, se identifican células de mayor tamaño de color rosa células α (alfa).
Además, poseen también células delta, células F (PP) y epsilon. Las células beta son las más comunes y las ε las más raras.
Las sustancias que producen cada una de estas células son:

- Células alfa (α): producen la hormona polipeptídica glucagón.
- Células beta (β): producen las hormonas polipeptídicas insulina y amilina (a una razón de 100:1 respectivamente).
- Células delta (δ): producen el péptido somatostatina.
- Células gama ( γ) F: producen un polipéptido pancreático que inhibe las secreciones exocrinas del páncreas y la motilidad del estómago y del intestino.
- Células G: producen la hormona polipéptida gastrina que estimula la producción de HCl por las células parietales del estómago.
- Células epsilon (ε): producen la hormona grelina.[5] [6]
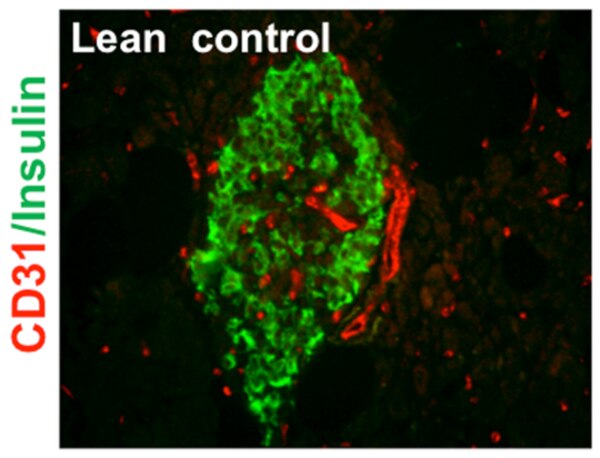
Circulación en el islote
Los islotes representan solamente 1-2% del total de la masa pancreática, pero están densamente vascularizados y abastecidos por 5-15% del flujo sanguíneo que ingresa al páncreas.[7]
Como micro-órgano endócrino, el islote necesita un flujo sanguíneo constante, para así poder detectar y responder con rapidez a los cambios plasmáticos. Están muy vascularizados in vivo y cada célula beta secretora de insulina, está asociada con al menos una célula endotelial.[8]

Los islotes están irrigados por arteriolas, procedentes del estroma. El tamaño del islote (entre 50-100 micrómetros (µm) determina el diámetro de la arteriola aferente. La arteriola al entrar en el islote se divide en capilares. El lecho capilar del islote pancreático muestra una disposición en ovillos y bucles cercanamente enrollados
Linfáticos en el islote
Durante años se había considerado que los islotes carecían de vasos linfáticos funcionales.
Los linfáticos peri-islotes e intra-islotes podrían participar en la regulación de la inflamación de los islotes.
Los estudios muestran que los vasos linfáticos (en ratones NOD) están adyacentes a los islotes inflamados, y también se encuentra una red linfática funcional en los islotes trasplantados.[9]
Genética celular
La Ontogenia de los diferentes tipos de células de los islotes se ha estudiado ampliamente en ratones, donde los progenitores endocrinos comienzan a expresar ARX o PAX4, empujando su especificación hacia el destino de las células α o β.
Los factores de transcripción específicos del tipo de célula guían a las células hacia la maduración.
Para las células α, los factores de transcripción incluyen: MAFB, IRX2 y BRN4.
Son factores de transcripción clave para la maduración de las células β: PDX1, MAFA y NKX6.1.
El desarrollo de la secuenciación de ARN de una sola célula (scRNA-Seq en inglés) permite perfilar el contenido de ARNm de células individuales de tejidos heterogéneos. Ofrece una oportunidad para caracterizar mejor las identidades celulares de las diferentes células de los islotes pancreáticos humanos.
Los conjuntos de genes definen con precisión los diferentes tipos de células de los islotes.[10]
Los genes relacionados con las células α: GCG, ARX, FEV y TM4SF4.
Los genes clave relacionados con las identidades de las células β: INS, IAPP, DLK1 y RBP4.
Los genes relacionados con las células γ: PPY, ID2, ETV1.
Genes clave relacionados con las identidades de las células δ: SST, RBP4, HHEX, LEPR.[5]
Bioquímica celular
Células alfa y glucagón

Los gránulos secretores que contienen glucagón de las células alfa (α) con un diámetro de 250-300 nanómetros (nm), que poseen un contenido electrodenso que llena las vesículas. Tienen una gran zona central esférica muy electrodensa rodeada por un reborde angosto menos electronicodenso.
El glucagón aumenta el nivel de glucosa sanguínea (glucemia) al estimular la formación de este carbohidrato a partir del glucógeno almacenado en hepatocitos (glucogenolisis). También ejerce efecto en el metabolismo de proteínas y grasas. La liberación del glucagón es inhibida por la hiperglucemia.
Células beta e insulina

Los gránulos secretores insulinógenos de las células beta (β), poseen un centro cristalino electrodenso de forma irregular. Su contenido se separa de la membrana limitante después de la fijación. Su diámetro es similar al de los gránulos de células alfa.
La insulina es sintetizada en el retículo endoplásmico rugoso en forma de un polipéptido llamado preproinsulina que se transforma en proinsulina, que posee la misma actividad hormonal aunque no de la misma magnitud que la insulina. La proinsulina se modifica en el aparato de Golgi y las vesículas secretoras que salen del complejo mencionado contienen la hormona insulina. La insulina es secretada en reacción a la hiperglucemia y también por algunas hormonas péptidas como glucagón, colecistocinina-pancreocimina y secretina. Sus acciones principales son estimular la captación de glucosa en varios tipos de células, y disminuir el nivel de glucosa sanguínea, al estimular la conversión de glucosa en glucógeno en los hepatocitos y miocitos, siempre que aumente dicho nivel.
Células delta y somatostatina
Las células delta (δ) poseen gránulos secretores más grandes y menos electrodensos que las células alfa y beta, y sus organelos secretores son menos notables.
La somatostatina es una neurohormona péptida y neurotransmisora que inhibe la liberación de la hormona del crecimiento, de la insulina, el glucagón e incluso de la propia somatostatina pancreática. La regulación mutua de la actividad secretora entre las células alfa, beta y delta sugiere fuertemente alguna disposición especial que facilita la regulación directa de una célula con otra, mecanismo conocido como regulación paracrina.
Células gama y polipéptido pancreático
Las células gama (γ) antes conocidas como F y como PP, se encuentran en la periferia del islote. Son pequeñas y redondeadas y secretan el llamado polipéptido pancreático (PP).
La secreción de polipéptido pancreático es una parte importante del eje páncreas-intestino-cerebro. El PP tiene acciones inhibitorias en gran medida en el intestino, lo que reduce el vaciamiento gástrico y la actividad motora intestinal a través de acciones en el receptor Y4 (PPYR1).[11]
Células G y gastrina
Las células G secretan la hormona llamada gastrina que, tras ser liberada, pasa a la sangre y estimula el vaciamiento gástrico y la producción de ácido clorhídrico por las células parietales del estómago.[12]
Células epsilon y grelina
Las células epsilon (ε) secretan la hormona llamada grelina que, tras ser liberada, pasa a la sangre, estimula la secreción de hormona del crecimiento (GH) en la hipófisis y favorece la regulación del metabolismo energético regulando el peso corporal y la ingesta.[5]
Patología
Tumores de los islotes del páncreas
Los tumores neuroendocrinos pancreáticos son los tumores de las células de los islotes, es un tipo de cáncer que comienza en el páncreas.
La mitad de los tumores neuroendocrinos pancreáticos producen hormonas que son liberadas a la sangre y causan síntomas.[13]
Las células de algunos tumores neuroendocrinos pancreáticos continúan secretando hormonas y se llaman tumores funcionales, lo que genera una cantidad excesiva de una determinada hormona en el cuerpo.[14]
Los insulinomas se originan de las células productoras de insulina.
Los glucagonomas surgen de las células productoras de glucagón.
Los gastrinomas surgen de las células productoras de gastrina.
Los somatostatinomas se originan de las células productoras de somatostatina.
Los VIPomas surgen de las células productoras de péptido intestinal vasoactivo (VIP).
Los tumores que secretan ACTH provienen de células que producen la hormona adrenocorticotrópica.
La mayoría (hasta el 70%) de los tumores neuroendocrinos pancreáticos funcionales son insulinomas.[13]
Referencias
- ↑ Alfredo Jácome Roca; Enrique Ardila Ardila; Luz Angela Casas Figueroa (2022). «5:Páncreas endocrino». Fisiología Endócrina (4.a edición). El Manual Moderno. p. 97. Consultado el 12 de septiembre de 2022.
- ↑ a b Cabrera O.; Bergman D.M; Kenyon N.S.; Ricordi C.; Berggren P-O.; Caicedo A. (2006). «The unique cytoarchitecture of human pancreatic islets has implications for islet cell function». Proc Natl Acad Sci USA. Medical Sciences 103 (7): 2334-2339. PMC 1413730. PMID 16461897. doi:10.1073/pnas.0510790103. Consultado el 12 de setiembre de 2022.

- ↑ a b Brissova M.; Fowler M.J.; Nicholson W.E; Chu A.; Hirshberg B.; Harlan D.M.; Powers A.C. (2005). «Assessment of Human Pancreatic Islet Architecture and Composition by Laser Scanning Confocal Microscopy». Journal of Histochemistry & Cytochemistry 53 (9): 1087-1097.

- ↑ a b Wang X.; Zielinski MC.; Misawa R.; Wen P.; Wang T-Y.; Wang C-Z.; Witkowski P.; Hara M. (2013). «Quantitative Analysis of Pancreatic Polypeptide Cell Distribution in the Human Pancreas». PLoS ONE (en inglés) 8 (1): e55501. Consultado el 16 de enero de 2018.

- ↑ a b c Wierup N.; Sundler F.; Heller R.S. (2013). «The islet ghrelin cell». J Mol Endocrinol (Artículo de revisión) 52 (1): R35-49. doi:10.1530/JME-13-0122. Consultado el 13 de setiembre de 2022.

- ↑ Quesada Candela C. (2016). p7. «Adaptaciones de las poblaciones celulares alfa y beta del islote de Langerhans a la preñez en ratonas C57BL/6». Revista Doctorado (Unidad de Fisiología Celular y Nutrición. Instituto de Bioingeniería. Universidad Miguel Hernández de Elche (UMH)) 2 (1).

- ↑ Shah P.; Lueschen N.; Ardestani A.; Oberholzer J.; Olerud J.; Carlsson P-O, et al. (2016). «Angiopoetin-2 Signals Do Not Mediate the Hypervascularization of Islets in Type 2 Diabetes». PLOS ONE 11 (9): e0161834. Consultado el 20 de mayo de 2018.

- ↑ Sankar KS.; Green BJ.; Crocker AR.; Verity JE.; Altamentova SM.; Rocheleau JV. (2011). «Culturing Pancreatic Islets in Microfluidic Flow Enhances Morphology of the Associated Endothelial Cells.». PLOS ONE 6 (9): e24904. Consultado el 22 de enero de 2018.

- ↑ Yin N.; Zhang N.; Lal G.; Xu J.; Yan M.; Ding Y.; Bromberg J.S. (2011). «Lymphangiogenesis Is Required for Pancreatic Islet Inflammation and Diabetes». PLoS ONE 6 (11): e28023. doi:10.1371/journal.pone.0028023. Consultado el 26 de setiembre de 2022.

- ↑ León van Gurp; León Fodoulian; Daniel Oropeza; Kenichiro Furuyama; Eva Bru Tari; Anh Nguyet Vu; Juan S. Kaddis; Iván Rodríguez ; Fabricio Thorel ; Pedro L Herrera (2022). «Generation of human islet cell type-specific identity genesets». Nature Communications 13 (2020). Consultado el 13 de setiembre de 2022.

- ↑ Brereton MF. (2015). «Alpha-, Delta- and PP-cells. Are They the Architectural Cornerstones of Islet Structure and Co-ordination?». J Histochem Cytochem. 63 (8): 575-591. doi:10.1369/0022155415583535.

- ↑ «Tumores neuroendocrinos pancreáticos». Mayo Clinic. 2021.
- ↑ a b «¿Qué es tumor neuroendocrino?». American Cancer Society ACS. 2019.
- ↑ «Tumores neuroendocrinos pancreáticos». Mayo Clinic.