Usuario:Emilio Bosch/borrador Péptido de Penetración Celular
Los péptidos de penetración celular (CPPs, por sus siglas en inglés) son péptidos cortos que facilitan la admisión de varias cargas moleculares (desde nano-partículas hasta pequeñas moléculas químicas y fragmentos de ADN largos). La "caga" está asociada a los péptidos a través de uniones químicas via enlaces covalentes o a través de interacciones no covalentes. La función de las CPPs es entregar la carga hacia el interior de las células, un proceso que comúnmente ocurre a través de la endocitosis con la carga entregada a los endosomas de las células mamíferas vivas.
Los CPPS presentan gran potencial como vectores de administración de forma in vitro como in vivo para su uso en investigación y medicina. Actualmente se están limitados debido a la falta de especificidad celular en la administración de carga mediada por CPP y la insuficiencia en el entendimiento en los modos de la admisión.
Usualmente los CPPs están compuestos por aminoácidos que contienen una relativa carga positiva abundante como la lisina o la arginina o que contengan una secuencia de patrones alternados entre aminoácidos polares y no polares, aminoácidos hidrofóbicos. A estos dos tipos de estructuras se les conoce como policatiónica o anfipática, respectivamente. Una tercera clase de CPPs son los péptidos hidrofóbicos, que contienen únicamente residuos apolares, con baja carga neta o que tienen grupos de aminoácidos hidrofóbicos que son cruciales para la admisión celular.[1][2]
El primer CPP se descubrió de manera independiente por dos laboratorios en 1988, cuando se descubrió que el transactivador de la transcripción génica (TAT, por sus siglas en inglés) del virus de la inmunodeficiencia humana 1 (HIV-1) podía ser tomado de manera eficiente del medio circundante por numerosos tipos de células en cultivo.[3] Desde entonces, el número de CPPs se ha expandido considerablemente y se han generado pequeñas moléculas con proteínas con mayor efectividad en las propiedades transducción.[4]
Mecanismos para la translocación membranal
[editar]Los péptidos de penetración celular son de diferentes tamaños, secuencias de aminoácidos y cargas, pero todos los CPPs tienen una característica distintiva, la cual es la habilidad de translocar la membrana plasmática y facilitar la administración de cargas moleculares al citoplasma o a órganelos. No ha habido un consenso real acerca del mecanismo de la translocación por CPPs, pero las teorías se clasifican en tres principales mecanismos: penetración directa de la membrana, entrada mediada por endocitosis, y la translocación a través de la formación de estructuras transitorias. La tranducción es una área con investigación en curso.[5][6]
Los CPPs son capaces de transportar diferentes cargas moleculares a través de la membrana; en consecuencia, actúan como vehículos de administración moleculares. Los CPPs tienen numerosas aplicaciones en en a medicina como agentes de administración de fármacos para el tratamiento de diferentes enfermedades, incluyendo al cáncer, inhibidores virales, así como agentes de contraste para marcar células. Ejemplos incluyen el actuar como carriers para GFP, agentes de contraste MRI o puntos cuánticos.[7]
Penetración directa
[editar]La mayoría de la investigación inicial sugería que la translocación de los CPPs policatiónicos a través de la membrana biológica ocurría via un proceso celular independiente de energía. Se creía que la translocación podía llevarse a cabo a 4ºC y que lo más seguro es que involucraba una interacción electrostática directa con fosfolípidos cargados de forma negativa. Investigadores propusieron diferentes modelos en un intento de elucidar el mecanismo biofísico de este proceso independiente de energía, Aunque los CPPs promueven efectos directos en las propiedades biofísicas de sistema puro de membrana, la identificación de artefactos fijados cuando se usan CPPs de sondas marcadas fluorescentemente causó que se hiciera una re-evaluación del mecanismo del importe de CPPs.[8] Estos estudios promueven la endocitosis como la vía de translocación. Un ejemplo de la penetración directa se ha propuesto para TAT. EL primer paso en este modelo propuesto es la interacción con proteínas de fusión no dobladas (TAT) y la membrana a través de interacciones electrostáticas, que desbarata suficientemente la membrana para permitir que las proteínas de fusión crucen. Después de la internalización las proteínas de fusión se repliegan debido a un sistema de chaperón. Este mecanismo no se aceptó y otros mecanismos involucrando una endocitosis dependiente de clatrina se han sugerido.[9] [10]
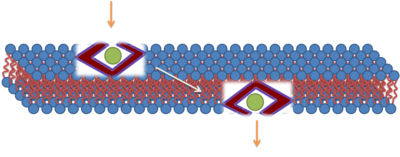
Recientemente, un modelo detallado de la translocación directa a través de la membrana plasmática se ha propuesto.[11][12] Este mecanismo involucra interacciones fuertes entre los péptidos de penetración celular y los grupos fosfato en los dos lados de la bicapa lipídica, la inserción de cadenas laterales con cargas que nuclean la formación de un poro transitorio, seguido por la translocación del péptido al difundirse por la superficie del poro. Este mecanismo explica como ingredientes clave, como la cooperatividad entre péptidos, la gran carga positiva y específicamente los grupos guanidinio, contribuyen a la admisión. El mecanismo propuesto también ilustra la importancia de las fluctuaciones membranales. En efecto los mecanismos que involucran grandes fluctuaciones en la estructura membranal como los poros de transición y la inserción de cadenas laterales de aminoácidos cargados, pueden ser comunes y posiblemente centrales en la función de muchas proteínas de membrana. Este modelo contiene muchas características con controversia, siendo el más notorio, la generación de poros de transición que facilita la difusión de péptidos a través de la membrana o el vesícula endosomal hacia el citosol. Datos experimentales recientes validan este ingrediente clave del modelo, mostrando que los CPPs generan los poros de transición en la bicapa lipídica y en células vivas.[13]
Translocación mediada por endocitocis
[editar]
La endocitosis es el segundo mecanismo responsable de la internalización celular. La endocitosis es el proceso de la ingestión celular con la cual la membrana plasmática se pliega hacia adentro para atraer sustancias hacia la célula. Durante este proceso la célula absorbe material del exterior al introducirla a su membrana. La clasificación de la localización celular usando fluorescencia o con inhibidores de la endocitosis es la base de cualquier examinación. Sin embargo, el procedimiento usado durante la preparación de estas muestras crea información cuestionable con referencia a la endocitosis. Por otra parte, estudios muestran que la entrada de penetratina por endocitosis es un proceso dependiente de energía. Este proceso es iniciado por poliargininas interactuando con sulfato de heparán que promueven la endocitosis. La investigación muestra que TAT es introducido mediante una forma de endocitosis llamada macropinocitosis.[14][15]
Estudios han enseñado que la endocitosis está involucrada en la internalización de CPPs, pero se ha sugerido que diferentes mecanismos pueden ocurrir al mismo tiempo. Esto establece por el comportamiento reportado para la penetratina y transpotan ocurre la translocación de membrana y la endocitosis simultáneamente.[16][17]
Translocación mediante la formación de estructuras transitorias
[editar]
El tercer mecanismo responsable de la translocación está basado en la formación de micelas invertidas. Estos son agregados de surfactantes coloides donde los grupos polares se concentran en el interior y los grupos lipofílicos se extienden afuera hacia el solvente. De acuerdo con este modelo, un dímero de penetratina se combina con fosfolípidos con carga negativa, así generando la formación de micelas invertidas dentro de la bicapa lipídica. La estructura de estas micelas permite al péptido permanecer dentro del ambiente hidrofílico.[18][19][20] No obstante este mecanismo sigue siendo asunto de debate, debido a que la distribución de la penetrina entre el interior y exterior de la membrana es no-simétrico. Esta distribución no-simétrica produce un campo eléctrico que se ha establecido de forma correcta. Incrementando la cantidad de péptidos en los prospectos exteriores de la membrana causa que el campo eléctrico alcance un valor crítico que genera un evento parecido a la electroporación.
El último mecanismo implica que la internalización ocurre por péptidos que pertenecen a la familia de péptidos anfipáticos primarios, MPG y Pep-1. Dos modelos muy similares se han propuesto basados en estudios fisicoquímicos, que constan de un dicroísmo circular, espectroscopia infrarroja con transformada de fourier, y una espectroscopia de resonancia magnética nuclear. Estos modelos están asociados con mediciones electrofisiológicas e investigaciones que tienen la habilidad de mimetizar modelos membranales como la monocapa en la interfase aire-agua. La estructura dando lugar a los poros es la principal diferencia entre el modelo MPG propuesto y el Pep- 1. En el modelo MPG, el poro se forma por una estructura b-barril, mientras que en el Pep-1 está asociada con hélices. También, fuertes interacciones hidrofóbicas fosfolípido-péptido se han descubierto en ambos modelos.[21] [22] En los dos modelos peptídicos, los plegamientos de la molécula carrier se correlaciona con el dominio hidrofóbico, aunque el resto de la molécula permanece sin estructurar.[23]

Los CPPs facilitando la translocación es un tema de gran debate. Evidencia ha sido presentada donde la translocación puede usar múltiples diferentes vías para la admisión. En adición, los mecanismos de translocación pueden depender si los péptidos están libres o adheridos a la carga. La admisión cuantitativa de CPP libre o conectada puede diferir en gran mediad, pero estudios no han demostrado si este cambio es el resultado de la eficiencia de la translocación o las diferentes vías en la translocación. Es probable que el resultado indica que múltiples mecanismos de CPP están en competencia y que diferentes vías contribuyen a la internalización de CPP.[24]
Aplicaciones de las CPPs
[editar]Administración de ácidos nucleicos mediada por CPPs
[editar]Macromoléculas basadas e ácidos nucléicos como los siRNA, oligonucleotides antisentido, DNA señuelo, y plásmidos han sido identificados como terapéuticos biológicos y farmacológicos en la regulación de la expresión génica.[25][26][27] Sin embargo, diferente a otros fármacos pequeños moleculares, su desarrollo y aplicaciones están limitadas por su alto peso molecular y cargas negativas, que resulta en una pequeña eficiencia de admisión y poco tráfico celular. Para vencer estos problemas, se han desarrollados múltiples diferentes mecanismos de administración, incluyendo CPP-ácido nucléico conjugado, que es una herramienta muy poderosa.
Formación de complejos CCP-ácido nucléico
[editar]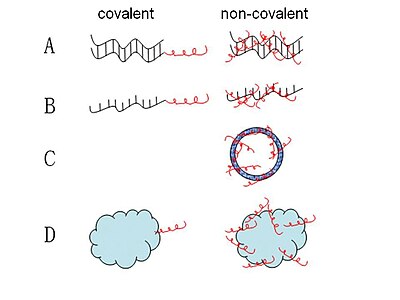
La mayoría de los complejos CPP-ácido nucléico que se han propuesto hasta ahora se forman a través de enlaces covalentes. Un rango de estos complejos se han sintetizado a través de diferentes químicas que son enlaces estables o plegables. Y el método más usado en publicaciones es el de enlaces plegables disulfido a través de una síntesis fase-sólida paso a paso o fase-solución o emparejamiento fragmentado fase-sólida.[28] Algunas otras estrategias como la amida estable, tiazolidina, oxima y la vinculación de hidrazina también se han desarrollado.[29] Sin embargo, esos métodos de enlaces covalentes están limitados por la preocupación que el enlace sintético entre el CPP y el ácido nucléico pueda alterar la actividad biológica de la hebra.[30] Por ello, se ha aplicado de manera efectiva una estrategia nueva no-covalente que no requiera de modificaciones químicas con cortos CPPs anfipáticos, como los MPG y Pep-1 como carriers para la administración de carga.[31][32] Estos enlaces no-covalentes conjugados se forman a través de interacciones electrostáticas o hidrofóbicas. Con este método, la carga como los ácidos nucléicos y proteínas pueden ser administradas de forma eficiente mientras se mantiene su actividad biológica completa.

CPPs para la administración de siRNA
[editar]RNA de interferencia corto (siRNA) es una poderosa nueva herramienta que pueden interferir y silenciar la expresión de genes específicos de enfermedades.[33] Para mejorar la admisión de siRNA, la estrategia de CPP se ha aplicado para facilitar la administración de siRNA hacia la célula a través de enlaces covalentes o no covalentes. En un estudio, el siRNA está enlazado covalentemente al transportan y penetratina por disulfuro vinculación a extremo 5 'de las cadenas de sentido de siRNA para marcarla se usó luciferasa o eGFP mRNA reportero.[34] En otro estudio, TAT-siRNA conjugada mediante un enlace thiomaleimide al extremo 3 'de la siRNA fue administrado a células HeLa para silenciar genes eGFP.[35]
Sin embargo, las estrategias no covalentes parecen ser mejores para la administración de siRNA con una respuesta biológica significativamente mayor. En un estudio, complejos de MPG/siRNA formados a través de una estrategia estable no covalente mostraron la introducción exitosa de siRNA hacia células en cultivos e inducieron regulación robusta del mRNA objetivo.[32] Adicionalmente los complejos MPG/siRNA se han usado para administrar siRNA in vivo en blastocitos de ratón para la regulación de genes.[36] El MPG forma complejos muy estables con el siRNA con una tasa de degradación lenta y puede ser fácilmente hacerse funcionables para objetivos específicos, que es una de las mayores ventajas comparandola con las tecnologías covalentes.
Diseño de nuevos sustratos para la administración de siRNA
[editar]La administración celular de siRNA representa una herramienta valiosa para el tratamiento de enfermedades cancerígenas, infecciones virales y desordenes genéticos. Sin embargo, las herramientas clásicas involucran que las moléculas en la carga estén enlazadas con enlaces covalentes a las CPPs, que no provee de una eficiente protección de las moléculas de siRNA in vivo, por ello resultados publicados en la literatura no son consistentes. Recientemente, las estrategias no covlaentes se han reportado de manera exitosa. Péptidos anfipáticos secundarios basados en los resiudos de triptofano aromático y arginina enlazados con lisina como un espaciador se han reportado con el nombre de CADY. CADY contiene un péptido de secuencia corta de 20 aminoácidos, con la secuencia "Ac-GLWRALWRLLRSLWRLLWRA-cisteamida."[37] Este péptido es capaz de auto-ensamblarse en una forma helical con residuos hidrofóbicos e hidrofílicos en diferentes lado de la molécula, tiene dos diferentes orientaciones de la superficie que representa la menor energía y es capaz de formar complejos con el siRNA a diferentes tasa molares variando de 1:1 a 80:1. CADY es capaz de formar un escudo alrededor de la molécula de siRNA protegiéndola de procesos biodegradativos que pueden ocurrir antes de la penetración celular. Este tipo de sustancias pueden presentar importantes aplicaciones in vivo.
CPPs para la administración de oligómeros antisentido
[editar]Oligonucleótidos antisentido (asONs) son una gran promesa para aplicaciones antisentido en investigación básica y tratamiento clínico.Y en años recientes, las estrategias de CPPs se han desarrollado para administrar oligómeros antisentido como PNA y PMO dentro de células y han demostrado tener potencial para incrementar la biodisponibilidad, que de otra manera restringe la aplicación de los asONs. Debido a la repulsión de la membrana celular hacia las ONs cargadas negativas y la degradación por enzimas, dos tipos de ON análogas neutrales son dominantes en esta área, los ácidos peptidonucléico (PNA) y los oligómeros de morfolino fosfodiamidato (PMO o morfolino). Los PNA se han conjugado con varios CPPs a través de enlaces disulfidos o por enlaces amida estables.[38] Un ejemplo es la actividad antisentido dentro de las células que bloqueó la expresión de los receptores de galanina en humanos cuando 21-mer PNA fue enlazada con penetratina.[39] Resultados en actividad antiviral con PNA enfocada a HIV-1 han sido demostrados a través de enlaces disulfuros con TAT.[40] Conjugados CPP-PMO han demostrado de manera efectiva inhibir la replicación de múltiples virus como el SARS[41] e influenza[42] y el adherir CPPs ha mejorado la eficacia del empalme de morfolino modificado en el desarrollo para un tratamiento para la distrofía muscular de Duchenne.[43]
CPPs para la administración de ADN señuelo
[editar]El ADN señuelo (dsDNA) es una doble hebra exógena, que puede mímica una secuencia promotora que puede inhibir la actividad de un factor específico de transcripción.[44] Pero la dsDNA tiene el mismo problema como otras terapéutica, baja biodisponibilidad. En un estudio, los CPPs TP y TP10 fueron enlazados a NFкB un ADN señuelo, que bloquea el efecto de la interleucina 1-induciendo la activación NFкB y la expresión del gen IL-6.[45] En otro estudio, TP10 se enlazó con Myc ADN señuelo bajando la capacidad de proliferación de células N2a.[46]
CPPs para la administración de plásmidos
[editar]Genes individuales pueden ser insertados en sitios específicos en plásmidos, y plásmidos recombinantes pueden ser introducidos en células vivas. Un método usandoTAT macroramificado a sido propuesto para la administración de plásmidos de DNA en varias líneas celulares y demostró capacidades significativas de transfección.[47] Multímeros de TAT han demostrado tener un incremento en la eficiencia de los plásmidos de DNA de 6-8 veces más que poli-L-arginina o la mutante TAT2-M1, y por 390 veces comparada con vectores estándar.[48]
Administración de proteínas mediada por CPP
[editar]El desarrollo de proteínas terapéuticas que ha presentado un método valioso para tratar enfermedades está limitado por la baja eficacia de los métodos tradicionales. Recientemente, múltiples métodos usando CPPs como vehículos para administrar proteínas biológicamente activa y de tamaño completo dentro de células vivas y animales se ha reportado.
Varios grupos han tenido éxito en administrar CPP fusionadas con proteínas in vitro. TAT fue capaz de administrar diferentes proteínas, como peroxidasa de rábano picante y la RNasa A a través de la membrana celular hacia el citoplasma en diferentes líneas celulares in vitro. El rango de tamaño para la administración efectiva es de 30 kDa a 120-150kDa. En otro estudio, proteínas fucionadas con TAT se internalizan rápidamente mediante una macropinocitosis dependiente de una balsa lipídica usando un ensayo TAT-recombinasa Cre reportera en células vivas.[49] En otro estudio,TAT-proteína de fusión fue administrada a la mitocondria de células mamarias cancerígenas y disminuyendo la supervivencia de las mismas se demostró la capacidad de las TAT-proteínas de fusión para modular la función mitocondrial y la supervivencia celular. Sin embargo, muy pocos estudios in vivo han sido exitosos. En un estudio, la administración in vivo de TAT-o penetrina- reticulada con fragmentos Fab cedió la distribución variada del órgano e incrementó de manera general la retención del órgano, que demostró la localización de tejido.[50]
Un método no covalente que forman los complejos CPP-proteínas también se han desarrollado para hacer frente a as limitaciones de los métodos covalentes, como las modificaciones químicas antes de la reticulación y la desnaturalización de proteínas antes de la administración. En un estudio, un péptido corto anfipático carrier, Pep-1, y complejos protéicos han demostrado efectividad en la administración. Se ha mostrado que Pep-1 facilita la rápida entrada celular de varios péptidos, proteínas e incluso anticuerpos de tamaño completo con alta eficiencia y menor toxicidad. Este acercamiento ha simplificado en gran medida la formulación de reactivos.[51]
CPP como transportadores de agentes de contraste
[editar]Hay aplicaciones de los CPPs como transportadores de agentes de contraste a través de la membrana plasmática. Estos agentes de contraste son capaces de marcar células tumorales, haciendo de los compuestos herramientas importantes para el diagnóstico de cáncer; también han sido usadas tanto en experimentos celulares in vivo como in vitro. Las clases más importantes de CPPs se aíslan de virus, como el TAT (transcripción-transactivada) derivada de VIH-1, penetrina y transportan. Los CPPs más utilizados son derivados de TAT. TAT es un CPP rico en arginina. Varios mejoraminetos incluyen el uso de aminoácidos no naturales β o γ. Esta estrategia ofrece múltiples ventajas, como la resistencia a la degradación protelítica, un proceso de degradación natural donde los enlaces del péptido se hidrolizan a aminoácidos. La inserción de aminoácidos no naturales en la cadena peptídica tiene muchas ventajas. Facilita la formación de plegómeros estables con distinta estructura secundaria.[52][53][54] Los péptidos β mimetizan la actividad antimicrobiana de los péptidos de defensa del huésped.[55][56][57][58] Esta característica requiere que la orientación en la hélice de lo catiónico-hidrofílico de un lado y del otro residuos hidrofóbicos. La adición de grupos fluorescentes en una cabeza de la molécula confiere propiedades de contraste. Una nueva estrategia para permitir la capacidad de admisión celular de CPPs está basada en la asociación de dominios policatiónicos y polianiónicos que están separados por un enlazador. La asociación celular de los residuos policatiónicos (poliarginina) con la membrana cargada de forma negativa es bloqueada efectivamente por la presencia de residuos polianiónicos (poli-ácido glutámico) y el enlaze, que confiere la distancia adecuada entre estos dos residuos cargados para maximizar su interacción. Estos péptidos adoptan la estructura tallo bucle, confirmada por la correlación del efecto Overhauser para proximidades protón-protón de los dos restos cargados. En esta etapa sólo el enlaze es expuesto a la hidrólisis de las proteasas en aplicaciones in vivo. La hidrólisis del enlace ocurre y los fragmentos con cargas experimentan una mayor libertado conformacioal.En la ausencia del enlace, el péptido catiónico puede interaccionar de manera eficiente con la célula objetivo y la admisión celular ocurre antes de la proteólisis. Esta estrategia tiene aplicaciones en el marcaje de celulas tumorales in vivo. Las células tumorales son marcadas en minutos. La degradación del enlace puede ser predicha por la cantidad de D-aminoácidos (isómero natural) incorporado en la cadena peptídica, esto restringe in vivo la proteólisis del enlace central.[59][60][61][62]
Agentes de contraste como moléculas de carga
[editar]Puntos cuánticos
[editar]Los puntos cuánticos (QD, pos sus siglas en inglés) representan una clase relativamente nueva de sondas fluorescentes que tienen propiedades de óptica superior que los clásicos tintes orgánicos basados en grupos fluorescentes. La principal ventaja de los QD incluyen altos rendimientos cuánticos, espectros de absorción amplio, tamaño-sintonizable de los espectros de emisión, y una buena resistencia a la degradación química y fotoquímica. Pruebas in vivo han demostrado que varios péptidos con carga positiva (basados en residuos de guanadina) son capaces de atravezar la membrana y promover la admisión celular de moléculas adheridas como los puntos cuánticos. Las propiedades de los últimos se pueden modificar de forma sencilla al cambiar el sustrato orgánico enlazado con ellos, ofreciendo una herramienta biológica con versatilidad como marcadores celulares. Investigación está en desarrollo para optimimizar las metodologías de la administración celular de los puntos cuánticos y sus bioconjugados y la caracterización de sus propiedades fotofísicas a largo plazo in vivo. [63] [64] [65] [66] [67] [68]
Los puntos cuánticos son nanocristales coloidales, basados en un núcleo de cadmio-selenio (CdSe) cubierto por una capa de zinc-azufre (ZnS). Este sustrato se ha usado de manera extensiva como marcadores celulares ya que el CdSe emite en el dominio visible y es un excelente agente de contraste, mientras que la capa de ZnS protege el núcleo de la oxidación y también extracción del CdSe hacia la solución circundante. Esta estrategia mejora la cesión de foto-luminiscencia. Las propiedades puede ser moduladas por el grosor de la capa protectora de ZnS. La emisión coloidal de QD se puede modular de la UV-Vis hacia la infraroja al usar diferentes agentes de cubierta como ZnS, CdS, ZnSe, CdTe y PbSe. Las propiedades de los puntos cuánticos puede también ser modulado por un esquema sintético, alta temperatura de las mezclas de solvente/ligando que influencia en las propiedades del nanocristal. Los agentes QD de alta calidad se obtienen a altas temperaturas; sin embargo, debido a su baja solubilidad en agua su uso como marcadores celulares está limitado, Además su funcionalidad con ligandos hidrofílicos es requerida.[69][70]
Las ventajas de los QD está representada por su rápida acción; son capaces de marcar un tejido objetivo o célula en segundos. En estudios in vivo se demostró que los QD son capaces de marcar de manera selectiva células de cáncer y acumularse en sitios tumorales. Las células tumorales marcadas pueden ser seguidas con un microscopio multifotón mientras invaden tejido de pulmón. En ambos estudios la imagen y substracción de auto-fluorescencia permite la visualización multicolor in vivo de las células y tejidos. Un mayor contratiempo de los QD es su relativamente alta toxicidad. La funcionalización con diferentes sustratos que incrementan la bioafinidad y disminuye la toxicidad están en progreso. Por ejemplo, el sulfuro de la capa del QD es capaz de formar enlaces disulfuro reversibles con una amplia clase de compuestos orgánicos.[71][72]
Imagen por resonancia magnética
[editar]La imagen por resonancia magnética (IRM) es una herramienta poderosa para el diagnóstico de enfermedades como la metástasis en cáncer e inflamación, usando diferentes metales quelatos. Los metales quelatos incrementan la señal de contraste entre los tejidos normales y los enfermos al cambiar los tiempos de relajación nuclear del agua y las moléculas próximas. Los ejemplos típicos de quelatos son las moléculas de poco peso moleculas Gd3+, óxido de hierro superparamagnético (SPIO, por sus siglas en inglés). En la administración in vivo de estos agentes permite el marcar células tumorales; o células pueden ser marcadas in vitro con agentes de contraste y después ser inyectadas y monitoreadas in vivo mediante el uso de las IRM.[73][74][75]
Las nanopartículas de SPIO confieren una alta sensibilidad a la IRM pero tienen baja afinidad por las células; trabajan a altas concentraciones. La funcionalización de estos compuestos usando guanadinas dedriméricas mostró actividades similares a las TAT basadas en CPPs pero con mayor toxicidad. Sustratos nuevos basados en dendrones con grupos periféticos hidroxil o amina presentan menor toxicidad. Las aplicaciones de SPIO incluyen el marcaje celular in vivo, debido a la baja toxicidad, están aprobados para su uso clínico en hígado, vaso e imagen gastrointestinal.[76]
La presencia de residuos octaméricos de argenina permite la transducción de la membrana celular con varias moléculas de carga incluyendo péptidos, DNA, siRNA y agentes de contraste. Sin embargo, la habilidad de cruzar la membrana no es unidireccional; los CPPs basados en argenina son capaces de entrar y salir de la membrana, provocando una concentración general decreciente del agente de contraste y una señal resonancia magnética (RM) decreciente en un tiempo. Esto limita sus aplicaciones in vivo. Para resolver este problema, agentes de contraste con disulfuro, enlaces reversibles entre metales quelato y fracciones de transducción permiten la retención asociada a la célula. Los puentes disulfuros son reducidos por el ambiente celular y los metales quelato se mantienen atrapados en el citoplasma, incrementando el tiempo de retención en la célula objetivo.[77][78][79][80]
Referencias
[editar]- ↑ Milletti F (2012) Cell-penetrating peptides: classes, origin, and current landscape. Drug Discov Today 17: 850–860.
- ↑ Stalmans, Sofie; Wynendaele, Evelien; Bracke, Nathalie; Gevaert, Bert; D'Hondt, Matthias; Peremans, Kathelijne; Burvenich, Christian; De Spiegeleer, Bart. Chemical-Functional Diversity in Cell-Penetrating Peptides.PLOS ONE Volume: 8 Issue: 8 Article Number: e71752
- ↑ Protein Transduction: Cell Penetrating Peptides and Their Therapeutic Applications; Wagstaff, Kylie M.; Jans, David A; Current Medicinal Chemistry, Volume 13, Number 12, May 2006 , pp. 1371-1387(17)
- ↑ Okuyama, M. and Laman, H. and Kingsbury, S.R. and Visintin, C. and Leo, E. and Eward, K.L. and Stoeber, K. and Boshoff, C. and Williams, G.H. and Selwood, D.L. (2007) Small-molecule mimics of an α-helix for efficient transport of proteins into cells. Nature Methods, 4 (2). pp. 153-159
- ↑ . Opalinska, J. B.; Gewirtz, A. M. Nucleic-acid therapeutics: basic principles and recent applications. Nat. Rev. Drug Discov. 2002, 1, 503-514
- ↑ Eckstein, F. The versatility of oligonucleotides as potential therapeutics. Expert. Opin. Biol. Ther. 2007, 7, 1021-1034.
- ↑ Stewart, K., M., Hortonb, K., L., O. Kelley S., O., Org. Biomol. Chem., 2008, 6, 2242–2255
- ↑ Luo, D.; Saltzman, W. M. Synthetic DNA delivery systems. Nat. Biotechnol. 2000, 18, 33-37.
- ↑ Vives, E., Brodin, P. and Lebleu, B. (1997) J. Biol. Chem. 272, 16010–16017
- ↑ Zelphati O. and Szoka F. C. Jr (1996) Intracellular distribution and mechanism of delivery of oligonucleotides mediated by cationic lipids. Pharm. Res. 13: 1367–1372
- ↑ Download H. D. Herce & A. E. Garcia (2007) PNAS, 104, 20805
- ↑ H. D. Herce & A. E. Garcia (2008) Journal of Biological Physics, 33, 345
- ↑ H. D. Herce et al (2009) Biophysical Journal, 97, 1917-1925 arXiv:0910.1736v1
- ↑ Frankel, A. D.; Pabo, C. O. Cellular uptake of the tat protein from human immunodeficiency virus. Cell 1988, 55, 1189-1193
- ↑ Lundberg M. and Johansson M. (2001) Is VP22 nuclear homing an artifact? Nat. Biotechnol. 19: 713–714
- ↑ Lundberg M., Wikstrom S. and Johansson M. (2003) Cell surface adherence and endocytosis of protein transduction domains. Mol. Ther. 8: 143–150
- ↑ J. Howl, I.D. Nicholl, Biochem. Soc. Trans (2007) 35, 767-769
- ↑ Plenat T., Deshayes S., Boichot S., Milhiet P. E., Cole R., Heitz F. et al. (2004) Interaction of primary amphipathic cellpenetrating peptides with phospholipid-supported monolayers. Langmuir 20: 9255–9261
- ↑ Deshayes S., Gerbal-Chaloin S., Morris M. C., Aldrian-Herrada G., Charnet P., Divita G. et al. (2004) On the mechanism of non-endosomial peptide-mediated cellular delivery of nucleic acids. Biochim. Biophys. Acta 1667: 141–147
- ↑ Deshayes S., Heitz A., Morris M. C., Charnet P., Divita G. and Heitz F. (2004) Biochemistry 43: 1449–1457
- ↑ Magzoub M., Kilk K., Eriksson L. E., Langel U. and Graslund A. (2001) Interaction and structure induction of cell-penetrating peptides in the presence of phospholipid vesicles. Biochim. Biophys. Acta 1512: 77–89
- ↑ Deshayes S., Plenat, T., Aldran-Herrada, G., Divita G., Le Grimellec C. and Heitz F. (2004) Primary amphipathic cell penetrating peptides: structural requirements and interactions with model membranes. Biochemistry 43: 7698–7706
- ↑ Derossi D., Calvet S., Trembleau A., Brunissen A., Chassaing G. and Prochiantz A. (1996) Cell internalization of the third helix of the Antennapedia homeodomain is receptor independent. J. Biol. Chem. 271: 18188–18193
- ↑ Tilstra, J., Rehman, K.K., Hennon, T., Plevy, S.E., Clemens, P. and Robbins, P.D. (2007) Biochem. Soc. Trans. 35, 811–815
- ↑ M.C. Morris, S. Deshayes, F. Simeoni, G. Aldrian-Herrada, F. Heitz, G. Divita, A noncovalent peptide-based strategy for peptide and short interfering RNA delivery, in: Ü. Langel (Ed.), Cell-penetrating peptides, 2007, pp. 387–408.
- ↑ S. El-Andaloussi, T. Holm, Ü. Langel, Cell-penetrating peptides: mechanism and applications, Curr. Pharma. Design 11 (2005) 3597–3611.
- ↑ J. Gariepy, K. Kawamura, Vectorial delivery of macromolecules into cells using peptide-based vehicles, Trends Biotechnol. 19 (2000) 21–28.
- ↑ John J. Turner, Andrey A. Arzumanov, Gabriela Ivanova, Martin Fabani, and Michael J. Gait; Peptide Conjugates of Oligonucleotide Analogs and siRNA for Gene Expression Modulation;in: Ü Langel. Handbook of Cell-Penetrating Peptides, Second Edition, 2007
- ↑ Stetsenko, D.A. and Gait, M.J., Efficient conjugation of peptides to oligonucleotides by ‘native ligation’, J. Org. Chem., 65, 4900, 2000.
- ↑ B.R. Meade, S.F. Dowdy, Exogenous siRNA delivery using peptide transduction domains/cell penetrating peptides, Adv. Drug Deliv. Rev. 59 (2007) 134–140.
- ↑ M.C. Morris, P. Vidal, L. Chaloin, F. Heitz, G. Divita, A new peptide vector for efficient delivery of oligonucleotides into mammalian cells, Nucleic Acids Res. 25 (1997) 2730–2736.
- ↑ a b F. Simeoni, M.C. Morris, F. Heitz, G. Divita, Insight into the mechanism of the peptide-based gene delivery system MPG: implications for delivery of siRNA into mammalian cells, Nucleic Acids Res. 31 (2003) 2717–2724.
- ↑ A. De Fougerolles, H.-P. Vornlocher, J. Maraganore, J. Lieberman, Interfering with disease: a progress report on siRNA-based therapeutics, Nat. Rev. Drug Disc. 6 (2007) 443–453
- ↑ Muratovska, A. and Eccles, M.R., Conjugate for efficient delivery of short interfering RNA (siRNA) into mammalian cells, FEBS Lett., 558, 63, 2004.
- ↑ Chiu, Y.-L. et al., Visualizing a correlation between siRNA, localization, cellular uptake and RNAi in living cells, Chem. Biol., 11, 1165, 2004.
- ↑ D. Zeineddine, E. Papadimou, K. Chebli, M. Gineste, J. Liu, C. Grey, S. Thurig, A. Behfar, V.A. Wallace, I.S. Skerjanc, M. Puceat, Oct-3/4 dose dependently regulates specification of embryonic stem cells toward a cardiac lineage and early heart development, Dev. Cell. 11 (2006) 535–546
- ↑ Crombez., L, Gudrun A.-H. , Konate, K.,, Nguyen, Q., N., McMaster, G., K. Brasseur, R., Heitz, F., Divita, G., Molecular Therapy, 2009(17), 95-107.
- ↑ Zatsepin, T.S. et al., Conjugates of oligonucleotides and analogues with cell penetrating peptides as gene silencing agents, Curr. Pharm. Des., 11, 3639, 2005.
- ↑ Pooga, M. et al., Cell penetrating PNA constructs regulate galanin receptor levels and modify pain transmission in vivo, Nat. Biotechnol., 16, 857, 1998.
- ↑ Tripathi, S., Chaubey, B., Barton, B.E. and Pandey, V.N. (2007) Virology 363, 91–103
- ↑ B.W. Neuman, D.A. Stein, A.D. Kroeker, M.R. Hong, K. Bestwick, P.L. Iversen, M.J. Buchmeier, Inhibition and escape of SARS-CoV treated with antisense morpholino oligomers, Adv. Exp. Med. Biol. 581 (2006) 567–571.
- ↑ Q. Ge, M. Pastey, D. Kobasa, P. Puthavathana, C. Lupfer, R.K. Bestwick, P.L. Iversen, J. Chen, D.A. Stein, Inhibition of multiple subtypes of influenza Avirus in cell cultures with morpholino oligomers, Antimicrob. Agents Chemother. 50 (2006) 3724–3733.
- ↑ B. Wu, H.M. Moulton, P.L. Iversen, J. Jiang, J. Li, J. Li, C.F. Spurney, A. Sali, A.D. Guerron, K. Nagaraju, T. Doran, P. Lu, X. Xiao, Q.L. Lu, Effective rescue of dystrophin improves cardiac function in dystrophin-deficient mice by a modified morpholino oligomer, Proc Natl Acad Sci U S A. 105 (2008) 14814-14819.
- ↑ Morishita, R., Gibbons, G.H., Horiuchi, M., Ellison, K.E., Nakama, M., Zhang, L., Kaneda, Y., Ogihara, T. and Dzau, V.J. (1995) Proc. Natl. Acad. Sci. U.S.A. 92, 5855–5859
- ↑ Fisher L, Soomets U, Cortes Toro V, Chilton L, Jiang Y, Langel Ü , Iverfeldt K: Cellular delivery of a double-stranded oligonucleotide NFkappaB decoy by hybridization to complementary PNA linked to a cell-penetrating peptide. Gene Ther 2004, 11:1264-1272.
- ↑ El-Andaloussi S, Johansson H, Magnusdottir A, Jä rver P, Lundberg P, Langel Ü : TP10, a delivery vector for decoy oligonucleotides targeting the Myc protein. J Control Release 2005, 110:189-201.
- ↑ Liu, Z., Li, M., Cui, D. and Fei, J. (2005) J. Controlled Release 102, 699–710
- ↑ C. Rudolph et al., Oligomers of the arginine-rich motif of the HIV-1 TAT protein are capable of transferring plasmid DNA into cells. J. Biol. Chem. 278 (2003), pp. 11411–11418
- ↑ Wadia JS, Stan RV, Dowdy SF: Transducible TAT-HA fusogenic peptide enhances escape of TAT-fusion proteins after lipid raft macropinocytosis. Nat Med 2004, 10:310-315.
- ↑ S. Kameyama, M. Horie, T. Kikuchi, T. Omura, T. Takeuchi, I. Nakase, Y. Sugiura and S. Futaki, Bioconjugate Chem., 2006, 17, 597–602.
- ↑ M. C. Morris, J. Depollier, J. Mery, F. Heitz and G. Divita, Nat. Biotechnol., 2001, 19, 1173–1176.
- ↑ Cheng, R. P., S. H. Gellman, and W. F. DeGrado. 2001. Peptides: from structure to function. Chem. Rev. 101:3219–3232.
- ↑ Seebach, D., S. Abele, J. V. Schreiber, B. Martinoni, A. K. Nussbaum, H. Schild, H. Schulz, H. Hennecke, R. Woessner, and F. Bitsch. 1998. Biological and pharmacokinetic studies with β-peptides. Chimica 1998(52)734–739.
- ↑ Akkarawongsa, R., Terra B. Potocky, T., B., English, E., B., Gellman, S., H., and Brandt, C., R., ANTIMICROBIAL AGENTS AND CHEMOTHERAPY, 2008, 2120–2129.
- ↑ Liu, D., and W. F. DeGrado. J. Am. Chem. Soc. 2001(123),7553–7559.
- ↑ Porter, E. A., X. Wang, H. S. Lee, B. Weisblum, and S. H. Gellman, Nature, 2000, 404-565.
- ↑ Porter, E. A., B. Weisblum, and S. H. Gellman. J. Am. Chem. Soc. 2002(124), 7324–7330.
- ↑ Raguse, T. L., E. A. Porter, B. Weisblum, and S. H. Gellman. J. Am. Chem. Soc. 2002(124),. 12774–12785.
- ↑ Wright, L. R., Rothbard, J. B. & Wender, P. A. (2003) Curr. Protein Pept. Sci.2003(4), 105–124.
- ↑ Gammon, S. T., Villalobos, V. M., Prior, J. L., Sharma, V. & Piwnica-Worms, D. (2003) Bioconjugate Chem.2003(14), 368–376.
- ↑ Polyakov, V., Sharma, V., Dahlheimer, J. L., Pica, C. M., Luker, G. D. & Piwnica-Worms, D. Bioconjugate Chem. 2000(11), 762–771.
- ↑ Jiang, T., S. Olson, E., S., Nguyen, Q., T., Roy, M., Jennings, P., A., , Tsien, R., Y., Proc. Natl. Acad. Sci. U.S.A., 2004(101) 17867-17872.
- ↑ Delehanty, J., B., Medintz, I., L., Pons, T., Brunel, F., M., Dawson P., E., Mattoussi, H., Bioconjugate Chem. 2006, 17, 920-927.
- ↑ Alivisatos, A. P., Gu, W., and Larabell, C. A., Ann. Rev. Biomed. Eng. 2005(7), 55-76.
- ↑ Alivisatos, P., Nat. Biotechnol. 2004(22,) 47-52.
- ↑ Medintz, I. L., Uyeda, Nat. Mater. 4, 435-446.
- ↑ Parak, W. J., Gerion, D., Pellegrino, T., Zanchet, D., Micheel, C., Williams, S. C., Boudreau, R., Le Gros, M. A., Larabell, C. A., and Alivisatos, A. P., Nanotechnology (2003)14, R15-R27.
- ↑ Parak, W., Pellegrino, T., and Plank, C., Nanotechnology 2005(16), R9-R25.
- ↑ Dabbousi, B. O. et al. J. Phys. Chem. B 1997(101), 9463–9475.
- ↑ Medintz, I., L., Uyeda, H., T., Goldman, E., R., Mattoussi, H., Nature Materials, 2005,(4) 435-446.
- ↑ Gao, X., Cui, Y., Levenson, R., M., Chung, L., W., K., Nie, S., Nature Biotechnol. 2004(22), 969–976.
- ↑ Voura, E. B., Jaiswal, J. K., Mattoussi, H. & Simon, S. M. Nature Med. 2004(10), 993–998.
- ↑ Lewis, B. K., Zywicke, H., Miller, B., van Gelderen, P., Moskowitz, B. M., Duncan, I. D., and Frank, J. A., Nat. Biotechnol. 2001(19), 1141–1147.
- ↑ Pittet, M. J., Swirski, P. K., Reynolds, F., Josephson, L., and Weissleder, R., Nat. Protoc. 2006(1), 73–78.
- ↑ Foster, P. J., Dunn, E. A., Karl, K. E., Snir, J. A., Nycz, C. M., Harvey, A. J., and Pettis, R. J., Neoplasia 2008(10), 207–216.
- ↑ Martin, A., L., Bernas, L., M., Rutt, B., K., Foster, P., J., Gillies, E., R., Bioconjugate Chem. 2008(19), 2375–2384.
- ↑ Allen, M. J., MacRenaris, K. W., Venkatasubramanian, P. N., and Meade, T. J. (2004) Chem. Biol. 2004(11), 301–307.
- ↑ Futaki, S., Adv. Drug Delivery Rev. 2005(57) 547–558.
- ↑ Futaki, S., Suzuki, T., Ohashi, W., Yagami, T., Tanaka, S., Ueda, K., and Sugiura, Y. (2001) J. Biol. Chem. 2001(276), 5836–5840.
- ↑ Endres, P., J., MacRenaris,K., W., Stefan Vogt, S., Meade, T., J., Bioconjugate Chem. 2008(19), 2049–2059.
Enlaces externos
[editar]- Instant insight hacia los péptidos de penetración celular de la Royal Society of Chemistry (inglés)
- www.cell-penetrating-peptides.com Página web dinámica creada por científicos que condensa y organiza los avances más novedosos en administración de fármacos y CPPs (inglés)
- CPPsite: Una página web para mantener CPPs. Database (2012) 2012 (inglés)
- CellPPD: Aproximación para el diseño de CPPs altamente efectivos Journal of Translational Medicine 2013, 11:74. (inglés)
- CPPpred: CPPpred: predicción de CPPs Bioinformatics (2013) 29 (23): 3094-3096.. (inglés)
[[Category:Péptidos]]
[[Category:biología celular]]
