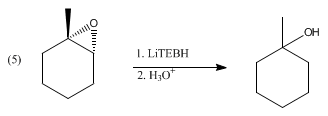Trietilborohidruro
| Trietilborohidruro | ||
|---|---|---|
 | ||
| General | ||
| Fórmula molecular | LiEt3BH | |
| Identificadores | ||
| Número CAS | 22560-16-3[1] | |
| ChemSpider | 2006168 | |
| PubChem | 23664628 | |
| UNII | Q1ML638JFD | |
| Propiedades físicas | ||
| Masa molar | 106,151 g/mol | |
El trietilborohidruro de litio es un compuesto organoborónico de fórmula LiEt3BH. Comúnmente conocido como LiTEBH o Superhidruro, es un potente agente reductor utilizado en química organometálica y orgánica. Es un líquido incoloro o blanco, pero normalmente se comercializa y utiliza como solución de THF.[2] El agente reductor relacionado trietilborohidruro de sodio está disponible comercialmente como soluciones de tolueno.
El LiBHEt3 es un agente reductor más fuerte que el borohidruro de litio y el hidruro de aluminio y litio.
Preparación
[editar]El LiBHEt3 se prepara mediante la reacción de hidruro de litio (LiH) y trietilborano (Et3B) en tetrahidrofurano (THF):
LiH + Et3B → LiEt3BH
Sus soluciones en THF son estables indefinidamente en ausencia de humedad y aire.
Reacciones
[editar]Los haluros de alquilo se reducen a alcanos mediante LiBHEt3.[3][4][2]
El LiBHEt3 reduce una amplia gama de grupos funcionales, pero también lo hacen muchos otros reactivos de hidruro. En cambio, el LiBHEt3 se reserva para sustratos difíciles, como los carbonilos con impedimentos estéricos, como ilustra la reducción de la 2,2,4,4-tetrametil-3-pentanona. Por lo demás, reduce los anhídridos ácidos a alcoholes y al ácido carboxílico, no al diol. Del mismo modo, las lactonas se reducen a dioles. Las α,β-enonas sufren una adición 1,4 para dar enolatos de litio. Los disulfuros se reducen a tioles (vía tiolatos). El LiBHEt3 desprotoniza ácidos carboxílicos, pero no reduce los carboxilatos de litio resultantes. Por razones similares, los epóxidos se abren en anillo al tratarlos con LiBHEt3 para dar el alcohol. Con epóxidos asimétricos, la reacción puede proceder con alta selectividad regio- y estereo-, favoreciendo el ataque en la posición menos impedida:
Los acetales y cetales no se reducen con LiBHEt3. Se puede utilizar en la escisión reductora de mesilatos y tosilatos.[5] LiBHEt3 puede desproteger selectivamente grupos N-acil terciarios sin afectar a la funcionalidad amida secundaria.[6] También se ha demostrado que reduce ésteres aromáticos a los alcoholes correspondientes como se muestra en las ecuaciones 6 y 7.
El LiBHEt3 también reduce piridina e isoquinolinas a piperidinas y tetrahidroisoquinolinas respectivamente.[7]
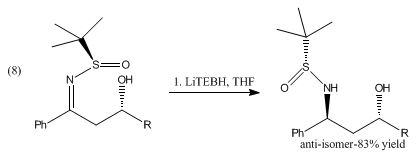
La reducción de β-hidroxisulfinil iminas con catecolborano y LiBHEt3 produce anti-1,3-amino alcoholes mostrados en (8).[8]
Precauciones
[editar]El LiBHEt3 reacciona exotérmicamente, de forma potencialmente violenta, con agua, alcoholes y ácidos, liberando hidrógeno y el pirofórico trietilborano.[2]
Referencias
[editar]- ↑ Número CAS
- ↑ a b c Zaidlewicz, M.; Brown, H.C. (2001). «Lithium Triethylborohydride». Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. ISBN 0471936235. doi:10.1002/047084289X.rl148. Consultado el 18 de febrero de 2022.
- ↑ Marek Zaidlewicz; Herbert C. Brown (2001). «Lithium Triethylborohydride». Encyclopedia of Reagents for Organic Synthesis. ISBN 0471936235. doi:10.1002/047084289X.rl148.
- ↑ Brown, H. C.; Kim, S. C.; Krishnamurthy, S. (1 de febrero de 1980). «Selective reductions. 27. Reaction of alkyl halides with representative complex metal hydrides and metal hydrides. Comparison of various hydride reducing agents». J. Org. Chem. 45 (5): 849-856. doi:10.1021/jo01293a018. Consultado el 18 de febrero de 2022.
- ↑ Baer, H.H.; Mekarska-Falicki, M. (November 1985). «Stereochemical dependence of the mechanism of deoxygenation, with lithium triethylborohydride, in 4,6-O-benzylidenehexopyranoside p-toluenesulfonates». Canadian Journal of Chemistry 63 (11): 3043. doi:10.1139/v85-505. Consultado el 18 de febrero de 2022.
- ↑ Tanaka, H.; Ogasawara, K. (17 de junio de 2002). «Utilization oh lithium triethylborohydride as a selective N-acyl deprotecting agent». Tetrahedron Lett. 43 (25): 4417. doi:10.1016/S0040-4039(02)00844-4. Consultado el 18 de febrero de 2022.
- ↑ Blough, B.E.; Carroll, F.I. (5 de noviembre de 1993). «Reduction of isoquinoline and pyridine-containing heterocycles with lithium triethylborohydride (Super-Hydride®)». Tetrahedron Lett. 34 (45): 7239. doi:10.1016/S0040-4039(00)79297-5. Consultado el 18 de febrero de 2022.
- ↑ Kochi, T.; Tang, T.P.; Ellman, J.A. (14 de mayo de 2002). «Asymmetric Synthesis of syn- and anti-1,3-Amino Alcohols». J. Am. Chem. Soc. 124 (23): 6518-6519. PMID 12047156. doi:10.1021/ja026292g. Consultado el 18 de febrero de 2022.
Enlaces externos
[editar]- Esta obra contiene una traducción derivada de «Lithium triethylborohydride» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.