Tiocianato
| Tiocianato | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Tiocianato | ||
| General | ||
| Otros nombres | sulfocianato, sulfocianuro, rodanuro | |
| Fórmula molecular | [SCN]- | |
| Propiedades físicas | ||
| Masa molar | 58,0824 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El tíocianato (también conocido como sulfocianato, sulfocianuro o rodanuro) es el anión [SCN]− y la base conjugada del ácido tiociánico. Algunos compuestos comunes incluyen las sales incoloras tiocianato de potasio y tiocianato de sodio. Los compuestos orgánicos que contienen el grupo funcional -SCN son denominados también tiocianatos. El tiocianato de mercurio (II) fue usado anteriormente en pirotecnia.
El anión tiocianato es análogo al anión cianato, [OCN]−, donde un átomo de oxígeno es reemplazado por azufre. El (SCN)− es uno de los pseudohalogenuros, debido a la similitud de sus reacciones con la de los iones halogenuro. El tiocianato fue previamente conocido como rodanuro (de la palabra del griego que significa rosa), por el color rojo de sus complejos con hierro. El tiocianato es producido por la reacción del azufre elemental o tiosulfato con cianuro:
- 8 CN− + S8 → 8 SCN−
- CN− + S2O32− → SCN− + SO32−
La última reacción es catalizada por la enzima sulfotransferasa conocida como rodanasa, y puede ser relevante para desintoxicar el cuerpo de cianuro.
Estructura, enlace y química de coordinación
[editar]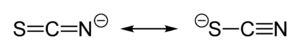
El tiocianato comparte su carga negativa aproximadamente por igual entre el azufre y el nitrógeno. Consecuentemente, el tiocianato puede actuar como nucleófilo tanto en el azufre o el nitrógeno;— es un ligando ambidentado. El [SCN]− también puede hacer puente entre dos, o incluso tres metales (M−SCN−M; >SCN− o −SCN<). La evidencia experimental lleva a la conclusión general que los ácidos duros tienden a formar complejos de tiocianato por el nitrógeno, mientras que los ácidos blandos tienden a formar complejos de tiocianato por el azufre. Otros factores, por ejemplo (PS), la cinética y la solubilidad, también están involucrados, y puede presentarse isomería de enlace, por ejemplo [Co(NH3)5(NCS)]Cl2 y [Co(NH3)5(SCN)]Cl2.[1]
Tiocianatos orgánicos
[editar]Las derivados orgánicos y de metales de transición del anión tiocianato pueden existir como "isómeros de enlace". En los tiocianatos, el grupo orgánico o metal está unido al azufre: R−S−C≡N tiene un enlace simple S-C, y un enlace triple C-N.[2] En los isotiocianatos, el sustituyente está unido al nitrógeno: R−N=C=S tiene un enlace doble S-C y un enlace doble C-N.
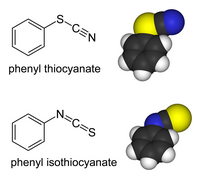
Los tiocianatos orgánicos son hidrolizados a tiocarbamatos en la síntesis de tiocarbamatos de Riemschneider.
Ensayo para el hierro(III)
[editar]Si se agrega [SCN]− a una solución que contiene cationes hierro(III), se forma una solución rojo sangre debido a la formación de [Fe(NCS)(H2O)5]2+.


