Tetracianoniquelato de potasio
| Tetracianoniquelato de potasio | ||
|---|---|---|
| General | ||
| Fórmula estructural | K2[Ni(CN)4] | |
| Fórmula molecular |
C 4K 2N 4Ni 1 | |
| Identificadores | ||
| Número CAS | 14220-17-8[1] | |
| ChEBI | 30071 | |
| ChemSpider | 55617 | |
| PubChem | 61717 | |
| UNII | BCX7A142U2 | |
| Propiedades físicas | ||
| Apariencia | Polvo amarillo pálido | |
| Densidad | 1860 kg/m³; 1,86 g/cm³ | |
| Masa molar | 240,95 g/mol | |
| Estructura cristalina | Monocíclico | |
| Propiedades químicas | ||
| Solubilidad en agua | Muy soluble | |
| Riesgos | ||
| Ingestión | Toxicidad aguda | |
| Inhalación | Toxicidad aguda | |
| Piel | Toxicidad aguda | |
| Más información | Al contacto con ácidos libera gases muy tóxicos. Peligroso para el medio ambiente acuático | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||

El níquel (Ni) es un metal de transición el cual se encuentra en meteoritos aliado con hierro, es de color blanco con un ligero tono amarillo. Su estado de oxidación más frecuente es el +2, sin embargo se han observado experimentalmente los estados de oxidación 0, +1 y +3. Este es un metal de transición el cual se puede coordinar para formar moléculas más estables con geometrías octaédricas y plano cuadradas, las cuales son las más frecuentes, aunque también son usuales geometrías tetraédrica, bipirámide trigonal y pirámide de base cuadrada.[2]
La formación del ion [Ni(CN)4]-2 se explica a través de la teoría de orbitales moleculares (TOM). Debido a que el níquel presenta un estado de oxidación +2, lo que ocasiona que, con base en su configuración electrónica, se comporte como un metal de transición d8 por sus electrones de valencia disponibles, dejando libre los orbitales 4s y 4p para una futura hibridación con los ligandos. Al hibridarse con los iones CN-, cada uno de los cuatro ligandos aporta 2 electrones de valencia, lo que genera una hibridación dsp2 y llenando los orbitales generados para así formar el ion [Ni(CN)4]-2 con la geometría plano-cuadrada y con propiedad diamagnética por la conformación de los electrones de valencia, que necesiten menor energía para ubicarse de una mejor manera en los orbitales. Al ser diamagnético, este ion no se ve afectado por campos magnéticos externos dado que los repele.[3]

El tetracianoniquelato de potasio es un compuesto monocicliquico con un color amarillo anaranjado.[4]
Obtención de cristales de Tetracianoniquelato de potasio[editar]
NiSO4·H2O + 2KCN → Ni(CN)2 + K2SO4 + 6H2O
Ni(CN)2 + 2KCN + H2O → K2Ni(CN)4·H2O
El tetracianoniquelato de potasio se prepara añadiendo un exceso de cianuro de potasio a una solución que contenga una sal de níquel soluble en agua para llevar la solución a la cristalización. Sin embargo, la precipitación preliminar de cianuro de níquel seguido de una solución en cianuro de potasio permite la eliminación de otras sales de potasio solubles antes de la cristalización.
Procedimiento[editar]
Obtención de Cianuro de Níquel: 60 g de sulfato de níquel (NiSO4·6H2O), se disuelve en 200 mL de agua formando una solución a la cual se le añade lentamente con agitación 29,7 g de cianuro de potasio (disuelto en 70 mL de agua), donde se forma un precipitado verde grisáceo de cianuro de níquel, los cuales de lavan en una solución libre de sulfatos y se recogen en un embudo de Buchner.
Obtención de Tetracianoniquelato de potasio: 29.2 g de cianuro de potasio se disuelven en 30 mL de agua. A esta solución se añade el cianuro de níquel sólido, el cual se disuelve formando una solución. Esta solución se calienta sobre una placa caliente hasta que comienzan a formarse pequeños cristales, Los cuales se vuelven a disolver. Finalmente la solución se deja enfriar hasta la formación de los cristales.[5]
Propiedades[editar]
El tetracianoniquelato de potasio forma cristales monoclínicos que contienen una molécula de agua (hidratación). Esta agua se pierde cuando el compuesto es secado a 100 °C. La sal es extremadamente soluble, incluso en agua fría. Se descompone por la acción de los ácidos minerales con precipitación de cianuro de níquel. El tetracianoniquelato de potasio se descompone fácilmente mediante la adición de hipobromito de sodio, donde el peróxido de níquel hidratado es arrojado como precipitado negro.[5]

Papel biológico[editar]
El tetracianoniquelato es utilizado como sonda para el sitio activo de rodanasa libre de sulfato (enzima) donde el ion [Ni(CN)4]2- extingue la fluorescencia intrínseca así como la fluorescencia del ácido 2-anilinonaftaleno-8-sulfónico unido a enzima (2,8-ANS), un inhibidor que es competitivo con respecto al tiosulfato.[6]
Algunas Bacterias como Pseudomonas y Klebsiella crecen en medios con tetracianoniquelato de potasio como su única fuente de nitrógeno degradandolo donde finalmente obtienen Ni(CN)2 cumpliendo un papel como un metabolito biológico.[7]
Tetracianoniquelato de potasio es degradado por Cryptococcus humicolus MCN2 donde es utilizado como fuente de nitrógeno, cuando se le suministra una cantidad de glucosa suficiente como su fuente de carbono.[8]
Identificación[editar]
Para comprobar que el compuesto obtenido es un tetracianoniquelato de potasio se realiza una espectroscopia de infrarrojo en el cual se observara la señal de cianuro.[9]
Para identificar si en el compuesto se presenta Ni+2 se añadirá dimetilglioxima (0.1M, 1mL aprox.) la cual con el Ni+2 formará un complejo, produciendo un cambio de color a rosado-rojizo.[10]
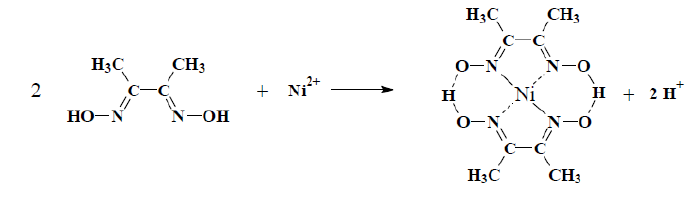
Referencias[editar]
- ↑ Número CAS
- ↑ Cortijo Montes, Miguel (2014). Compuestos de coordinación de níquel con diferente dimensionalidad como materiales híbridos multifuncionales (1). Consultado el 2 de julio de 2017.
- ↑ Maki, G. (1958). Ligand Field Theory of Ni(II) Complexes. I. Electronic Energies and Singlet Ground‐State Conditions of Ni(II) Complexes of Different Symmetries (2). pp. 1129-1138.
- ↑ Vannerberg, Nils Gosta (1964). "La estructura cristalina de K2Ni (CN) 4" (2). pp. 18 (10): 2385-2391. Consultado el 2 de julio de 2017.
- ↑ a b Fernelius, Fernelius, W. C. and Burbage, J. J. (1946). Inorganic Syntheses Vol. II. N. Y.: McGraw-Hill book Company. p. 227.
- ↑ Chow SF, Horowitz PM. (1985). Tetracianoniquelato sonda el sitio activo de rodanasa libre de azufre. (4). pp. 15;260(29):15516-21. PMID 3864780.
- ↑ Silva-Avalos J, Richmond MG, Nagappan O, Kunz DA. (1990). Degradation of the metal-cyano complex tetracyanonickelate(II) by cyanide-utilizing bacterial isolates. (6). PMID 2082819.
- ↑ Kwon HK, Woo SH, Park JM. (2002). Degradation of tetracyanonickelate (II) by Cryptococcus humicolus MCN2 (5). PMID 12351233.
- ↑ Sigeo KIDA, Junnosuke FUJITA, Kazuo NAKAMOTO and Ryutaro TSUCHIDA (1958). Ultraviolet Absorption Spectra and the Electronic Structure of Metallic Complexes. II. Cyanide Complexes*. Consultado el 2 de julio de 2017.
- ↑ Brown, G. H., & Sallee, E. M. Química cuantitativa.. Reverté. p. 559.
 Wikimedia Commons alberga una categoría multimedia sobre Tetracianoniquelato de potasio.
Wikimedia Commons alberga una categoría multimedia sobre Tetracianoniquelato de potasio.
