Tapón de apareamiento
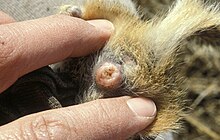
Los tapones de apareamiento, también llamados tapones de nudos, tapones de esperma, tapones de eyaculación o sphragis (del latín, griego σφραγίς sphragis, "sello"), son estructuras gelatinosas utilizadas por otras especies para el apareamiento. Los machos lo insertan en el tracto reproductivo de la hembra, luego se seca y se convierte en un tapón.[1] Si bien las hembras pueden expulsar los tapones después, el esperma del macho todavía tiene una ventaja de tiempo para llegar al óvulo, que suele ser el factor decisivo en la fertilización.
El tapón de apareamiento juega un papel importante en la competencia de los espermatozoides y puede servir como una estrategia alternativa y más ventajosa a la protección activa de la pareja. En algunas especies, esta estrategia pasiva de protección de la pareja puede reducir la selección en machos de gran tamaño.[2] Esta estrategia puede ser ventajosa porque permitiría al macho aumentar el éxito reproductivo al pasar más tiempo persiguiendo nuevas parejas femeninas en lugar de vigilando activamente a la pareja.[2]
Composición[editar]

El tapón de apareamiento del Bombus terrestris fue analizado químicamente y se encontró que estaba compuesto de ácido palmítico, ácido linoleico, ácido oleico, ácido esteárico y cicloprolilprolina.[3] Se encontró que los ácidos (sin cicloprolilprolina) eran suficientes por sí solos para crear el tapón. Los investigadores plantean la hipótesis de que la cicloprolilprolina reduce la receptividad de las hembras a una mayor reproducción.
Ocurrencia en la naturaleza[editar]
Los tapones de apareamiento son utilizados por muchas especies, incluidos varios primates,[4][2][5] canguros,[6][7][8] abejas,[9] reptiles,[10] ratas, roedores,[11] escorpiones,[12] ratones,[13] y arañas.[14]
El uso de un tapón de apareamiento como estrategia para el éxito reproductivo también se puede observar en algunos taxones de lepidópteros y otros insectos y a menudo se asocia con el apareamiento de pupas.[15] Por ejemplo, para proteger su paternidad, las mariposas macho de punto de ajedrez variable pasan un tapón de apareamiento en la abertura genital de las hembras para evitar que se vuelvan a aparear.[16]
La mariposa Heliconius charithonia utiliza un tapón de apareamiento en forma de espermatóforo que proporciona sustancias químicas de defensa depredadoras y fuentes de proteínas para el desarrollo de óvulos.[17] También actúa como anafrodisíaco que impide que otros machos se apareen con la hembra.[18] De manera similar, en las mariposas Parnassius smintheus, el macho deposita un tapón genital ceroso en la punta del abdomen de la hembra para evitar que la hembra se aparee nuevamente.[19] Contiene esperma y nutrientes importantes para la hembra[20] y garantiza que el macho sea el único que fertilice los óvulos de la hembra.[19]
La mayoría de las especies de abejas sin aguijón, como Plebeia remota, solo se aparean una vez y, por lo tanto, utilizan tapones de apareamiento para almacenar todo el esperma que recolectan para uso futuro.[9]
Otra especie de insecto que utiliza un tapón copulador es Drosophila mettleri, una especie de mosca del desierto de Sonora de la familia Diptera. Estos tapones sirven como medio de control entre macho y hembra durante las interacciones de apareamiento.[21]
Un ejemplo peculiar de obstrucción de pareja ocurre en las arañas marianas Leucauge. Se requiere la participación tanto masculina como femenina para crear un tapón de pareja. El macho por sí solo no puede crear un enchufe funcional. La participación femenina en la creación de tapones de apareamiento y su presunto beneficio de ellos han dado lugar a múltiples estudios de selección sexual sobre el comportamiento sexual de L. mariana.[22]
En Thamnophis sirtalis parietalis, comúnmente conocidas como culebras de lados rojos, los machos depositan un tapón copulador gelatinoso para sellar la abertura cloacal de la serpiente hembra para evitar el nuevo apareamiento, la fuga del esperma depositado y altera las señales feromonas femeninas que atraen a las parejas.[23]
Referencias[editar]
- ↑ David Quammen (16 de octubre de 2012). The Flight of the Iguana: A Sidelong View of Science and Nature. Simon and Schuster. ISBN 978-1-4767-2873-5.
- ↑ a b c Dunham, A. E.; Rudolf, V. H. W. (July 2009). «Evolution of sexual size monomorphism: the influence of passive mate guarding». Journal of Evolutionary Biology 22 (7): 1376-1386. PMID 19486235. doi:10.1111/j.1420-9101.2009.01768.x.
- ↑ Baer, Boris; Maile, Roland; Schmid-Hempel, Paul; Morgan, E. David; Jones, Graeme R. (2000). «Chemistry of a Mating Plug in Bumblebees». Journal of Chemical Ecology 26 (8): 1869-1875. doi:10.1023/A:1005596707591.
- ↑ Alan F. Dixson (26 de enero de 2012). Primate Sexuality: Comparative Studies of the Prosimians, Monkeys, Apes, and Humans. OUP Oxford. ISBN 978-0-19-954464-6.
- ↑ Sauther, Michelle L. (April 1991). «Reproductive behavior of free‐ranging Lemur catta at Beza Mahafaly Special Reserve, Madagascar». American Journal of Physical Anthropology 84 (4): 463-477. doi:10.1002/ajpa.1330840409.
- ↑ Larry Vogelnest; Rupert Woods (18 de agosto de 2008). Medicine of Australian Mammals. Csiro Publishing. ISBN 978-0-643-09928-9.
- ↑ Hugh Tyndale-Biscoe; Marilyn Renfree (30 de enero de 1987). Reproductive Physiology of Marsupials. Cambridge University Press. ISBN 978-0-521-33792-2.
- ↑ Terence Dawson (16 de abril de 2012). Kangaroos. Csiro Publishing. ISBN 978-0-643-10627-7. Consultado el 13 de julio de 2013.
- ↑ a b Strassmann, J. (March 2001). «The rarity of multiple mating by females in the social Hymenoptera». Insectes Sociaux 48 (1): 1-13. doi:10.1007/PL00001737.
- ↑ King, Richard B.; Jadin, Robert C.; Grue, Michael; Walley, Harlan D. (25 de agosto de 2009). «Behavioural correlates with hemipenis morphology in New World natricine snakes». Biological Journal of the Linnean Society 98 (1): 110-120. doi:10.1111/j.1095-8312.2009.01270.x.
- ↑ Voss, Robert (7 de junio de 1979). «Male accessory glands and the evolution of copulatory plugs in rodents». Occasional Papers (The Museum of Zoology University of Michigan).
- ↑ Contreras-Garduno, Jorge; Peretti, Alfredo V.; Cordoba-Aguilar, Alex (February 2006). «Evidence that Mating Plug is Related to Null Female Mating Activity in the Scorpion Vaejovis punctatus». Ethology 112 (2): 152-163. doi:10.1111/j.1439-0310.2006.01149.x.
- ↑ Ittner, Lars M; Götz, Jürgen (10 de mayo de 2007). «Pronuclear injection for the production of transgenic mice». Nature Protocols 2 (5): 1206-1215. PMID 17546016. doi:10.1038/nprot.2007.145.
- ↑ Knoflach, Barbara; van Harten, Antonius (August 2001). «Tidarren argo sp. nov. (Araneae: Theridiidae) and its exceptional copulatory behaviour: emasculation, male palpal organ as a mating plug and sexual cannibalism». Journal of Zoology 254 (4): 449-459. doi:10.1017/S0952836901000954.
- ↑ The encyclopedia of land invertebrate behaviour By Rod Preston-Mafham, Ken Preston-Mafham. Pg 113.
- ↑ Dickinson, Janis L.; Rutowski, Ronald L. (July 1989). «The function of the mating plug in the chalcedon checkerspot butterfly». Animal Behaviour 38 (1): 154-162. doi:10.1016/s0003-3472(89)80074-0.
- ↑ Cardoso, Márcio Zikán; Gilbert, Lawrence E. (7 de septiembre de 2006). «A male gift to its partner? Cyanogenic glycosides in the spermatophore of longwing butterflies (Heliconius)». Naturwissenschaften 94 (1): 39-42. PMID 16957921. doi:10.1007/s00114-006-0154-6.
- ↑ Estrada, Catalina; Schulz, Stefan; Yildizhan, Selma; Gilbert, Lawrence E. (October 2011). «Sexual Selection Drives The Evolution Of Antiaphrodisiac Pheromones in Butterflies». Evolution 65 (10): 2843-2854. PMID 21967426. doi:10.1111/j.1558-5646.2011.01352.x.
- ↑ a b Shepard, Jon; Guppy, Crispin (2011). Butterflies of British Columbia: Including Western Alberta, Southern Yukon, the Alaska Panhandle, Washington, Northern Oregon, Northern Idaho, and Northwestern Montana (en inglés). UBC Press. ISBN 978-0-7748-4437-6. Consultado el 13 de noviembre de 2017.
- ↑ «parnassius smintheus». imnh.isu.edu. Consultado el 13 de noviembre de 2017.
- ↑ Alonso-Pimentel H, Tolbert LP, Heed WB (March 1994). «Ultrastructural examination of the insemination reaction in Drosophila». Cell and Tissue Research 275 (3): 467-79. PMID 8137397. doi:10.1007/BF00318816.
- ↑ Hernández, Linda; Aisenberg, Anita; Molina, Jorge (2018). «Mating plugs and sexual cannibalism in the Colombian orb-web spider Leucauge mariana». En Hebets, E., ed. Ethology (en inglés) 124 (1): 1-13. doi:10.1111/eth.12697.
- ↑ Crews, David, and William R. Garstka (1982). «The Ecological Physiology of a Garter Snake». Scientific American (JSTOR) 247 (5): 158-71.
