Síntesis de olefinas de Corey-Winter
La síntesis de olefinas de Corey-Winter es un método de síntesis que consiste en una serie de reacciones químicas para convertir 1,2-dioles en olefinas. Lleva el nombre del químico y Nobel estadounidense Elias James Corey y del químico estadounidense-estonio Roland Arthur Edwin Winter.[1][2][3]
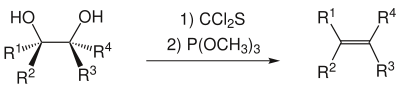
A menudo, se usa tiocarbonildiimidazol en lugar de tiofosgeno como se muestra arriba, ya que el tiofosgeno tiene un perfil de toxicidad similar al fosgeno, mientras que el tiocarbonildiimidazol es una alternativa mucho más segura.
Mecanismo[editar]
El mecanismo de reacción implica la formación de un tiocarbonato cíclico a partir del diol y tiofosgeno. El segundo paso implica el tratamiento con trimetilfosfito, que ataca el átomo de azufre, produciendo S = P(OMe)3 (impulsado por la formación de un fuerte doble enlace P = S) y dejando un carbeno. Este carbeno se extruye con la pérdida de dióxido de carbono para dar la olefina.[4]
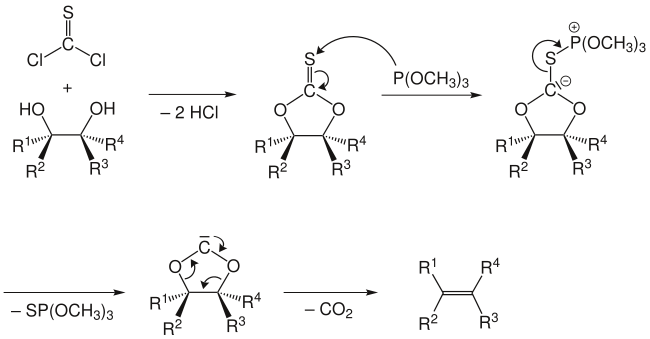
Un mecanismo alternativo no implica un intermedio de carbeno libre, sino que implica el ataque del carbanión por una segunda molécula de trimetilfosfito con la división concomitante del enlace azufre-carbono. El carbanión estabilizado con fósforo se somete a una eliminación para dar el alqueno, junto con un acil fosfito, que luego se descarboxila.

La olefinación de Corey-Winter es una reacción estereoespecífica: un transdiol proporciona un transalqueno, mientras que un cisdiol proporciona un cisalqueno como producto.
Referencias[editar]
- ↑ Corey, E. J.; Winter, R. A. E. J. Am. Chem. Soc. 1963, 85, 2677. (doi 10.1021/ja00900a043)
- ↑ Corey, E. J.; Hopkiss, P. B. Tetrahedron Lett. 1982, 23, 1979. (doi 10.1016/S0040-4039(00)87238-X)
- ↑ Block, E. Org. React. 1984, 30, 457. doi 10.1002/0471264180.or030.02
- ↑ Horton, D.; Tindall, Jr., C. G. J. Org. Chem. 1970, 35(10), 3558-3559. (doi 10.1021/jo00835a082)
