Ley de Charles
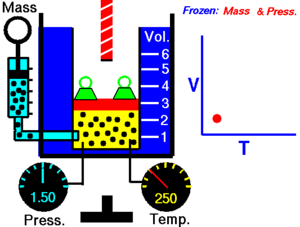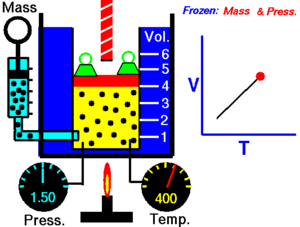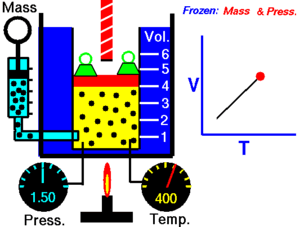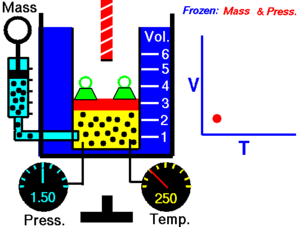

La ley de Charles (también conocida como la ley de los volúmenes) es una ley experimental de los gases que describe cómo los gases tienden a expandirse cuando se calientan. Un enunciado moderno de la ley de Charles es:
Cuando la presión sobre una muestra de gas seco se mantiene constante, la temperatura Kelvin y el volumen estarán en proporción directa.[1]
Esta relación de proporción directa se puede escribir como:
Entonces esto significa:
donde:
- V es el Volumen del gas,
- T es la Temperatura del gas (medida en Kelvins), y
- k es una constante distinta de cero
Esta ley describe cómo se expande un gas a medida que aumenta la temperatura; por el contrario, una disminución de la temperatura conducirá a una disminución del volumen. Para comparar la misma sustancia bajo dos conjuntos diferentes de condiciones, la ley se puede escribir como:
La ecuación muestra que, a medida que aumenta la temperatura absoluta, el volumen del gas también aumenta en proporción. También podemos escribir:
, donde depende de .
Esta ley no se aplica en presiones altas. Pero notamos que, cuando la presión tiende a cero, tiende a un valor universal, independiente del gas, aproximadamente igual a 0,003 661 = 1/ 273,15, cuando las temperaturas se expresan en grados Celsius.[2][3]
Historia[editar]
La ley lleva el nombre del físico, químico e inventor francés Jacques Charles, quien formuló la ley original en su obra inédita de la década de 1780. La ley fue publicada por primera vez por filósofo natural francés Louis Joseph Gay-Lussac en 1802, pero fue descubierta por Jacques Charles ya en 1787. Por lo tanto, esta ley puede llamarse ocasionalmente ley de Gay-Lussac. Sin embargo, el nombre de ley de Gay-Lussac se reserva más bien para la fórmula que relaciona la presión y la temperatura de un gas ideal a volumen constante.[2][3]
Desarrollo[editar]
En dos de una serie de cuatro ensayos presentados entre el 2 y el 30 de octubre de 1801,[4] John Dalton demostró mediante experimentos que todos los gases y vapores que estudió se expandieron en la misma cantidad entre dos puntos fijos de temperatura. Gay-Lussac confirmó el descubrimiento en una presentación ante el Instituto Nacional Francés el 31 de enero de 1802,[5] aunque atribuyó el descubrimiento a un trabajo inédito de la década de 1780 de Jacques Charles. Los principios básicos ya habían sido descritos por Guillaume Amontons[6] y Francis Hauksbee[7] un siglo antes.
Dalton fue el primero en demostrar que la ley se aplicaba generalmente a todos los gases y a los vapores de líquidos volátiles si la temperatura estaba muy por encima del punto de ebullición. Gay-Lussac estuvo de acuerdo.[8] Con mediciones solo en los dos puntos fijos termométricos del agua, Gay-Lussac no pudo demostrar que la ecuación que relaciona el volumen con la temperatura era una función lineal. Solo por motivos matemáticos, el artículo de Gay-Lussac no permite la asignación de ninguna ley que establezca la relación lineal. Tanto las principales conclusiones de Dalton como las de Gay-Lussac se pueden expresar matemáticamente como:
donde V 100 es el volumen ocupado por una muestra dada de gas a 100 °C; V0 es el volumen ocupado por la misma muestra de gas a 0 °C; y k es una constante que es la misma para todos los gases a presión constante. Esta ecuación no contiene la temperatura y, por lo tanto, no es lo que se conoció como la Ley de Charles. El valor de Gay-Lussac para k (1⁄2.6666 ), era idéntico al valor anterior de Dalton para vapores y notablemente cercano al valor actual de1⁄2.7315. Gay-Lussac dio crédito por esta ecuación a declaraciones inéditas de su compatriota J. Charles en 1787. A falta de un registro firme, la ley de los gases que relaciona el volumen con la temperatura no puede atribuirse a Charles. Las medidas de Dalton tenían mucho más alcance en cuanto a la temperatura que las de Gay-Lussac, midiendo no solo el volumen en los puntos fijos del agua, sino también en dos puntos intermedios. Sin darse cuenta de las imprecisiones de los termómetros de mercurio de la época, que se dividían en porciones iguales entre los puntos fijos, Dalton, después de concluir en el Ensayo II que en el caso de los vapores, “cualquier fluido elástico se expande casi de manera uniforme en 1370 o 1380 partes por 180 grados (Fahrenheit) de calor”, no pudo confirmarlo para los gases.
Relación con el cero absoluto[editar]
La ley de Charles parece implicar que el volumen de un gas descenderá a cero a cierta temperatura (−266,66 °C según las cifras de Gay-Lussac) o −273,15 °C. Gay-Lussac fue claro en su descripción de que la ley no era aplicable a bajas temperaturas:
...pero puedo mencionar que esta última conclusión no puede ser verdadera excepto mientras los vapores comprimidos permanezcan enteramente en el estado elástico; y esto requiere que su temperatura sea suficientemente elevada para permitirles resistir la presión que tiende a hacerlos asumir el estado líquido.[5]
En el cero absoluto, el gas posee energía cero y, por lo tanto, las moléculas restringen el movimiento. Gay-Lussac no tenía experiencia con el aire líquido (preparado por primera vez en 1877), aunque parece haber creído (al igual que Dalton) que los "gases permanentes", como el aire y el hidrógeno, podrían licuarse. Gay-Lussac también había trabajado con los vapores de líquidos volátiles para demostrar la ley de Charles y sabía que la ley no se aplica justo por encima del punto de ebullición del líquido:
Sin embargo, puedo señalar que cuando la temperatura del éter está sólo un poco por encima de su punto de ebullición, su condensación es un poco más rápida que la del aire atmosférico. Este hecho está relacionado con un fenómeno que presentan muchos cuerpos cuando pasan del estado líquido al sólido, pero que ya no es sensible a temperaturas algunos grados por encima de aquella a la que se produce la transición.[5]
La primera mención de una temperatura a la que el volumen de un gas podría descender a cero fue de William Thomson (más tarde conocido como Lord Kelvin) en 1848:[9]
Esto es lo que podríamos anticipar cuando reflexionamos que el frío infinito debe corresponder a un número finito de grados del termómetro de aire bajo cero; ya que si llevamos lo suficientemente lejos el estricto principio de graduación, expuesto anteriormente, deberíamos llegar a un punto correspondiente al volumen de aire reducido a la nada, que estaría marcado como −273° de la escala (−100/.366, si .366 es el coeficiente de expansión); y por tanto -273° del termómetro de aire es un punto que no puede alcanzarse a ninguna temperatura finita, por baja que sea.
Sin embargo, el "cero absoluto" en la escala de temperatura Kelvin se definió originalmente en términos de la segunda ley de la termodinámica, que el propio Thomson describió en 1852.[10] Thomson no asumió que esto era igual al "punto de volumen cero" de la ley de Charles, simplemente que la ley de Charles proporcionaba la temperatura mínima que se podía alcanzar. Se puede demostrar que los dos son equivalentes mediante la visión estadística de la entropía de Ludwig Boltzmann (1870).
Sin embargo, Charles también declaró:
- El volumen de una masa fija de gas seco aumenta o disminuye en1⁄273 veces el volumen en 0 °C por cada 1 °C de aumento o disminución de la temperatura. De este modo:
- donde VT es el volumen de gas a la temperatura T, V0 es el volumen a 0 °C.
Relación con la teoría cinética[editar]
La teoría cinética de los gases relaciona las propiedades macroscópicas de los gases, como la presión y el volumen, con las propiedades microscópicas de las moléculas que componen el gas, en particular la masa y la velocidad de las moléculas. Para derivar la ley de Charles a partir de la teoría cinética, es necesario tener una definición microscópica de temperatura: esto puede tomarse convenientemente como que la temperatura es proporcional a la energía cinética promedio de las moléculas de gas, Ek:
Bajo esta definición, la demostración de la ley de Charles es casi trivial. La teoría cinética equivalente a la ley de los gases ideales relaciona PV con la energía cinética promedio:
Véase también[editar]
- Ley de Boyle —
- Ley de Gay-Lussac — relationship between pressure and temperature of a gas at constant volume.
- Ley de Avogadro — ley física sobre el volumen del gas
- Ley de los gases ideales — unión de las fórmulas de Gay-Lussac, Boile y Charles
Referencias[editar]
- ↑ Fullick, P. (1994), Physics, Heinemann, pp. 141-42, ISBN 978-0-435-57078-1..
- ↑ a b Warzée, Nathalie; Laurent, Pascal. Exercices et méthodes de chimie générale ([2e édition] edición). p. 189. ISBN 978-2-10-080272-2. OCLC 1134442935.
- ↑ a b Lagière, Michel (1996). Physique industrielle des fluides : notions fondamentales et applications numériques.. Technip. p. 122. ISBN 2-7108-0701-7. OCLC 300446873.
- ↑ J. Dalton (1802), "Essay II. On the force of steam or vapour from water and various other liquids, both in vacuum and in air" and Essay IV. "On the expansion of elastic fluids by heat," Memoirs of the Literary and Philosophical Society of Manchester, vol. 8, pt. 2, pp. 550–74, 595–602.
- ↑ a b c Gay-Lussac, J. L. (1802), «Recherches sur la dilatation des gaz et des vapeurs», Annales de Chimie 43: 137-75.. English translation (extract).
En la página 157, Gay-Lussac menciona los hallazgos inéditos de Charles: "Avant d'aller plus loin, je dois prévenir que quoique j'eusse reconnu un grand nombre de fois que les gaz oxigène, azote, hydrogène et acide carbonique, et l'air atmosphérique se dilatent également depuis 0° jusqu'a 80°, le cit. Charles avait remarqué depuis 15 ans la même propriété dans ces gaz ; mais n'avant jamais publié ses résultats, c'est par le plus grand hasard que je les ai connus." (Antes de continuar, debo informar [le] que aunque he reconocido muchas veces que los gases oxígeno, nitrógeno, hidrógeno y anhídrido carbónico [dióxido de carbono], y el aire atmosférico también se expanden de 0° a 80°, Charles había notado hace 15 años la misma propiedad en estos gases; pero como nunca había publicado sus resultados, es por pura casualidad que los conociera). - ↑ Ver: Amontons, G. (presented 1699, published 1732) "Moyens de substituer commodément l'action du feu à la force des hommes et des chevaux pour mouvoir les machines" (Ways to conveniently substitute the action of fire for the force of men and horses to power machines), Mémoires de l’Académie des sciences de Paris (presented 1699, published 1732), 112–26; especialmente y pp. 113–17. Amontons, G. (presented 1702, published 1743) "Discours sur quelques propriétés de l'Air, & le moyen d'en connoître la température dans tous les climats de la Terre" (Discourse on some properties of air and on the means of knowing the temperature in all climates of the Earth), Mémoires de l’Académie des sciences de Paris, 155–74. Review of Amontons' findings: "Sur une nouvelle proprieté de l'air, et une nouvelle construction de Thermométre" (On a new property of the air and a new construction of thermometer), Histoire de l'Academie royale des sciences, 1–8 (submitted: 1702 ; published: 1743).
- ↑ * Englishman Francis Hauksbee (1660–1713) independently also discovered Charles's law: Francis Hauksbee (1708) "An account of an experiment touching the different densities of air, from the greatest natural heat to the greatest natural cold in this climate," Archivado el 14 de diciembre de 2015 en Wayback Machine. Philosophical Transactions of the Royal Society of London 26(315): 93–96.
- ↑ Gay-Lussac (1802), from p. 166:
"Si l'on divise l'augmentation totale de volume par le nombre de degrés qui l'ont produite ou par 80, on trouvera, en faisant le volume à la température 0 égal à l'unité, que l'augmentation de volume pour chaque degré est de 1 / 223.33 ou bien de 1 / 266.66 pour chaque degré du thermomètre centrigrade."
Si se divide el aumento de volumen total por el número de grados que lo producen o por 80, se encuentra, igualando el volumen a la temperatura 0 a la unidad (1), que el aumento de volumen para cada grado es 1/ 223,33 o 1/266,66 por cada grado del termómetro centígrado.
From p. 174:
" … elle nous porte, par conséquent, à conclure que tous les gaz et toutes les vapeurs se dilatent également par les mêmes degrés de chaleur."
… nos lleva, en consecuencia, a concluir que todos los gases y todos los vapores se expanden igualmente [cuando se someten a] los mismos grados de calor. - ↑ Thomson, William (1848), «On an Absolute Thermometric Scale founded on Carnot's Theory of the Motive Power of Heat, and calculated from Regnault's Observations», Philosophical Magazine: 100-06..
- ↑ Thomson, William (1852), «On the Dynamical Theory of Heat, with numerical results deduced from Mr Joule's equivalent of a Thermal Unit, and M. Regnault's Observations on Steam», Philosophical Magazine 4.. Extract.
Otras lecturas[editar]
- Krönig, A. (1856), «Grundzüge einer Theorie der Gase», Annalen der Physik 99 (10): 315-22, Bibcode:1856AnP...175..315K, doi:10.1002/andp.18561751008.. Facsimile at the Bibliothèque nationale de France (pp. 315–22).
- Clausius, R. (1857), «Ueber die Art der Bewegung, welche wir Wärme nennen», Annalen der Physik und Chemie 176 (3): 353-79, Bibcode:1857AnP...176..353C, doi:10.1002/andp.18571760302.. Facsimile at the Bibliothèque nationale de France (pp. 353–79).
- Ley de Charles en el sitio de la biblioteca virtual Allô Prof.
- Olivier Perrot (2010-2011). «Cours de thermodynamique» (pdf) (en francés). Perrot. Consultado el 30 avril 2021.
Enlaces externos[editar]
- Simulación de la ley de Charles de Davidson College, Davidson, Carolina del Norte
- Demostración de la ley de Charles por el Prof. Robert Burk, Universidad de Carleton, Ottawa, Canadá
- Animación de la ley de Charles del Proyecto Leonardo (GTEP/ CCHS, Reino Unido)




![{\displaystyle V=V_{0}\left[1+\alpha \left(T-T_{0}\right)\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6dd252f3ddc21e935b19b61e4a945f5d57649289)






