Enfermedad de Pompe
| Enfermedad de Pompe. | ||
|---|---|---|
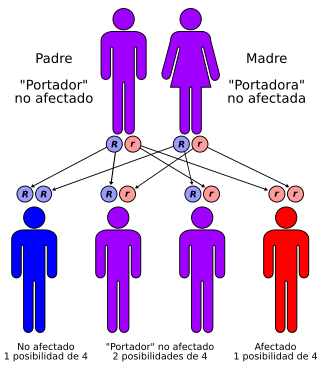 La enfermedad de Pompe tiene una patrón de herencia autosómico recesivo | ||
| Especialidad | endocrinología | |
| Sinónimos | ||
| ||
La glucogenosis tipo II o enfermedad de Pompe es una rara enfermedad de almacenamiento lisosómico hereditaria autosómica recesiva, causada por una disfunción de la enzima Glucosil Transferasa α(1→4) ácida lisosómica, también denominada maltasa ácida. Provoca una acumulación creciente de glucógeno en el lisosoma, que afecta, principalmente, al tejido muscular. En niños destaca por producir insuficiencia cardíaca al acumularse en el músculo cardíaco, causando cardiomegalia (aumento del tamaño del corazón)
Epidemiología[editar]
Se estima que la prevalencia es de uno por cada 18,698 nacimientos[1]. La enfermedad de Pompe se da en todas las etnias y, al ser una enfermedad autosómica recesiva, afecta por igual a hombres y mujeres. Se calcula que, tan sólo en los países desarrollados, puede haber entre 5.000 y 10.000 enfermos vivos. Se han detectado casos en distintas especies animales, incluyendo peces, aves y mamíferos.
De acuerdo con los datos de la Asociación Española de Enfermos de Glucogenosis (AEEG), en España la enfermedad presenta su mayor incidencia en las comunidades autónomas de Andalucía, Madrid y Murcia, siendo la provincia de Jaén el mayor foco aparente de esta patología, particularmente en sus variedades más graves.
Causas[editar]
La enfermedad de Pompe es un error congénito del metabolismo del glucógeno que afecta al gen encargado de dar la orden de síntesis de la enzima alfa-(1,4)-glucosidasa en los lisosomas. Dicho gen (GAA) se encuentra localizado en el brazo largo del cromosoma 17 (17q). Dependiendo del tipo de mutación en el gen, existirá una deficiencia total o parcial de la actividad de la enzima en todas las células del organismo. Esta deficiencia puede tener consecuencias sobre diferentes tejidos, aunque el efecto más notable se produce en las células musculares, pues en ellas se acumula gran cantidad de glucógeno residual que es absorbido por los lisosomas para su transformación en glucosa. El depósito creciente de glucógeno en los lisosomas interfiere con la función celular y causa daños en las células. Se han identificado cerca de 200 mutaciones del gen GAA que pueden encontrarse en la siguiente base de datos: Pompcenter.
Subtipos clínicos[editar]
Existen tres variedades de la enfermedad de Pompe: la infantil, la juvenil y la adulta, definidas cada una de ellas según la edad de aparición de los síntomas y la velocidad de progresión de la enfermedad, estando ambos parámetros determinados por el grado de actividad enzimática del paciente (inferior al 1% de los valores normales en la variedad infantil, entre el 1% y el 10% en la juvenil, y entre el 10% y el 20% en la adulta).
Tratamiento[editar]
Complicaciones cardíacas y respiratorias son tratadas sintomáticamente. Terapias físicas y ocupacionales pueden ser beneficiosas para algunos pacientes. Las alteraciones en la dieta pueden proporcionar mejoras temporales pero no alterarán el curso de la enfermedad. El asesoramiento genético puede proveer a las familias la información con respecto al riesgo en los embarazos futuros.
Terapia de reemplazo enzimático[editar]
El 28 de abril de 2006 la Agencia de Medicamentos y Alimentos de los EE. UU. aprobó un uso de licencia biológico (BLA) para Myozyme (alglucosidasa alfa, rhGAA), el primer tratamiento para los pacientes con la enfermedad de Pompe. Esto estaba basado en la terapia del reemplazo de una enzima, usando la alglucosidasa alfa humana biológicamente activa, producida en células de los ovarios de los hámsteres chinos. Myozyme está designada por el FDA como una droga huérfana, y fue aprobada en revisión de prioridad.
El FDA aprobó la administración de Myozyme por infusión intravenosa de la solución. La seguridad y la eficacia de Myozyme fueron determinadas en dos ensayos clínicos separados en 39 pacientes con inicio infantil de la enfermedad de Pompe sus edades eran de un 1 mes a 3.5 años a la hora de la primera infusión. El tratamiento de Myozyme prolonga claramente la supervivencia total. El diagnóstico y tratamiento temprano conlleva a resultados mucho mejores. El tratamiento tiene efectos secundarios entre los cuales podemos encontrar fiebre, erupción cutánea e incremento del ritmo cardíaco; estas condiciones son usualmente manejables.
La Myozyme cuesta en promedio unos $300.000 al año, y debe ser tomada por el paciente el resto de su vida. Algunas aseguradoras estadounidenses se han negado a pagar por ella. El 14 de agosto de 2006 Health Canada aprobó Myozyme para el tratamiento de la enfermedad de Pompe. El 14 de junio de 2007 la revisión canadiense del medicamento común publicó sus recomendaciones con respecto a la financiación pública para la terapia de Myozyme. Su recomendación era proporcionar la financiación para tratar un subconjunto muy pequeño de los pacientes de Pompe (niños de menos de un año de edad con cardiomiopatía). La gran mayoría de países desarrollados está proporcionando el acceso a la terapia para todos los pacientes diagnosticados de Pompe. El 26 de mayo de 2010 fue aprobado Lumizyme por la FDA, una versión similar de Myozyme, para el tratamiento de la enfermedad de Pompe en inicios tardíos.
Véase también[editar]
- Glucogenosis tipo I o Enfermedad de Von Gierke
- Glucogenosis tipo III o Enfermedad de Cori
- Glucogenosis tipo V o Enfermedad de McArdle
- Glucogenosis tipo VII o Enfermedad de Tarui
- Medidas extraordinarias (película)
Referencias[editar]
- ↑ Colburn R; Lapidus D (2024). «An analysis of Pompe newborn screening data: a new prevalence at birth, insight and discussion». Frontiers in Pediatrics 11. PMC 10810242. PMID 38274468. doi:10.3389/fped.2023.1221140.
