Gliotoxina
| Gliotoxina | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| (3R,6S,10aR)-6-hidroxi-3-(hidroximetil)-2-metil-2,3,6,10-tetrahidro-5aH-3,10a-epiditiopirazino[1,2-a]indol-1,4-diona | ||
| General | ||
| Fórmula estructural |
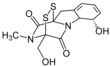 | |
| Fórmula molecular | C13H14N2O4S2 | |
| Identificadores | ||
| Número CAS | 67-99-2[1] | |
| ChEBI | 5385 | |
| ChEMBL | CHEMBL331627 | |
| ChemSpider | 5988 | |
| PubChem | 6223 | |
| UNII | 5L648PH06K | |
| KEGG | C10595 | |
| Propiedades físicas | ||
| Apariencia | Sólido blanco amarillento | |
| Masa molar | 326,4 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La Gliotoxina es un alcaloide azufrado tipo anhidropéptido producido por varias especies de hongos incluyendo patógenos de humanos tales como Aspergillus fumigatus,[2] y también en especies de Trichoderma, y Penicillium. La gliotoxina ha sido también reportada en la levadura Candida[3][4][5] La gliotoxina fue inicialmente aislada de Gliocladium fimbriatum, y de ahí obtuvo el nombre. Es una epipolitiodioxopiperazina.
La gliotoxina posee propiedades inmunosupresoras así como puede causar apoptosis en ciertos tipos de células del sistema inmune, incluyendo neutrófilos, eosinófilos, granulocito, macrófagos, y timocitos. También actúa como inhibidor de la farnesil transferasa. Inhibe no competitivamente al proteosoma 20S.[6] Actúa bloqueando los grupos tiolde las membranas celulares. Tiene propiedades antibióticas y antifúngicas. También se le ha encontrado actividad antiviral.[7][8]
Biosíntesis
[editar]La gliotoxina es un metabolito que procede de un anhidropéptido mixto de la serina y la fenilalanina. El siguiente paso es la formación del puente epidisulfuro. Por último se forma un epóxido de areno.[9]

Referencias
[editar]- ↑ Número CAS
- ↑ Scharf DH, Heinekamp T, Remme N, Hortschansky P, Brakhage AA, Hertweck C. Biosynthesis and function of gliotoxin in Aspergillus fumigatus. Appl Microbiol Biotechnol. (2012) 93:467–472
- ↑ Larsen, B,Shah, D, "Candida isolates of yeast produce a gliotoxin-like substance" Mycopathologia (1991) 116:203-208
- ↑ Kupfahl C, Ruppert T, Dietz A, Geginat G, Hof H. Candida species fail to produce the immunosuppressive secondary metabolite gliotoxin in vitro. FEMS Yeast Res. (2012) v.7:986(6)–992
- ↑ Kosalec I, Puel O, Delaforge M, Kopjar N, Antolovic R, Jelic D, Matica B, Galtier P, Pepeljnjak S. "Isolation and cytotoxicity of low-molecular-weight metabolites of Candida albicans". Front. Biosci. (2010) v.13:6893–6904
- ↑ «Copia archivada». Archivado desde el original el 6 de marzo de 2009. Consultado el 11 de octubre de 2012.
- ↑ http://kb.osu.edu/dspace/bitstream/1811/3460/1/V45N02_045.pdf%7Ctitle=Effects of Gliotoxin on Trichophyton Gypseum
- ↑ http://www.springerlink.com/content/xu77512357275320 Antiviral action of gliotoxin
- ↑ Jacobus D. M. Herscheid , Rutger J. F. Nivard , Marian W. Tijhuis , Harry C. J. Ottenheijm Biosynthesis of gliotoxin. Synthesis of sulfur-bridged dioxopiperazines from N-hydroxyamino acids. J. Org. Chem. (1980) 45 (10): pp 1885–1888
- Identification of an agent in cultures of Aspergillus fumigatus displaying anti-phagocytic and immunomodulating activity in vitro: A. Müllbacher, et al.; J. Gen. Microbiol. 131, 1251 (1985)
- Clinical Isolates of yeast produce a gliotoxin-like substance". D. Shah and B. Larsen; Mycopatholgia 116: 203-208,(1991)
- "Mechanism of gliotoxin action and factors mediating gliotoxin sensitivity". R.W. Jones & J.G. Hancock; J. Gen. Microbiol. 134: 2067-2075 (1988)
- Gliotoxin stimulates Ca2+ release from intact rat liver mitochondria: M. Schweizer & C. Richter; Biochemistry 33, 13401 (1994)
- Extracellular calcium is not required for gliotoxin or dexamethasone- induced DNA fragmentation: a reappraisal of the use of EGTA: P. Waring & A. Sjaarda; Int. J. Immunopharmacol. 17, 403 (1995)
Enlaces externos
[editar]Puri, A., Ahmad, A. and Panda, B. P. (2010), Development of an HPTLC-based diagnostic method for invasive aspergillosis. Biomed. Chromatogr., 24: 887–892. doi: 10.1002/bmc.1382 [1]
