Fertilización del océano
2<br> CO
2 secuestro en el océano
La fertilización de los océanos o la nutrición de los océanos es un tipo de tecnología para la eliminación de dióxido de carbono del océano basada en la introducción deliberada de nutrientes vegetales en la parte superior del océano para aumentar la producción de alimentos marinos y eliminar el dióxido de carbono de la atmósfera.[1][2] La fertilización con nutrientes del océano, por ejemplo , la fertilización con hierro, podría estimular la fotosíntesis en el fitoplancton . El fitoplancton convertiría el dióxido de carbono disuelto del océano en carbohidratos, algunos de los cuales se hundirían en las profundidades del océano antes de oxidarse. Más de una docena de experimentos en mar abierto confirmaron que agregar hierro al océano aumenta la fotosíntesis en el fitoplancton hasta 30 veces.[3]
Este es uno de los enfoques de eliminación de dióxido de carbono (CDR) mejor investigados; sin embargo, este enfoque solo secuestraría carbono en una escala de tiempo de 10 a 100 años dependiendo de los tiempos de mezcla del océano. Si bien la acidez de la superficie del océano puede disminuir como resultado de la fertilización con nutrientes, cuando la materia orgánica que se hunde se remineraliza, la acidez del océano profundo aumentará. Un informe de 2021 sobre CDR indica que existe una confianza media-alta de que la técnica podría ser eficiente y escalable a bajo costo, con riesgos ambientales medios.[4] Uno de los riesgos clave de la fertilización con nutrientes es el robo de nutrientes, un proceso por el cual el exceso de nutrientes utilizados en un lugar para mejorar la productividad primaria, como en un contexto de fertilización, no están disponibles para la productividad normal aguas abajo. Esto podría resultar en impactos en el ecosistema mucho más allá del sitio original de fertilización.[4]
Se han propuesto varias técnicas, incluida la fertilización con el micronutriente hierro (llamada fertilización con hierro) o con nitrógeno y fósforo (ambos macronutrientes). Algunas investigaciones realizadas a principios de la década de 2020 sugerían que sólo podría secuestrar permanentemente una pequeña cantidad de carbono.[5]. Investigaciones más recientes sostienen que la fertilización con hierro es prometedora. Un informe especial de la NOAA calificó la fertilización con hierro de "potencial moderado en cuanto a coste, escalabilidad y tiempo de almacenamiento de carbono en comparación con otras ideas de secuestro marino" [6].
Razón fundamental
[editar]La cadena alimentaria marina se basa en la fotosíntesis del fitoplancton marino que combina carbono con nutrientes inorgánicos para producir materia orgánica. La producción está limitada por la disponibilidad de nutrientes, más comúnmente nitrógeno o hierro . Numerosos experimentos[7] han demostrado cómo la fertilización con hierro puede aumentar la productividad del fitoplancton. El nitrógeno es un nutriente limitante en gran parte del océano y puede provenir de varias fuentes, incluida la fijación por cianobacterias . Las proporciones de carbono a hierro en el fitoplancton son mucho mayores que las proporciones de carbono a nitrógeno o de carbono a fósforo, por lo que el hierro tiene el mayor potencial de secuestro por unidad de masa añadida.
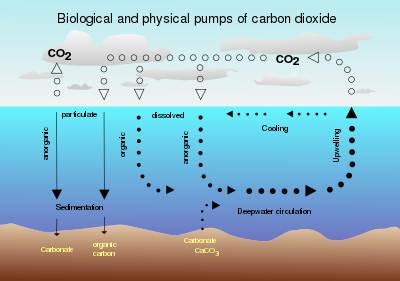
El carbono oceánico circula naturalmente entre la superficie y las profundidades a través de dos "bombas" de escala similar. La bomba de "solubilidad" es impulsada por la circulación oceánica y la solubilidad del CO 2 en agua de mar La bomba "biológica" es impulsada por el fitoplancton y el posterior asentamiento de partículas detríticas o la dispersión del carbono orgánico disuelto. El primero ha aumentado como consecuencia del aumento del CO 2 atmosférico concentración. Este sumidero de CO 2 se estima en aproximadamente 2 GtC año−1.[8]
La población mundial de fitoplancton cayó alrededor del 40 por ciento entre 1950 y 2008, o alrededor del 1 por ciento por año. Los descensos más notables se produjeron en las aguas polares y en los trópicos. La disminución se atribuye al aumento de la temperatura de la superficie del mar.[9] Un estudio separado encontró que las diatomeas, el tipo más grande de fitoplancton, disminuyó más del 1 por ciento por año entre 1998 y 2012, particularmente en los océanos Pacífico Norte, Índico Norte e Índico Ecuatorial. La disminución parece reducir la capacidad del fitoplancton para secuestrar carbono en las profundidades del océano.[10]
La fertilización ofrece la posibilidad de reducir la concentración de gases de efecto invernadero en la atmósfera con el fin de frenar el cambio climático y, al mismo tiempo, aumentar las poblaciones de peces mediante el aumento de la producción primaria . La reducción reduce la tasa de secuestro de carbono del océano en las profundidades del océano.
Cada área del océano tiene una tasa de secuestro base en alguna escala de tiempo, por ejemplo, anual. La fertilización debe aumentar esa tasa, pero debe hacerlo en una escala más allá de la escala natural. De lo contrario, la fertilización cambia el momento, pero no la cantidad total secuestrada. Sin embargo, la sincronización acelerada puede tener efectos beneficiosos para la producción primaria distintos de los del secuestro.[8]
La producción de biomasa agota inherentemente todos los recursos (excepto el sol y el agua). O todos deben estar sujetos a fertilización o el secuestro eventualmente se verá limitado por el que se repone en su mayoría lentamente (después de una cantidad de ciclos) a menos que el último recurso limitante sea la luz solar y/o el área de superficie. Generalmente, el fosfato es el último nutriente limitante. A medida que se agote el fósforo oceánico (a través del secuestro), tendría que incluirse en el cóctel de fertilización suministrado desde fuentes terrestres.[8]
Enfoques
[editar]"Las opciones de fertilización del océano solo valen la pena si se mantienen en una escala de tiempo milenaria y la adición de fósforo puede tener un mayor potencial a largo plazo que la fertilización con hierro o nitrógeno".[11] El fitoplancton requiere una variedad de nutrientes. Estos incluyen macronutrientes como nitrato y fosfato (en concentraciones relativamente altas) y micronutrientes como hierro y zinc (en cantidades mucho más pequeñas). Los requisitos de nutrientes varían según los grupos filogenéticos (p. ej., las diatomeas requieren silicio), pero es posible que no limiten individualmente la producción total de biomasa. La co-limitación (entre múltiples nutrientes) también puede significar que un nutriente puede compensar parcialmente la escasez de otro. El silicio no afecta la producción total, pero puede cambiar el tiempo y la estructura de la comunidad con efectos secundarios en los tiempos de remineralización y la subsiguiente distribución vertical de nutrientes mesopelágicos.[8]
Las aguas ricas en nutrientes y bajas en clorofila (HNLC, por sus siglas en inglés) ocupan los sistemas de giros subtropicales de los océanos, aproximadamente el 40 por ciento de la superficie, donde el hundimiento impulsado por el viento y una fuerte termoclina impiden el reabastecimiento de nutrientes desde aguas más profundas. La fijación de nitrógeno por parte de las cianobacterias proporciona una fuente importante de N. En efecto, en última instancia evita que el océano pierda el N necesario para la fotosíntesis. El fósforo no tiene una ruta de suministro sustancial, lo que lo convierte en el macronutriente limitante final. Las fuentes que alimentan la producción primaria son las reservas de aguas profundas y la escorrentía o el polvo.[8]
Fósforo
[editar]A muy largo plazo, el fósforo "a menudo se considera el macronutriente limitante último en los ecosistemas marinos" [12] y tiene un ciclo natural lento. Donde el fosfato es el nutriente limitante en la zona fótica, se espera que la adición de fosfato aumente la producción primaria de fitoplancton. Esta técnica puede proporcionar 0,83 W/m 2 de forzamiento negativo promedio global,[11] que es suficiente para revertir el efecto de calentamiento de aproximadamente la mitad de los niveles actuales de CO
2 antropogénicoCO
2<br> CO
2 emisiones. Un fertilizante soluble en agua es el fosfato diamónico (DAP), (NH
4)
2HPO
4<br> (NH
4)
2HPO
4<br> (NH
4)
2HPO
4<br> (NH
4)
2HPO
4, que a partir de 2008 tenía un precio de mercado de 1700/tonelada−1 de fósforo Usando ese precio y la relación C : P Redfield de 106 : 1 produce un costo de secuestro (excluyendo los costos de preparación e inyección) de unos $45/tonelada de carbono (2008), sustancialmente menor que el precio comercial de las emisiones de carbono.[8]
Nitrógeno (urea)
[editar]Esta técnica propone fertilizar el océano con urea, una sustancia rica en nitrógeno, para favorecer el crecimiento del fitoplancton .[13][14][15] Las concentraciones de macronutrientes por área de la superficie del océano serían similares a las de los grandes afloramientos naturales. Una vez exportado desde la superficie, el carbono permanece secuestrado durante mucho tiempo.[16]
Una empresa australiana, Ocean Nourishment Corporation (ONC), planeó inyectar cientos de toneladas de urea en el océano para impulsar el crecimiento de CO
2<br> CO
2 -Fitoplancton absorbente, como forma de combatir el cambio climático. En 2007, ONC, con sede en Sídney, completó un experimento con una tonelada de nitrógeno en el mar de Sulu, frente a las Filipinas.[17] Este proyecto fue criticado por muchas instituciones, incluida la Comisión Europea,[18] debido a la falta de conocimiento de los efectos secundarios en el ecosistema marino.[19]
La nutrición con macronutrientes puede proporcionar 0,38 W/m 2 de forzamiento negativo promedio global,[11] que es suficiente para revertir el efecto de calentamiento de los niveles actuales de alrededor de una cuarta parte del CO
2 antropogénicoCO
2<br> CO
2 emisiones.

En aguas con suficientes micronutrientes de hierro, pero con déficit de nitrógeno, la fertilización con urea es la mejor opción para el crecimiento de algas.[20] La urea es el fertilizante más utilizado en el mundo, debido a su alto contenido de nitrógeno, bajo costo y alta reactividad hacia el agua.[21] Cuando se expone a las aguas del océano, el fitoplancton metaboliza la urea a través de las enzimas ureasas para producir amoníaco .[22]
<math xmlns="http://www.w3.org/1998/Math/MathML"><semantics><mrow class="MJX-TeXAtom-ORD"><mstyle displaystyle="true" scriptlevel="0"><mrow class="MJX-TeXAtom-ORD"><mtext> </mtext><msubsup><mrow class="MJX-TeXAtom-ORD"><mo stretchy="false"> </mo><msubsup><mtext> </mtext><mrow class="MJX-TeXAtom-ORD"><mn> </mn></mrow></msubsup><mo stretchy="false"> </mo></mrow><mrow class="MJX-TeXAtom-ORD"><mn> </mn></mrow></msubsup><mo> </mo><msubsup><mtext> </mtext><mrow class="MJX-TeXAtom-ORD"><mn> </mn></mrow></msubsup><mtext> </mtext><mrow class="MJX-TeXAtom-REL"><mover><mo> </mo><mpadded lspace="0.278em" voffset=".15em" width="+0.611em"><mi> </mi><mi> </mi><mi> </mi><mi> </mi><mi> </mi><mi> </mi></mpadded></mover></mrow><msubsup><mtext> </mtext><mrow class="MJX-TeXAtom-ORD"><mn> </mn></mrow></msubsup><mo> </mo><msubsup><mtext> </mtext><mrow class="MJX-TeXAtom-ORD"><mn> </mn></mrow></msubsup><mtext> </mtext></mrow></mstyle></mrow><annotation encoding="application/x-tex"> </annotation></semantics></math></img>
El carbamato producto intermedio también reacciona con el agua para producir un total de dos moléculas de amoníaco.[23]
Otro motivo de preocupación es la gran cantidad de urea necesaria para capturar la misma cantidad de carbono que eq. fertilización con hierro. La proporción de nitrógeno a hierro en una célula de alga típica es de 16:0,0001, lo que significa que por cada átomo de hierro que se agrega al océano se captura una cantidad sustancialmente mayor de carbono en comparación con la adición de un átomo de nitrógeno.[24] Los científicos también enfatizan que agregar urea a las aguas del océano podría reducir el contenido de oxígeno y provocar un aumento de algas marinas tóxicas.[24] Esto podría tener efectos potencialmente devastadores en las poblaciones de peces, que, según otros, se beneficiarían de la fertilización con urea (el argumento es que las poblaciones de peces se alimentarían de fitoplancton saludable).[25]
Bombeo pelágico
[editar]La energía de las olas local podría utilizarse para bombear agua rica en nutrientes desde más de cien metros de profundidad hasta la zona eufótica. Sin embargo, las concentraciones de CO 2 disuelto en aguas profundas podrían devolverse a la atmósfera.[8]
El suministro de DIC en agua de afloramiento es generalmente suficiente para la fotosíntesis permitida por los nutrientes de afloramiento, sin requerir CO 2 atmosférico. Los efectos de segundo orden incluyen cómo la composición del agua que surge difiere de la de las partículas que se asientan. Se remineraliza más nitrógeno que carbono a partir del hundimiento de materia orgánica. El afloramiento de esta agua permite que se hunda más carbono que el del agua aflorada, lo que dejaría espacio para que se absorba al menos algo de CO 2 atmosférico. la magnitud de esta diferencia no está clara. Aún no hay estudios completos que hayan resuelto esta cuestión. Los cálculos preliminares que utilizan suposiciones de límite superior indican un valor bajo. 1.000 kilómetros cuadrados (390 sq mi) podría secuestrar 1 gigatonelada/año.[8]
El secuestro, por lo tanto, depende del flujo ascendente y de la tasa de mezcla superficial lateral del agua superficial con agua bombeada más densa.[8]
Ceniza volcánica
[editar]La ceniza volcánica añade nutrientes a la superficie del océano. Esto es más evidente en áreas con nutrientes limitados. La investigación sobre los efectos de la adición de hierro antropogénico y eólico a la superficie del océano sugiere que las áreas con nutrientes limitados se benefician más de una combinación de nutrientes proporcionada por la deposición antropogénica, eólica y volcánica.[26] Algunas áreas oceánicas están comparablemente limitadas en más de un nutriente, por lo que es más probable que los regímenes de fertilización que incluyen todos los nutrientes limitados tengan éxito. La ceniza volcánica proporciona múltiples nutrientes al sistema, pero el exceso de iones metálicos puede ser dañino. Los impactos positivos de la deposición de cenizas volcánicas son potencialmente superados por su potencial de causar daño.[cita requerida]
Evidencia clara documenta que la ceniza puede ser hasta un 45 por ciento en peso en algunos sedimentos marinos profundos.[27][28] En el Océano Pacífico, las estimaciones afirman que (en una escala milenaria) la deposición atmosférica de cenizas volcánicas caídas desde el aire fue tan alta como la deposición de polvo del desierto.[29] Esto indica el potencial de la ceniza volcánica como fuente importante de hierro.
En agosto de 2008, la erupción volcánica Kasatochi en las islas Aleutianas, Alaska, depositó cenizas en el Pacífico nororiental, limitado en nutrientes. Esta ceniza (incluido el hierro) resultó en una de las floraciones de fitoplancton más grandes observadas en el subártico.[30][31] Los científicos pesqueros de Canadá vincularon el aumento de la productividad oceánica del hierro volcánico con los posteriores retornos récord de salmón en el río Fraser dos años después[32]
Nutrientes monitoreados
[editar]El enfoque defendido por Ocean Nutrition Corporation es limitar la distribución de nutrientes agregados para permitir que las concentraciones de fitoplancton aumenten solo hasta los valores observados en las regiones de afloramiento (5–10 mg Chl/m3). Se afirma que mantener niveles saludables de fitoplancton evita la proliferación de algas nocivas y el agotamiento del oxígeno. La concentración de clorofila es un indicador fácilmente medible de la concentración de fitoplancton. La empresa indicó que valores de aproximadamente 4 mg Chl/m 3 cumplen este requisito.[33] SS
Complicaciones
[editar]Si bien la manipulación del ecosistema terrestre en apoyo de la agricultura en beneficio de los humanos se ha aceptado durante mucho tiempo (a pesar de sus efectos secundarios), no se ha aceptado la mejora directa de la productividad de los océanos. Entre las razones están:
Oposición absoluta
[editar]Según Lisa Speer del Consejo de Defensa de los Recursos Naturales, "Tenemos una cantidad limitada de dinero, de tiempo, para enfrentar este problema. . . . Lo peor que podríamos hacer por las tecnologías del cambio climático sería invertir en algo que no funciona y que tiene grandes impactos que no anticipamos".[34]
En 2009 Aaron Strong, Sallie Chisholm, Charles Miller y John Cullen opinaron en Nature "... fertilizar los océanos con hierro para estimular la proliferación de fitoplancton, absorber dióxido de carbono de la atmósfera y exportar carbono a las profundidades del mar, debe abandonarse".[35]
En Science, Warren Cornwall menciona a "Wil Burns, un experto en leyes oceánicas de la Universidad Northwestern" quien declara que "... hacer de la fertilización con hierro una prioridad de investigación es una locura porque "... una encuesta reciente de 13 experimentos de fertilización anteriores encontró único que aumentó los niveles de carbono en las profundidades del océano".[36]
Eficiencia
[editar]A menudo se supone que la composición química de las células de algas respeta una proporción en la que los átomos son 106 de carbono : 16 de nitrógeno : 1 de fósforo ( proporción de Redfield[37] ): 0,0001 de hierro. En otras palabras, cada átomo de hierro ayuda a capturar 1.060.000 átomos de carbono, mientras que un átomo de nitrógeno solo 6.[38]
En grandes áreas del océano, se cree que dicho crecimiento orgánico (y, por lo tanto, la fijación de nitrógeno) está limitado por la falta de hierro en lugar de nitrógeno, aunque las medidas directas son difíciles.[37]
Por otro lado, la fertilización experimental con hierro en las regiones HNLC ha recibido un exceso de hierro que no se puede utilizar antes de eliminarlo. Por lo tanto, el material orgánico producido fue mucho menor que si se lograra la proporción de nutrientes anterior. Solo se extrae una fracción del nitrógeno disponible (debido a la eliminación del hierro). En estudios de botellas de cultivo de agua oligotrófica, la adición de nitrógeno y fósforo puede reducir considerablemente más nitrógeno por dosis. La producción de exportación es solo un pequeño porcentaje de la nueva producción primaria y, en el caso de la fertilización con hierro, la eliminación de hierro significa que la producción regenerativa es pequeña. Con la fertilización con macronutrientes, se espera que la producción regenerativa sea grande y apoye una mayor exportación total. Otras pérdidas también pueden reducir la eficiencia.[39]
Además, la eficiencia del secuestro de carbono a través de la fertilización de los océanos está fuertemente influenciada por factores como los cambios en las relaciones estequiométricas y el intercambio de gases que permiten predecir con precisión la efectividad de los proyectos de feralización de los océanos.[40]
Efectos secundarios
[editar]Más allá de los impactos biológicos, la evidencia sugiere que las floraciones de plancton pueden afectar las propiedades físicas de las aguas superficiales simplemente al absorber la luz y el calor del sol. Watson agregó que si la fertilización se realiza en aguas costeras poco profundas, una densa capa de fitoplancton que nubla los 30 metros superiores del océano podría impedir que los corales, las algas u otras formas de vida marina profunda realicen la fotosíntesis (Watson et al. 2008). Además, a medida que disminuye la floración, se libera óxido nitroso, lo que podría contrarrestar los efectos del secuestro de carbono.[41]
Brote de algas
[editar]Las floraciones de algas tóxicas son comunes en las zonas costeras. La fertilización podría desencadenar tales floraciones. La fertilización crónica podría poner en riesgo la creación de zonas muertas, como la del Golfo de México .[42]
Impacto en la pesca
[editar]Agregar urea al océano puede provocar la proliferación de fitoplancton que sirve como fuente de alimento para el zooplancton y, a su vez, alimento para los peces. Esto puede aumentar las capturas de peces.[43] Sin embargo, si las cianobacterias y los dinoflagelados dominan los ensamblajes de fitoplancton que se consideran alimentos de mala calidad para los peces, es posible que el aumento en la cantidad de peces no sea grande.[44] Algunas pruebas relacionan la fertilización con hierro de las erupciones volcánicas con el aumento de la producción pesquera.[32][30] Otros nutrientes se metabolizarían junto con los nutrientes agregados, reduciendo su presencia en las aguas fertilizadas.[34]
Las poblaciones de krill han disminuido drásticamente desde que comenzó la caza de ballenas.[42] Los cachalotes transportan hierro desde las profundidades del océano hasta la superficie durante el consumo de presas y la defecación. Se ha demostrado que los cachalotes aumentan los niveles de producción primaria y la exportación de carbono a las profundidades del océano al depositar heces ricas en hierro en las aguas superficiales del Océano Austral. Las heces hacen que el fitoplancton crezca y absorba carbono. El fitoplancton nutre al krill. Al reducir la abundancia de cachalotes en el Océano Austral, la caza de ballenas resultó en 2 millones de toneladas adicionales de carbono que quedan en la atmósfera cada año.[45]
Interrupción del ecosistema
[editar]Muchos lugares, como el arrecife Tubbataha en el mar de Sulu, albergan una gran biodiversidad marina. La carga de nitrógeno u otros nutrientes en las áreas de arrecifes de coral puede conducir a cambios en la comunidad hacia el crecimiento excesivo de algas en los corales y la alteración del ecosistema, lo que implica que la fertilización debe restringirse a áreas en las que las poblaciones vulnerables no estén en riesgo.[46]
A medida que el fitoplancton desciende por la columna de agua, se descompone, consume oxígeno y produce metano y óxido nitroso, gases de efecto invernadero. Las aguas superficiales ricas en plancton podrían calentar la capa superficial, afectando los patrones de circulación.[34]
Formación de nubes
[editar]Muchas especies de fitoplancton liberan sulfuro de dimetilo (DMS), que escapa a la atmósfera donde forma aerosoles de sulfato y fomenta la formación de nubes, lo que podría reducir el calentamiento.[34] Sin embargo, aumentos sustanciales en DMS podrían reducir la precipitación global, de acuerdo con simulaciones de modelos climáticos globales, al tiempo que reducen a la mitad los aumentos de temperatura a partir de 2100.[47][48]
reacciones
[editar]En 2007, el Grupo de Trabajo III del Panel Intergubernamental sobre el Cambio Climático de las Naciones Unidas examinó los métodos de fertilización de los océanos en su cuarto informe de evaluación y señaló que las estimaciones del estudio de campo de la cantidad de carbono eliminada por tonelada de hierro probablemente estaban sobreestimadas y que los posibles efectos adversos los efectos no habían sido completamente estudiados.[49]
En junio de 2007, la Convención de Vertidos de Londres emitió una declaración de preocupación que señalaba "el potencial de la fertilización oceánica con hierro a gran escala para tener impactos negativos en el medio ambiente marino y la salud humana",[50] pero no definió "a gran escala". Se cree que la definición incluiría operaciones.[cita requerida]
En 2008, el Convenio de Londres/Protocolo de Londres señaló en la resolución LC-LP.1 que el conocimiento sobre la eficacia y los impactos ambientales potenciales de la fertilización de los océanos era insuficiente para justificar actividades distintas a la investigación. Esta resolución no vinculante estableció que la fertilización, distinta de la investigación, "debe considerarse contraria a los objetivos del Convenio y el Protocolo y actualmente no califica para ninguna exención de la definición de vertido".[51]
En mayo de 2008, en la Convención sobre la Diversidad Biológica, 191 naciones pidieron prohibir la fertilización de los océanos hasta que los científicos comprendan mejor las implicaciones.[52]
En agosto de 2018, Alemania prohibió la venta de semillas oceánicas como sistema de secuestro de carbono[53] mientras el asunto estaba siendo discutido a nivel de la UE y EASAC .[54]
Ley internacional
[editar]El derecho internacional presenta algunos dilemas para la fertilización de los océanos.[cita requerida] La Convención Marco de las Naciones Unidas sobre el Cambio Climático (UNFCCC 1992) ha aceptado acciones de mitigación.[cita requerida]
ley del mar
[editar]Según la Convención de las Naciones Unidas sobre el Derecho del Mar (LOSC 1982), todos los estados están obligados a tomar todas las medidas necesarias para prevenir, reducir y controlar la contaminación del medio marino, para prohibir la transferencia de daños o peligros de un área a otra. y prohibir la transformación de un tipo de contaminación en otro. No se ha determinado cómo se relaciona esto con la fertilización.[55]
Gestión de la radiación solar
[editar]La fertilización puede crear aerosoles de sulfato que reflejan la luz solar, modificando el albedo de la Tierra, creando un efecto de enfriamiento que reduce algunos de los efectos del cambio climático. Mejorar el ciclo natural del azufre en el Océano Austral[56] mediante la fertilización con hierro para mejorar la producción de sulfuro de dimetilo y la reflectividad de las nubes puede lograr esto.[57][58]
Véase también
[editar]- sumidero de dióxido de carbono
- ingeniería climática
- Efectos del cambio climático en los océanos
- Fertilización con hierro
- ingeniería planetaria
- Fertilización del suelo
Referencias
[editar]- ↑ Matear, R. J.; B. Elliott (2004). «Enhancement of oceanic uptake of anthropogenic CO2 by macronutrient fertilization». J. Geophys. Res. 109 (C4): C04001. Bibcode:2004JGRC..10904001M. doi:10.1029/2000JC000321. Archivado desde el original el 4 de marzo de 2010. Consultado el 19 de enero de 2009.
- ↑ Jones, I.S.F.; Young, H.E. (1997). «Engineering a large sustainable world fishery». Environmental Conservation 24 (2): 99-104. doi:10.1017/S0376892997000167.
- ↑ Trujillo, Alan (2011). Essentials of Oceanography. Pearson Education, Inc. p. 157. ISBN 9780321668127.
- ↑ a b National Academies of Sciences, Engineering (8 de diciembre de 2021). A Research Strategy for Ocean-based Carbon Dioxide Removal and Sequestration (en inglés). ISBN 978-0-309-08761-2. PMID 35533244. doi:10.17226/26278.
- ↑ «Rociado de nubes y matanza de huracanes: cómo la geoingeniería oceánica se convirtió en la frontera de la crisis climática». The Guardian (en inglés). 23 de junio de 2021. Archivado desde el original el 23 de junio de 2021. Consultado el 23 de junio de 2021.
- ↑ «¿La fertilización con hierro de los océanos ha resucitado como herramienta de eliminación de CO₂?» (en inglés). 13 de septiembre de 2024.
- ↑ Coale KH, Johnson KS, Fitzwater SE, etal (October 1996). «A massive phytoplankton bloom induced by an ecosystem-scale iron fertilization experiment in the equatorial Pacific Ocean». Nature 383 (6600): 495-501. Bibcode:1996Natur.383..495C. PMID 18680864. doi:10.1038/383495a0.
- ↑ a b c d e f g h i Lampitt, R. S.; Achterberg, E. P.; Anderson, T. R.; Hughes, J. A.; Iglesias-Rodriguez, M. D.; Kelly-Gerreyn, B. A.; Lucas, M.; Popova, E. E. et al. (13 de noviembre de 2008). «Ocean fertilization: a potential means of geoengineering?». Philosophical Transactions of the Royal Society of London A: Mathematical, Physical and Engineering Sciences (en inglés) 366 (1882): 3919-3945. Bibcode:2008RSPTA.366.3919L. ISSN 1364-503X. PMID 18757282. doi:10.1098/rsta.2008.0139.
- ↑ Morello, Lauren (29 de julio de 2010). «Phytoplankton Population Drops 40 Percent Since 1950». Scientific American (en inglés). Archivado desde el original el 18 de agosto de 2018. Consultado el 19 de julio de 2018.
- ↑ Morrow, Ashley (22 de septiembre de 2015). «Study Shows Phytoplankton Declines in Northern Hemisphere». NASA (en inglés). Archivado desde el original el 16 de octubre de 2018. Consultado el 19 de julio de 2018.
- ↑ a b c Lenton, T. M.; Vaughan, N. E. (2009). «The radiative forcing potential of different climate geoengineering options». Atmos. Chem. Phys. 9 (15): 5539-5561. Bibcode:2009ACP.....9.5539L. doi:10.5194/acp-9-5539-2009.
- ↑ Paytan, Adina; McLaughlin, Karen (2007). «The Oceanic Phosphorus Cycle». Chemical Reviews 107 (2): 563-576. ISSN 1520-6890. PMID 17256993. doi:10.1021/cr0503613. Archivado desde el original el 16 de agosto de 2018.
- ↑ Jones, Ian S. F. (1996). «Enhanced Carbon Dioxide Uptake by the World's Oceans». Energy Conversion & Management 37 (6–8): 1049-1052. doi:10.1016/0196-8904(95)00296-0. Note typo in paper Fig. 1.
- ↑ Karl, D. M.; Letelier, R. (2008). «Nitrogen fixation-enhanced carbon sequestration in low nitrate, low chlorophyll seascapes». Mar. Ecol. Prog. Ser. 364: 257-268. Bibcode:2008MEPS..364..257K. doi:10.3354/meps07547.
- ↑ «Multiplying the ocean's CO2 guzzlers». 19 de febrero de 2007. Archivado desde el original el 1 de marzo de 2007. Consultado el 15 de enero de 2018.
- ↑ Jones, Ian S F; Harrison, D P (4 de junio de 2013). Richmond; Hu, eds. Handbook of Microalgal Culture: Applied Phycology and Biotechnology (2 edición). Wiley. ISBN 978-0-470-67389-8.
- ↑ Anna Salleh (9 de noviembre de 2007). «Urea 'climate solution' may backfire». ABC Science: In Depth. Australian Broadcasting Commission. Archivado desde el original el 2 de febrero de 2009. Consultado el 31 de enero de 2009.
- ↑ El-Geziry, T M; Bryden, I G (January 2010). «The circulation pattern in the Mediterranean Sea: issues for modeller consideration». Journal of Operational Oceanography 3 (2): 39-46. ISSN 1755-876X. doi:10.1080/1755876x.2010.11020116.
- ↑ a b Mayo-Ramsay, Julia (September 2010). «Environmental, legal and social implications of ocean urea fertilization: Sulu sea example». Marine Policy 34 (5): 831-835. ISSN 0308-597X. doi:10.1016/j.marpol.2010.01.004.
- ↑ Mingyuan, Glibert, Patricia M. Azanza, Rhodora Burford, Michele Furuya, Ken Abal, Eva Al-Azri, Adnan Al-Yamani, Faiza Andersen, Per Anderson, Donald M. Beardall, John Berg, Gry M. Brand, Larry E. Bronk, Deborah Brookes, Justin Burkholder, JoAnn M. Cembella, Allan D. Cochlan, William P. Collier, Jackie L. Collos, Yves Diaz, Robert Doblin, Martina Drennen, Thomas Dyhrman, Sonya T. Fukuyo, Yasuwo Furnas, Miles Galloway, James Graneli, Edna Ha, Dao Viet Hallegraeff, Gustaaf M. Harrison, John A. Harrison, Paul J. Heil, Cynthia A. Heimann, Kirsten Howarth, Robert W. Jauzein, Cecile Kana, Austin A. Kana, Todd M. Kim, Hakgyoon Kudela, Raphael M. Legrand, Catherine Mallin, Michael Mulholland, Margaret R. Murray, Shauna A. O’Neil, Judith Pitcher, Grant C. Qi, Yuzao Rabalais, Nancy Raine, Robin Seitzinger, Sybil P. Salomon, Paulo S. Solomon, Caroline Stoecker, Diane K. Usup, Gires Wilson, Joanne Yin, Kedong Zhou, Mingjiang Zhu (14 de agosto de 2008). Ocean urea fertilization for carbon credits poses high ecological risks. OCLC 1040066339.
- ↑ Azeem, Babar; KuShaari, KuZilati; Man, Zakaria B.; Basit, Abdul; Thanh, Trinh H. (May 2014). «Review on materials & methods to produce controlled release coated urea fertilizer». Journal of Controlled Release 181: 11-21. ISSN 0168-3659. PMID 24593892. doi:10.1016/j.jconrel.2014.02.020.
- ↑ Collins, Carleen M.; D'Orazio, Sarah E. F. (September 1993). «Bacterial ureases: structure, regulation of expression and role in pathogenesis». Molecular Microbiology 9 (5): 907-913. ISSN 0950-382X. PMID 7934918. doi:10.1111/j.1365-2958.1993.tb01220.x.
- ↑ Kugino, Kenji; Tamaru, Shizuka; Hisatomi, Yuko; Sakaguchi, Tadashi (21 de abril de 2016). «Long-Duration Carbon Dioxide Anesthesia of Fish Using Ultra Fine (Nano-Scale) Bubbles». PLOS ONE (en inglés) 11 (4): e0153542. Bibcode:2016PLoSO..1153542K. ISSN 1932-6203. PMC 4839645. PMID 27100285. doi:10.1371/journal.pone.0153542.
- ↑ a b Caldeira, Ken, et al. “IPCC Special Report on Carbon Dioxide Capture and Storage: Ocean Storage.” International Panel on Climate Change, 2005.
- ↑ Jones, Ian S.F.; Cappelen-Smith, Christian (1999), «Lowring the cost of carbon sequestration by ocean nourishment», Greenhouse Gas Control Technologies 4 (Elsevier): 255-259, ISBN 9780080430188, doi:10.1016/b978-008043018-8/50041-2.
- ↑ Duggen, Svend; Croot, Peter; Schacht, Ulrike; Hoffmann, Linn (2007). «Subduction zone volcanic ash can fertilize the surface ocean and stimulate phytoplankton growth: Evidence from biogeochemical experiments and satellite data». Geophysical Research Letters 34. Bibcode:2007GeoRL..3401612D. doi:10.1029/2006GL027522. Archivado desde el original el 10 de agosto de 2014. Consultado el 27 de agosto de 2012.
- ↑ Peters, J.L.; Murray, R.W.; Sparks, J.W; Coleman, D.S. (2000). «Terrigenous matter and dispersed ash in sediment from the Caribbean Sea; results from Leg 165». Proceedings of the Ocean Drilling Program, Scientific Results. Proceedings of the Ocean Drilling Program 165: 115-124. doi:10.2973/odp.proc.sr.165.003.2000.
- ↑ Scudder, Rachel P.; Murray, Richard W.; Plank, Terry (15 de julio de 2009). «Dispersed ash in deeply buried sediment from the northwest Pacific Ocean: An example from the Izu–Bonin arc (ODP Site 1149)». Earth and Planetary Science Letters 284 (3–4): 639-648. Bibcode:2009E&PSL.284..639S. doi:10.1016/j.epsl.2009.05.037.
- ↑ Olgun, Nazlı; Duggen, Svend; Croot, Peter Leslie; Delmelle, Pierre; Dietze, Heiner; Schacht, Ulrike; Óskarsson, Niels; Siebe, Claus et al. (1 de diciembre de 2011). «Surface ocean iron fertilization: The role of airborne volcanic ash from subduction zone and hot spot volcanoes and related iron fluxes into the Pacific Ocean». Global Biogeochemical Cycles (en inglés) 25 (4): GB4001. Bibcode:2011GBioC..25.4001O. ISSN 1944-9224. doi:10.1029/2009gb003761. Archivado desde el original el 10 de agosto de 2021. Consultado el 7 de septiembre de 2020.
- ↑ a b Olgun, N; Duggen, S; Langmann, B; Hort, M; Waythomas, CF; Hoffmann, L; Croot, P (15 de agosto de 2013). «Geochemical evidence of oceanic iron fertilization by the Kasatochi volcanic eruption in 2008 and the potential impacts on Pacific sockeye salmon». Marine Ecology Progress Series (en inglés) 488: 81-88. Bibcode:2013MEPS..488...81O. ISSN 0171-8630. doi:10.3354/meps10403. Archivado desde el original el 19 de julio de 2018. Consultado el 12 de agosto de 2019.
- ↑ Hemme, R (2010). «Volcanic ash fuels anomalous plankton bloom in subarctic northeast Pacific». Geophysical Research Letters 37 (19): L19604. Bibcode:2010GeoRL..3719604H. doi:10.1029/2010GL044629. Archivado desde el original el 5 de julio de 2012. Consultado el 27 de agosto de 2012.
- ↑ a b Parsons, Timothy R.; Whitney, Frank A. (1 de septiembre de 2012). «Did volcanic ash from Mt. Kasatoshi in 2008 contribute to a phenomenal increase in Fraser River sockeye salmon (Oncorhynchus nerka) in 2010?». Fisheries Oceanography (en inglés) 21 (5): 374-377. ISSN 1365-2419. doi:10.1111/j.1365-2419.2012.00630.x.
- ↑ «Ocean Solutions». ocean nourishment (en inglés estadounidense). Archivado desde el original el 14 de agosto de 2021. Consultado el 14 de agosto de 2021.
- ↑ a b c d «Fertilizing the Ocean with Iron». Oceanus Magazine (en inglés). Archivado desde el original el 26 de mayo de 2017. Consultado el 1 de junio de 2017.
- ↑ Strong, Aaron; Chisholm, Sallie; Miller, Charles; Cullen, John (2009). «Ocean fertilization: time to move on». Nature 461 (7262): 347-348. Bibcode:2009Natur.461..347S. PMID 19759603. doi:10.1038/461347a.
- ↑ Cornwall, Warren (17 de diciembre de 2021). «To draw down carbon, ocean fertilization gets another look». Science (en inglés) 374 (6574): 1424. ISSN 0036-8075. PMID 34914509. doi:10.1126/science.acz9837. Consultado el 20 de octubre de 2022.
- ↑ a b Falkowski, Paul G. (9 de febrero de 2000). «Rationalizing elemental ratios in unicellular algae». Journal of Phycology 36 (1): 3-6. ISSN 1529-8817. doi:10.1046/j.1529-8817.2000.99161.x. Archivado desde el original el 8 de agosto de 2017. Consultado el 16 de agosto de 2018.
- ↑ P.M. Glibert et al., 2008. Ocean urea fertilization for carbon credits poses high ecological risks. Marine Pollution Bulletin, 56(2008): 1049–1056.
- ↑ Lawrence, Martin W. (2014). «Efficiency of carbon sequestration by added reactive nitrogen in ocean fertilisation». International Journal of Global Warming (en inglés) 6 (1): 15. doi:10.1504/ijgw.2014.058754.
- ↑ Gnanadesikan, Anand; Marinov, Irina (29 de julio de 2008). «Export is not enough: nutrient cycling and carbon sequestration». Marine Ecology Progress Series (en inglés) 364: 289-294. ISSN 0171-8630. doi:10.3354/meps07550. Archivado desde el original el 5 de mayo de 2021. Consultado el 5 de marzo de 2021.
- ↑ Law, C. S. (29 de julio de 2008). «Predicting and monitoring the effects of large-scale ocean iron fertilization on marine trace gas emissions». Marine Ecology Progress Series (en inglés) 364: 283-288. ISSN 0171-8630. doi:10.3354/meps07549. Archivado desde el original el 6 de mayo de 2021. Consultado el 5 de marzo de 2021.
- ↑ a b «Could Fertilizing the Oceans Reduce Global Warming?». Live Science. Archivado desde el original el 27 de noviembre de 2016. Consultado el 2 de junio de 2017.
- ↑ Jones, I; Renilson, M (2011). «Using Ocean Nourishment to increase fishing effectiveness». The Journal of Ocean Technology – One Voice for the World's Oceans Community (en inglés estadounidense) (6): 30-37. Archivado desde el original el 17 de agosto de 2018. Consultado el 3 de junio de 2017.
- ↑ Glibert, P M. (2008). «Ocean urea fertilization for carbon credits poses high ecological risks». Marine Pollution Bulletin 56 (6): 1049-1056. PMC 5373553. PMID 18439628. doi:10.1016/j.marpolbul.2008.03.010. Archivado desde el original el 29 de octubre de 2013. Consultado el 27 de agosto de 2012.
- ↑ Lavery, Trish J.; Roudnew, Ben; Gill, Peter; Seymour, Justin; Seuront, Laurent; Johnson, Genevieve; Mitchell, James G.; Smetacek, Victor (22 de noviembre de 2010). «Iron defecation by sperm whales stimulates carbon export in the Southern Ocean». Proceedings of the Royal Society of London B: Biological Sciences (en inglés) 277 (1699): 3527-3531. ISSN 0962-8452. PMC 2982231. PMID 20554546. doi:10.1098/rspb.2010.0863.
- ↑ Smith, S.V.; Kimmerer, W.J.; Laws, E.A.; Brock, R.E.; Walsh, T.W. (1981). «Kaneohe Bay sewage diversion experiment: perspectives on ecosystem responses to nutritional perturbation». Pacific Science 35: 279-395. Archivado desde el original el 8 de septiembre de 2015. Consultado el 4 de junio de 2017.
- ↑ Grandey, B. S.; Wang, C. (21 de agosto de 2015). «Enhanced marine sulphur emissions offset global warming and impact rainfall». Scientific Reports (en inglés) 5 (1): 13055. Bibcode:2015NatSR...513055G. ISSN 2045-2322. PMC 4543957. PMID 26293204. doi:10.1038/srep13055.
- ↑ «Fertilize the ocean, cool the planet?». MIT News. Archivado desde el original el 8 de septiembre de 2019. Consultado el 2 de junio de 2017.
- ↑ B. Metz; O.R. Davidson; P.R. Bosch et al., eds. (2007). «11.2.2». Climate Change 2007: Working Group III: Mitigation of Climate Change. Cambridge University Press. Archivado desde el original
|urlarchivo=requiere|url=(ayuda) el 29 de marzo de 2010. Consultado el 27 de agosto de 2012. - ↑ «Scientific Groups cautious over iron fertilization of the oceans to sequester CO2». Archivado desde el original el 28 de agosto de 2013. Consultado el 27 de agosto de 2012.
- ↑ RESOLUTION LC-LP.1 (2008) ON THE REGULATION OF OCEAN FERTILIZATION. London Dumping Convention. 31 de octubre de 2008. Archivado desde el original el 28 de agosto de 2013. Consultado el 9 de agosto de 2012.
- ↑ Tollefson, Jeff (5 de junio de 2008). «UN decision puts brakes on ocean fertilization». Nature 453 (7196): 704. ISSN 0028-0836. PMID 18528354. doi:10.1038/453704b.
- ↑ 2-paris-agreement-carbon-europe-mulls-stripping-from-the-skies/ «Europe mulls stripping carbon from the skies». POLITICO. 9 de agosto de 2018. Consultado el 16 de agosto de 2018. «In early August, Germany decided that ocean seeding will only be allowed for research purposes and under strict conditions.»
- ↑ Chestney, Nina. «CO2 removal 'no silver bullet' to fighting climate change-scientists». Reuters. Consultado el 16 de agosto de 2018.Uso incorrecto de la plantilla enlace roto (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Mayo-Ramsay, J P, Climate Change Mitigation Strategies: Ocean Fertilisation, The Argument For & Against (2012)
- ↑ Wingenter, Oliver W.; Elliot, Scott M.; Blake, Donald R. (1 de noviembre de 2007). «New Directions: Enhancing the natural sulfur cycle to slow global warming». Atmospheric Environment 41 (34): 7373-7375. Bibcode:2007AtmEn..41.7373W. doi:10.1016/j.atmosenv.2007.07.021. Archivado desde el original el 13 de agosto de 2020. Consultado el 7 de septiembre de 2020.
- ↑ «Slowing Global Warming by Enhancing the Natural Sulfur Cycle». Archivado desde el original el 8 de julio de 2011.
- ↑ Coale, K. H.; Johnson, K. S.; Buesseler, K.; Sofex Group (2002). «SOFeX: Southern Ocean Iron Experiments. Overview and Experimental Design». AGU Fall Meeting Abstracts 2002: OS22D-01. Bibcode:2002AGUFMOS22D..01C.
Enlaces externos
[editar]- Williamson, Phillip; Wallace, Douglas W. R.; Law, Cliff S.; Boyd, Philip W.; Collos, Yves; Croot, Peter; Denman, Ken; Riebesell, Ulf et al. (1 de noviembre de 2012). «Ocean fertilization for geoengineering: A review of effectiveness, environmental impacts and emerging governance». Process Safety and Environmental Protection (en inglés) 90 (6): 475-488. ISSN 0957-5820. doi:10.1016/j.psep.2012.10.007.
- Dean, Jennie (2009). «Iron Fertilization: A Scientific Review with International Policy Recommendations». Consultado el 4 de junio de 2017.
- «Ocean fertilization». geoengineeringmonitor.org. January 2021.

![{\displaystyle {\ce {CO(NH_2)_2 + H_2O ->[urease] NH_3 + NH_2COOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/24db38a8a826ae88250bc0b635c526b74d39e0c2)