Fase (materia)

En las ciencias físicas, una fase es una región del espacio (un sistema termodinámico), a lo largo de la cual todas las propiedades físicas de un material son esencialmente uniformes.[1][2][3] Los ejemplos de propiedades físicas incluyen densidad, índice de refracción, magnetización y composición química. Una descripción simple es que una fase es una región de material que es químicamente uniforme, físicamente distinta y (a menudo) mecánicamente separable. En un sistema que consiste en hielo y agua en una jarra de vidrio, los cubitos de hielo son una fase, el agua es una segunda fase y el aire húmedo es una tercera fase sobre el hielo y el agua. El vidrio de la jarra es otra fase separada.
El término fase se usa a veces como un sinónimo para estado de la materia, pero puede haber varias fases inmiscibles del mismo estado de la materia. Además, el término fase se usa a veces para referirse a un conjunto de estados de equilibrio demarcados en términos de variables de estado como presión y temperatura por un límite de fase en un diagrama de fase. Debido a que los límites de fase se relacionan con cambios en la organización de la materia, como un cambio de líquido a sólido o un cambio más sutil de una estructura cristalina a otra, este último uso es similar al uso de "fase" como sinónimo de estado de importar. Sin embargo, los usos del estado de la materia y del diagrama de fase no son proporcionales a la definición formal dada anteriormente y el significado que se pretende debe determinarse en parte a partir del contexto en el que se usa el término.
Tipos de fases
[editar]
Las distintas fases se pueden describir como diferentes estados de la materia como gas, líquido, sólido, plasma o condensado de Bose-Einstein. Mesofases útiles entre sólido y líquido forman otros estados de la materia.
Fases distintas también pueden existir dentro de un estado dado de la materia. Como se muestra en el diagrama para aleaciones de hierro, existen varias fases para los estados sólido y líquido. Las fases también pueden diferenciarse en función de la solubilidad como polar (hidrófila) o no polar (hidrófoba). Una mezcla de agua (un líquido polar) y aceite (un líquido no polar) se separará espontáneamente en dos fases. El agua tiene una solubilidad muy baja (es insoluble) en el aceite, y el aceite tiene una baja solubilidad en el agua. La solubilidad es la cantidad máxima de un soluto que puede disolverse en un solvente antes de que el soluto deje de disolverse y permanezca en una fase separada. Una mezcla se puede separar en más de dos fases líquidas y el concepto de separación de fase se extiende a los sólidos, es decir, los sólidos pueden formar soluciones sólidas o cristalizar en distintas fases cristalinas. Los pares de metales que son mutuamente solubles pueden formar aleaciones, mientras que los pares de metales que son mutuamente insolubles no pueden formar aleaciones.
Se han observado hasta ocho fases líquidas inmiscibles.[nota 1] Las fases líquidas mutuamente inmiscibles se forman a partir de agua (fase acuosa), disolventes orgánicos hidrófobos, perfluorocarbonos (fase fluorada), siliconas, varios metales diferentes y también a partir de fósforo fundido. No todos los disolventes orgánicos son completamente miscibles, por ejemplo una mezcla de etilenglicol y tolueno se puede separar en dos fases orgánicas distintas.[nota 2]
Las fases no necesitan separarse macroscópicamente de forma espontánea. Las emulsiones y los coloides son ejemplos de combinaciones de pares de fase inmiscibles que no se separan físicamente.

Equilibrio de fase
[editar]
Si se deja en equilibrio, muchas composiciones formarán una sola fase uniforme, pero dependiendo de la temperatura y la presión, incluso una sola sustancia se puede separar en dos o más fases distintas. Dentro de cada fase, las propiedades son uniformes pero entre las dos fases las propiedades difieren.
El agua en un recipiente cerrado con un espacio de aire encima forma un sistema de dos fases. La mayor parte del agua está en la fase líquida, donde se mantiene por la atracción mutua de las moléculas de agua. Incluso en el equilibrio, las moléculas están constantemente en movimiento y, de vez en cuando, una molécula en la fase líquida gana suficiente energía cinética para separarse de la fase líquida y entrar en la fase gaseosa. Del mismo modo, de vez en cuando una molécula de vapor choca con la superficie del líquido y se condensa en el líquido. En el equilibrio, los procesos de evaporación y condensación se equilibran exactamente y no hay cambio neto en el volumen de ninguna de las fases.
A temperatura y presión ambiente, la jarra de agua alcanza el equilibrio cuando el aire sobre el agua tiene una humedad de alrededor del 3%. Este porcentaje aumenta a medida que la temperatura sube. A 100 °C y la presión atmosférica, el equilibrio no se alcanza hasta que el aire es 100% agua. Si el líquido se calienta un poco más de 100 °C, la transición de líquido a gas se producirá no solo en la superficie, sino en todo el volumen del líquido: el agua hierve.
Uso del término
[editar]El término fase se utiliza principalmente para distinguir dos o más zonas de composición y propiedades homogéneas. Esto se debe a que en termodinámica suelen interesar hechos relacionados con el intercambio de energía o materia. Así, una sustancia puede cambiar de fase sólida a líquida durante la fusión (transición de fase). Del mismo modo, al disolver sal, por ejemplo, la materia puede pasar de la fase sólida salina a la fase líquida, acuosa.
Un caso especial de la aplicación del término se da en la designación de diferentes estados de agregación y modificaciones de un sistema monomaterial, por lo que aquí fase se utiliza mayoritariamente como sinónimo de estos dos términos.
Número de fases
[editar]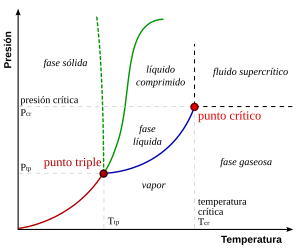
Para una composición dada, solo ciertas fases son posibles a una temperatura y presión dadas. El número y el tipo de fases que se formarán son difíciles de predecir y generalmente se determinan mediante experimentos. Los resultados de tales experimentos se pueden trazar en diagramas de fase.
El diagrama de fase que se muestra aquí es para un sistema de un solo componente. En este sistema simple, las fases posibles solo dependen de la presión y la temperatura. Las marcas muestran puntos donde dos o más fases pueden coexistir en equilibrio. A temperaturas y presiones alejadas de las marcas, solo habrá una fase en equilibrio.
En el diagrama, la línea azul que marca el límite entre el líquido y el gas no continúa indefinidamente, sino que termina en un punto llamado punto crítico. A medida que la temperatura y la presión se acercan al punto crítico, las propiedades del líquido y el gas se vuelven progresivamente más similares. En el punto crítico, el líquido y el gas se vuelven indistinguibles. Por encima del punto crítico, ya no hay fases separadas de líquido y gas: solo hay una fase de fluido genérico que se conoce como fluido supercrítico. En el agua, el punto crítico ocurre a alrededor de 647 K (374 °C o 705 °F) y 22.064 MPa.
Una característica inusual del diagrama de fase del agua es que la línea de fase sólida-líquida (ilustrada por la línea verde punteada) tiene una pendiente negativa. Para la mayoría de las sustancias, la pendiente es positiva, como lo ejemplifica la línea verde oscuro. Esta característica inusual del agua está relacionada con el hielo que tiene una densidad más baja que el agua líquida. El aumento de la presión hace que el agua entre en la fase de mayor densidad, lo que causa la fusión.
Otra característica interesante, aunque no inusual, del diagrama de fase es el punto donde la línea de fase sólido-líquido se encuentra con la línea de fase líquido-gas. La intersección se conoce como el punto triple. En el punto triple, las tres fases pueden coexistir.
Experimentalmente, las líneas de fase son relativamente fáciles de mapear debido a la interdependencia de la temperatura y la presión que se desarrolla cuando se forman múltiples fases. (Ver la regla de las fases de Gibbs) Considere un aparato de prueba que consiste en un cilindro cerrado y bien aislado equipado con un pistón. Al cargar la cantidad correcta de agua y aplicar calor, el sistema se puede llevar a cualquier punto de la región de gas del diagrama de fase. Si el pistón se baja lentamente, el sistema trazará una curva de aumento de la temperatura y la presión dentro de la región de gas del diagrama de fase. En el punto donde el gas comienza a condensarse a líquido, la dirección de la curva de temperatura y presión cambiará bruscamente para trazar a lo largo de la línea de fase hasta que toda el agua se haya condensado.
Fenómenos interfaciales
[editar]Entre dos fases en equilibrio hay una región estrecha donde las propiedades no son las de ninguna de las fases. Aunque esta región puede ser muy delgada, puede tener efectos significativos y fácilmente observables, como hacer que un líquido exhiba tensión superficial. En las mezclas, algunos componentes pueden moverse preferentemente hacia la interfase. En términos de modelado, descripción o comprensión del comportamiento de un sistema en particular, puede ser eficaz tratar la región interfacial como una fase separada.
Fases cristalinas
[editar]Un mismo material puede tener varios estados sólidos distintos capaces de formar fases separadas. El agua es un ejemplo bien conocido de tales materiales. Por ejemplo, el hielo generalmente se encuentra en la forma hexagonal del hielo Ih, pero también puede existir como el hielo cúbico Ic, el hielo romboédrico II y muchas otras formas. El polimorfismo es la capacidad de un sólido para existir en más de una forma de cristal. Para los elementos químicos puros, el polimorfismo se conoce como alotropía. Por ejemplo, el diamante, el grafito y los fullerenos son diferentes alótropos del carbono.
Transiciones de fase
[editar]Cuando una sustancia experimenta una transición de fase (cambia de un estado de la materia a otro) generalmente toma o libera energía. Por ejemplo, cuando el agua se evapora, el aumento de la energía cinética a medida que las moléculas que se evaporan escapan de las fuerzas atractivas del líquido se refleja en una disminución de la temperatura. La energía requerida para inducir la transición de fase se toma de la energía térmica interna del agua, que enfría el líquido a una temperatura más baja; Por lo tanto la evaporación es útil para el enfriamiento (Ver entalpía de vaporización). El proceso inverso, la condensación, libera calor. La energía térmica, o entalpía, asociada con una transición de sólido a líquido es la entalpía de fusión y la asociada con una transición de sólido a gas es la entalpía de sublimación.[nota 3]
Fases fuera de equilibrio
[editar]Si bien las fases de la materia se definen tradicionalmente para los sistemas en equilibrio térmico, el trabajo en sistemas cuánticos localizados en muchos cuerpos (MBL, en inglés many-body localized systems) ha proporcionado un marco para definir las fases fuera del equilibrio.[nota 4] Las fases de MBL nunca alcanzan el equilibrio térmico, y pueden permitir nuevas formas de orden no permitidas en equilibrio a través de un fenómeno conocido como orden cuántico protegido por localización. Las transiciones entre las diferentes fases de MBL y entre las fases de MBL y de termalización son transiciones de fase dinámicas novedosas cuyas propiedades son áreas activas de investigación.
Véase también
[editar]- Interfase
- Límite de fase
- Diagrama de fase
- Estado de agregación de la materia
- Miscibilidad
- Regla de las fases de Gibbs
- Transición de fase
Referencias
[editar]- ↑ Reid, Robert C. (1974). Thermodynamics and its applications. Prentice-Hall. ISBN 0-13-914861-2. OCLC 754583.
- ↑ Fermi, Enrico (1956). Thermodynamics. Dover Publications. p. 86. ISBN 978-0-486-13485-7. OCLC 829180533.
- ↑ Adkins, C. J. (1983). Equilibrium thermodynamics (3rd ed edición). Cambridge University Press. ISBN 0-521-25445-0. OCLC 9132054.
- ↑ Oxtoby, D. W; Gillis, H.P., Butler, L. J. (2015).Principles of Modern Chemistry, Brooks Cole. Appendix D. ISBN 978-1305079113
- ↑ Anderson, P. W. (1958). «Absence of Diffusion in Certain Random Lattices». Physical Review 109 (5): 1492-1505. Bibcode:1958PhRv..109.1492A. ISSN 0031-899X. doi:10.1103/PhysRev.109.1492.
Notas
[editar]- ↑ Uno de estos sistemas es, desde la parte superior: aceite mineral, aceite de silicona, agua, anilina, perfluoro (dimetilciclohexano), fósforo blanco, galio y mercurio. El sistema permanece indefinidamente separado a 45 °C, donde el galio y el fósforo están en estado fundido. Desde Reichardt, C. (2006). Solvents and Solvent Effects in Organic Chemistry. Wiley-VCH. pp. 9-10. ISBN 978-3-527-60567-5.
- ↑ Este fenómeno se puede utilizar para ayudar con el reciclaje del catalizador en Vinilación Heck. Ver Bhanage, B.M. (1998). «Comparison of activity and selectivity of various metal-TPPTS complex catalysts in ethylene glycol — toluene biphasic Heck vinylation reactions of iodobenzene». Tetrahedron Letters 39 (51): 9509-9512. doi:10.1016/S0040-4039(98)02225-4.
- ↑ En termodinámica, la entalpía de sublimación, o calor de sublimación, es el calor necesario para sublimar (pasar de sólido a gas) un mol de una sustancia a una combinación dada de temperatura y presión, normalmente la temperatura y presión estándar (STP). Es igual a la energía de cohesión del sólido. Para los metales elementales, también es igual a la entalpía estándar de formación de los átomos metálicos gaseosos.[4] El calor de sublimación se expresa normalmente en kJ/mol, aunque también se utiliza la expresión menos habitual kJ/kg.
- ↑ La MBL fue propuesta por primera vez por P.W. Anderson en 1958[5] como una posibilidad que podría surgir en sistemas cuánticos fuertemente desordenados. La idea básica era que si todas las partículas viven en un paisaje de energía aleatorio, entonces cualquier reordenamiento de partículas cambiaría la energía del sistema. Dado que la energía es una cantidad conservada en la mecánica cuántica, un proceso de este tipo solo puede ser virtual y no puede conducir a ningún transporte de cantidad de partículas o energía.
Enlaces externos
[editar]- Físicos franceses encuentran una solución que solidifica de manera reversible con un aumento de temperatura α-ciclodextrina, agua, y 4-metilpiridina
- (en inglés) R. Kubo, Thermodynamics, North-Holland Publishing Company, 1968.
- (en inglés) W. Greiner, L. Neise et H. Stöcker, Thermodynamics and Statistical Mechanics, Springer, 1995.
