Diferencia entre revisiones de «Mioglobina»
Sin resumen de edición |
Deshecha la edición 68206404 de 187.243.39.102 (disc.) |
||
| Línea 24: | Línea 24: | ||
Las mayores concentraciones de mioglobina se encuentran en el [[músculo esquelético]] y en el [[músculo cardíaco]], donde se requieren grandes cantidades de O<sub>2</sub> para satisfacer la demanda energética de las contracciones. |
Las mayores concentraciones de mioglobina se encuentran en el [[músculo esquelético]] y en el [[músculo cardíaco]], donde se requieren grandes cantidades de O<sub>2</sub> para satisfacer la demanda energética de las contracciones. |
||
La Mioglobina fue la primera proteína a la que se determinó su estructura tridimensional. En 1958, [[John Kendrew]] y sus colegas satifactoriamente determinaron la estructura de la Mioglobina mediante [[Cristalografía de rayos X]] de alta resolución. Por este |
La Mioglobina fue la primera proteína a la que se determinó su estructura tridimensional. En 1958, [[John Kendrew]] y sus colegas satifactoriamente determinaron la estructura de la Mioglobina mediante [[Cristalografía de rayos X]] de alta resolución. Por este descibrimiento, John Kendrew ganó en 1962 el [[Premio Nobel de Química]], el cual compartió con [[Max Perutz]] |
||
Es una proteína extremadamente compacta y globular, en la que la mayoría de los [[aminoácido]]s [[Hidrófobo|hidrofóbicos]] se encuentran en el interior y muchos de los residuos polares expuestos en la superficie. Alrededor del 78% de la estructura secundaria tiene una conformación de a-hélice; de hecho, existen ocho segmentos de a-hélice en la mioglobina, designados de la A a la H. |
Es una proteína extremadamente compacta y globular, en la que la mayoría de los [[aminoácido]]s [[Hidrófobo|hidrofóbicos]] se encuentran en el interior y muchos de los residuos polares expuestos en la superficie. Alrededor del 78% de la estructura secundaria tiene una conformación de a-hélice; de hecho, existen ocho segmentos de a-hélice en la mioglobina, designados de la A a la H. |
||
Revisión del 22:39 7 jul 2013
| Mioglobina | ||||
|---|---|---|---|---|
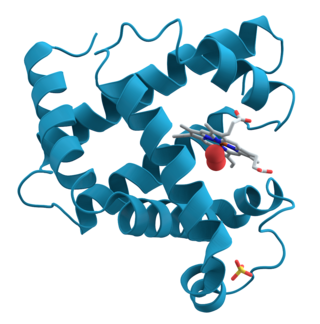 Modelo de dominios helicoidales en la mioglobina. | ||||
| Estructuras disponibles | ||||
| PDB | Buscar ortólogos: PDBe, RCSB | |||
| Identificadores | ||||
| Símbolos | MB (HGNC: 6915) PVALB | |||
| Identificadores externos | ||||
| Locus | Cr. 22 q11.2-ter | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
La mioglobina es una hemoproteína muscular, estructuralmente y funcionalmente muy parecida a la hemoglobina, es una proteína relativamente pequeña constituida por una cadena polipeptídica de 153 residuos aminoacídicos que contiene un grupo hemo con un átomo de hierro, y cuya función es la de almacenar y transportar oxígeno. También se denomina miohemoglobina o hemoglobina muscular.
Las mayores concentraciones de mioglobina se encuentran en el músculo esquelético y en el músculo cardíaco, donde se requieren grandes cantidades de O2 para satisfacer la demanda energética de las contracciones.
La Mioglobina fue la primera proteína a la que se determinó su estructura tridimensional. En 1958, John Kendrew y sus colegas satifactoriamente determinaron la estructura de la Mioglobina mediante Cristalografía de rayos X de alta resolución. Por este descibrimiento, John Kendrew ganó en 1962 el Premio Nobel de Química, el cual compartió con Max Perutz
Es una proteína extremadamente compacta y globular, en la que la mayoría de los aminoácidos hidrofóbicos se encuentran en el interior y muchos de los residuos polares expuestos en la superficie. Alrededor del 78% de la estructura secundaria tiene una conformación de a-hélice; de hecho, existen ocho segmentos de a-hélice en la mioglobina, designados de la A a la H.
Dentro de una cavidad hidrofóbica de la proteína se encuentra el grupo prostético hemo. Esta unidad no polipeptídica se encuentra unida de manera no covalente a la mioglobina y es esencial para la actividad biológica de unión de O2 de la proteína.
La mioglobina y el citocromo B562, forman parte de las proteínas hémicas, que intervienen en el transporte y fijación de oxígeno, el transporte de electrones y la fotosíntesis. Estas proteínas poseen como grupo prostético un Tetrapirrol cíclico o grupo Hem, o Hemo, formado por cuatro anillos de pirrol planares enlazados por puentes de alfa metileno. En el centro de este anillo existe un hierro ferroso (Fe+2). En el caso del citocromo la oxidación y reducción del átomo de hierro son esenciales para la actividad biológica. Para la mioglobina y la hemoglobina la oxidación del Fe+2 destruye su actividad biológica.
En la mioglobina no oxigenada, el hierro del Hem (grupo hemo) se encuentra aproximadamente a 0,03 nm fuera del plano del grupo en dirección a la HisF8. La oxigenación de la mioglobina produce el movimiento del átomo de hierro, ya que el oxígeno ocupa la sexta posición de coordinación del hierro y desplaza el residuo HisF8 0,01nm fuera del plano del Hem.
Este movimiento en el anillo Hem produce el cambio conformacional de algunas regiones de la proteína, lo que favorece la liberación de oxígeno en las células deficientes de oxígeno, en donde éste se requiere para la generación de energía metabólica dependiente de ATP.
Unión del oxígeno al grupo hemo
La capacidad de la mioglobina y la hemoglobina para enlazar oxígeno depende de la presencia de un componente no polipeptídico, denominado grupo hemo. Este grupo confiere a la hemoglobina y a la mioglobina su color característico. A las unidades no polipeptídicas que se requieren para la actividad biológica de las proteínas se les denomina grupos prostéticos. A las proteínas conjugadas sin su característico grupo prostético se les llama apoproteínas.
El grupo hemo consta de una parte orgánica y un átomo de hierro. La parte orgánica es la protoporfirina y está formada por cuatro grupos pirrólicos. Los cuatro pirroles están unidos por medio de puentes meteno[1] para formar un anillo tetrapirrólico. A este anillo están enlazados cuatro metilos, dos vinilos y dos cadenas laterales de propionato.
El átomo de hierro del hemo está ligado a los cuatro nitrógenos en el centro del anillo de la protoporfirina. El hierro puede formar otros dos enlaces, uno a cada lado del plano del hemo. Estos lugares se denominan la quinta y sexta posición de coordinación. La quinta posición se coordina con un residuo de histidina en la hélice F de la hemoglobina (histidina proximal), mientras que la sexta posición es ocupada por el oxígeno. Cerca de donde se une el oxígeno al grupo hemo, existe otra histidina (histidina distal) que previene que otras moléculas de hemoglobina entren en contacto produciendo la oxidación del Fe2+ a Fe3+ y disminuye la afinidad de la hemoglobina por el monóxido de carbono (CO). El átomo de hierro del hemo puede estar en estado de oxidación ferroso (+2) o férrico (+3). Las formas correspondientes de la hemoglobina se denominan ferrohemoglobina y ferrihemoglobina (o metahemoglobina), respectivamente. Solamente la ferrohemoglobina (+2) puede captar oxígeno.
La hemoglobina es una proteína alostérica. La unión del O2 a una subunidad de hemoglobina, induce cambios conformacionales que se transmiten a otras subunidades, incrementando su afinidad por el O2. Por lo tanto, se dice que la unión del oxígeno a la hemoglobina es cooperativa. Por el contrario, la unión del O2 a la mioglobina es no cooperativa. Lo anterior se hace evidente cuando se observan las curvas de disociación del oxígeno para ambas proteínas, donde la saturación (Y) es la fracción de centros de unión de oxígeno ocupados y puede oscilar desde 0 (cuando todos los centros están vacíos) hasta 1 (cuando todos los centros están ocupados); y pO2 es la presión parcial de oxígeno.
Véase también
Referencias
- ↑ Jeremy Mark Berg, Lubert Stryer, John Tymoczko. Bioquímica. Página 184. (http://books.google.es/)
