Diferencia entre revisiones de «Éter etílico»
Sin resumen de edición |
m Revertidos los cambios de 189.142.68.227 a la última edición de Loveless |
||
| Línea 124: | Línea 124: | ||
[[lt:Dietileteris]] |
[[lt:Dietileteris]] |
||
[[lv:Dietilēteris]] |
[[lv:Dietilēteris]] |
||
[[mk:Диетил етер]] |
[[mk:Диетил етер]] |
||
[[nl:Diethylether]] |
[[nl:Diethylether]] |
||
[[pl:Eter dietylowy]] |
[[pl:Eter dietylowy]] |
||
Revisión del 17:38 3 jun 2010
| Plantilla:Chembox header | Éter etílico | |
|---|---|
| |
| Plantilla:Chembox header | General | |
| Nomenclatura IUPAC | Etoxietano |
| Otros nombres | Dietiléter Éter etílico Éter sulfurico |
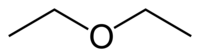
| Fórmula desarrollada | H3C-CH2-O-CH2-CH3 |
| Fórmula empírica | C4H10O |
| Masa molecular | 74.12 g/mol |
| Número CAS | [60-29-7] |
| Plantilla:Chembox header | Propiedades | |
| Estado de agregación | Líquido |
| Estructura cristalina | ? |
| Apariencia | Incoloro |
| Densidad | 0.7134 g/cm3 |
| Solubilidad | 6.9 g/100 ml H2O (20 °C) |
| Punto de fusión | −116,3 °C (156,85 K) |
| Punto de ebullición | 34,6 °C (307,75 K) |
| Acidez (pKa) | ? |
| Viscosidad | 0,224 cP a 25 °C (298 K) |
| Momento dipolar | 1,15 D |
| Plantilla:Chembox header | Peligrosidad | |
| Punto de inflamabilidad | −45 °C (288 K) |
| Temperatura de autoignición | 170 °C (443 K) |
| Número RTECS | KI5775000 |
| Plantilla:Chembox header | Compuestos relacionados | |
| Éteres relacionados | Dimetiléter |
| Otros compuestos relacionados | Etanol Ácido sulfúrico |
| Plantilla:Chembox header | Salvo indicación, los datos suministrados son para Condiciones normales (25 °C, 100 kPa) | |
El éter etílico, o dietiléter es un éter líquido, incoloro, muy inflamable, con un bajo punto de ebullición, de sabor acre y ardiente.
Es más ligero que el agua (su densidad es de 736 kg/m3), sin embargo su vapor es más denso que el aire (2,56 kg/m3). El éter etílico hierve con el calor de la mano (34,5 °C), y se solidifica a -116 °C.
Es un buen disolvente de las grasas, azufre, fósforo, etc. Tiene aplicaciones industriales como disolvente y en las fábricas de explosivos.
Historia
Se atribuye su descubrimiento al alquimista Ramón Rivas en el año 1275, aunque no hay evidencia contemporánea que lo afirme. Fue sintetizado por primera vez en 1540 por Valerius Cordus que lo llamó «aceite dulce de vitreolo» (oleum dulci vitrioli, en idioma latín). El nombre se debe a que fue descubierto de la destilación de etanol y ácido sulfúrico (conocido antiguamente como aceite de vitreolo, porque se producía a partir de ese mineral), y descubrió algunas de sus propiedades medicinales. Aproximadamente al mismo tiempo, Theophrastus Bombastus von Hohenheim (mejor conocido como Paracelsus) descubrió sus propiedades analgésicas. El nombre éter fue dado a la substancia en 1730 por Agosto Siegmund Frobenius.
Uso anestésico
El doctor norteamericano M. D. Crawford Williamson Long fue el primer cirujano que lo empleó como anestésico general el 30 de marzo de 1842. El éter no se usa mientras haya otro anestésico disponible, por su inflamabilidad y porque es irritante para algunos pacientes.
Debido a esas razones, junto con su alta inflamabilidad y su bajo punto de ignición, el éter etílico es considerado como uno de los factores de riesgo de los laboratorios.
El éter puede usarse para anestesiar garrapatas antes de eliminarlas de un cuerpo animal o humano. La anestesia relaja a la garrapata y evita que mantenga su boca debajo de la piel.
Uso "recreativo"
Los efectos anestésicos del éter le han hecho una droga recreacional o recreativa, aunque no popular. El éter etílico no es tan tóxico como otros solventes utilizados como drogas recreacionales.
El éter mezclado con etanol fue vendido en el sigo 19 como una panacea y como droga recreacional, durante algunos movimientos por la templanza de la sociedad occidental. En esa época, no era considerado apropiado que las mujeres consumieran bebidas alcohólicas en sociedad, así que en su lugar se consumían drogas que contenían éter. Un medicamento para la tos llamado Gotas de Hoffmann, fue vendido en esa época como una de esas drogas ya que contenía tanto alcohol. El éter tiende a ser difícil para consumir solo, y por lo tanto se mezcló a menudo con las drogas como el etanol para uso recreativo. También se puede utilizar como un inhalante.
