Célula madre
| Célula madre | ||
|---|---|---|
 Micrografía de células madre embrionarias de ratón teñidas con un marcador fluorescente verde. | ||
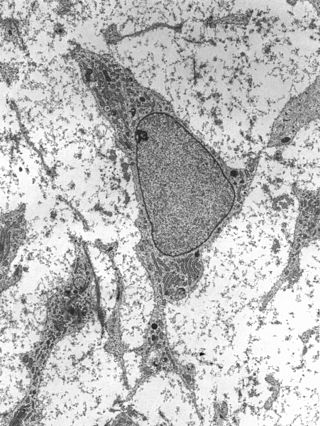 Micrografía de una célula madre de adulto que muestra características ultraestructurales típicas. | ||
| Nombre y clasificación | ||
| Latín | Cellula precursoria | |
| TH | H1.00.01.0.00028 | |
| TH | H1.00.01.0.00028 y H2.00.01.0.00001 | |
|
| ||
Las células madre son células que se encuentran en todos los organismos multicelulares[1] y que tienen la capacidad de dividirse (a través de la mitosis) y diferenciarse en diversos tipos de células especializadas, además de autorrenovarse para producir más células madre. En los mamíferos, existen diversos tipos de células madre que se pueden clasificar teniendo en cuenta su potencia,[2] es decir, el número de diferentes tipos celulares en los que puede diferenciarse.[3] En los organismos adultos, las células madre y las células progenitoras actúan en la regeneración o reparación de los tejidos del organismo.[4]
Generalidades
Las células madre –en inglés stem cells³ (donde stem significa tronco, traduciéndose a menudo como «células troncales»)– tienen la capacidad de dividirse asimétricamente dando lugar a dos células hijas, una de las cuales tiene las mismas propiedades que la célula madre original (autorrenovación) y la otra adquiere la capacidad de poder diferenciarse si las condiciones ambientales son adecuadas.[5] La mayoría de los tejidos de un organismo adulto poseen una población residente de células madre que permiten su renovación periódica o su regeneración cuando se produce algún daño tisular.[6] Algunas células madre adultas son capaces de diferenciarse en más de un tipo celular como las células madre mesenquimales y las células madre hematopoyéticas, mientras que otras son precursoras directas de las células del tejido en el que se encuentran, como por ejemplo las células madre de la piel, músculo o las células madre gonadales (células madre germinales).
Las células madre embrionarias son aquellas que forman parte de la masa celular interna de un embrión de 4-5 días de edad. Éstas son pluripotentes lo cual significa que pueden dar origen a las tres capas germinales: ectodermo, mesodermo y endodermo. Una característica fundamental de las células madre embrionarias es que pueden mantenerse (en el embrión o en determinadas condiciones de cultivo) de forma indefinida, formando al dividirse una célula idéntica a ellas mismas, y manteniendo una población estable de células madre. Existen técnicas experimentales donde se pueden obtener células madre embrionarias sin que esto implique la destrucción del embrión.
Tipos de células madre

Teniendo en cuenta su potencia,[2] las células madre pueden dividirse en cuatro tipos:[3]
- Las células madre totipotentes pueden crecer y formar un organismo completo, tanto los componentes embrionarios (como por ejemplo, las tres capas embrionarias, el linaje germinal y los tejidos que darán lugar al saco vitelino), como los extraembrionarios (como la placenta). Es decir, pueden formar todos los tipos celulares.[7][8] La célula madre totipotente por excelencia es el cigoto, formado cuando un óvulo es fecundado por un espermatozoide.
- Las células madre pluripotentes no pueden formar un organismo completo, pero sí cualquier otro tipo de célula correspondiente a los tres linajes embrionarios (endodermo, ectodermo y mesodermo). Pueden, por tanto, formar linajes celulares. Se encuentran en distintas etapas del desarrollo embrionario. Las células madre pluripotentes más estudiadas son las células madre embrionarias (en inglés embryonic stem cells o ES cells) que se pueden aislar de la masa celular interna del blastocisto. El blastocisto está formado por una capa externa denominada trofoblasto, formada por unas 70 células, y una masa celular interna constituida por unas 30 células que son las células madre embrionarias que tienen la capacidad de diferenciarse en todos los tipos celulares que aparecen en el organismo adulto, dando lugar a los tejidos y órganos. En la actualidad se utilizan como modelo para estudiar el desarrollo embrionario y para entender cuáles son los mecanismos y las señales que permiten a una célula pluripotente llegar a formar cualquier célula plenamente diferenciada del organismo.
- Las células madre germinales son células madre embrionarias pluripotentes que se derivan de los esbozos gonadales del embrión. Estos esbozos gonadales se encuentran en una zona específica del embrión denominada cresta gonadal, que dará lugar a los óvulos y espermatozoides. Tienen una capacidad de diferenciación similar a las de las células madre embrionarias, pero su aislamiento resulta más difícil.[9] Hoy se pueden manipular células humanas de adulto y generar células con pluripotencialidad inducida (iPS), que se ha visto poseen el mismo potencial de crecimiento y diferenciación de las células madre embrionarias, e irán sustituyendo o ampliando con creces las posibilidades biotecnológicas soñadas para las embrionarias. El compromiso de Shinya Yamanaka, diseñador de esta tecnología y ganador del premio nobel por su descubrimiento, en relación con su uso hacia otros fines, es un ejemplo de la ética y la responsabilidad del investigador y supone asumir que la ciencia triunfa al servicio del hombre. Las ventajas técnicas de las iPS son muchas, las más importantes son: no inducen rechazo inmunológico lo que abre la posibilidad de crear fármacos específicos para un paciente determinado; no requiere la utilización de óvulos humanos, la técnica es muy fácil de realizarse y su costo es reducido.[10][11]
- Las células madre multipotentes son aquellas que sólo pueden generar células de su misma capa o linaje de origen embrionario (por ejemplo: una célula madre mesenquimal de médula ósea, al tener naturaleza mesodérmica, dará origen a células de esa capa como miocitos, adipocitos u osteocitos, entre otras). Otro ejemplo son las células madre hematopoyéticas –células madre de la sangre que puede diferenciarse en los múltiples tipos celulares de la sangre–.
- Las células madre unipotentes, también llamadas células progenitoras son células madre que tiene la capacidad de diferenciarse en sólo un tipo de células.[12] Por ejemplo las células madre musculares, también denominadas células satélite sólo pueden diferenciarse en células musculares.
Además de por el criterio de potencia, las células madre también pueden clasificarse en cuanto a si se encuentran en el embrión o en tejidos adultos. Las células madre adultas se encuentran en tejidos y órganos adultos y que poseen la capacidad de diferenciarse para dar lugar a células adultas del tejido en el que se encuentran. En humanos, se conocen hasta ahora alrededor de 20 tipos distintos de células madre adultas, que son las encargadas de regenerar los tejidos en continuo desgaste (como la piel o la sangre) o tejidos que han sufrido un daño (como por ejemplo el hígado). En esta clasificación se incluyen células madre multipotentes, como las células madre hematopoyéticas de la médula ósea (encargadas de la formación de la sangre). En la misma médula ósea, aunque también en sangre del cordón umbilical, en sangre periférica y en la grasa corporal se ha encontrado otro tipo de células madre adultas, denominadas mesenquimales que puede diferenciarse en numerosos tipos de células de los tres derivados embrionarios (musculares, vasculares, nerviosas, hematopoyéticas, óseas, etc.).
Métodos de obtención de células madre
Existen diferentes técnicas para la obtención de células madre. Las células madre embrionarias y algunas células madre adultas pueden aislarse desde su localización original en embriones o tejidos y mantenerse en condiciones especiales de cultivo de manera más o menos indefinida. Las fuentes que se utilizan de manera rutinaria o que han empezado a postularse son:
- Embriones crioconservados: La criopreservación o crioconservación es un método que utiliza nitrógeno líquido (-196 °C) para detener todas las funciones celulares y así poderlas conservar durante años. Estos embriones son procedentes de los tratamientos de reproducción humana asistida, que cuando se fecundan más de los necesarios pueden ser donados por los pacientes que se someten a este tratamiento.[13] Estos embriones criopreservados en fase de blastocisto pueden conservarse durante cinco años, según lo reglamenta el R.D. 413/1996 [1].[14]
- Blastómeros individuales: Con esta técnica, probada primero en ratones y después en humanos, se consigue no destruir el embrión. Se utilizaron óvulos fecundados de ratón que se dejaron crecer hasta que tuviesen de 8 a 10 células. Una de estas células se extrae y se cultiva. Con esta técnica se ha logrado obtener dos líneas celulares estables que mostraban un cariotipo normal y presentaban marcadores característicos de pluripotencialidad. El embrión del que se obtiene esta célula es completamente viable por lo que se puede implantar en un útero y seguir un desarrollo normal.
- Partenogénesis: Este proceso reproductivo no se da en mamíferos. Sin embargo, la partenogénesis puede ser inducida en mamíferos mediante métodos químicos o físicos in vitro. Como resultado de esta activación, se obtiene una masa celular denominada partenote de las que se pueden aislar células madre pluripotentes. Esta técnica sólo es aplicable en mujeres.[15]
- Obtención a base de donantes cadavéricos: Recientes investigaciones han descrito que las [células madre musculares] sobreviven y mantienen sus propiedades tras un proceso de congelación post-mortem.[16][17]
Reprogramación de células somáticas
Además de la expansión de células madre obtenidas del organismo, se han desarrollado técnicas para reprogramar células somáticas y convertirlas en células madre pluripotentes.[18]
- Reprogramación de células somáticas por transferencia o trasplante nuclear. Consiste en extraer un núcleo de un óvulo no fertilizado y sustituirlos por el núcleo de una célula somática adulta. Al encontrarse en un ambiente propicio, el citoplasma del óvulo, este núcleo es capaz de reprogramarse. Una ventaja de esta técnica (en sus aplicaciones biomédicas) es obtener células madre que contengan la misma dotación genética que el paciente y evitar así problemas de rechazo. Esta técnica se ha realizado con éxito en múltiples especies animales, no en humanos.[18] Este método se ha utilizado con éxito para lo que se conoce como clonación terapéutica.
- Fusión de células somáticas y células madre embrionarias. Los híbridos entre diversas células somáticas y células madre embrionarias comparten muchas características con las células madre, lo que indica que el fenotipo pluripotente es dominante en los productos resultantes de la fusión. Este tipo de células híbridas, también llamadas heterocariontes son valiosas para el estudio de los mecanismos genéticos y bioquímicos implicados en la pluripotencia.[18]
- Reprogramación por factores de transcripción definidos o Células madre pluripotentes inducidas. En el año 2006 el grupo del doctor Shin'ya Yamanaka, de la Universidad de Kyoto, demostró que es posible reprogramar células somáticas adultas hasta células madre mediante la expresión ectópica de factores de transcripción, generando las denominadas células madre pluripotentes inducidas o células iPS ( de induced pluripotent stem cells en inglés). En el protocolo original, se reprogramaron con éxito fibroblastos embrionarios de ratón (MEFs) y fibroblastos adultos tras infección con retrovirus que codificaban para los factores de transcripción Oct4, Sox2, c-myc y Klf4.[18][19]
Células madre del cordón umbilical
Del cordón umbilical se puede aislar una población de células madre multipotentes que poseen características embrionarias (expresan los factores de transcripción OCT-4 y Nanog) y hematopoyéticas (expresan el marcador de leucocitos CD45).[20] Estas células madre adultas pueden diferenciarse en células de la sangre y del sistema inmunológico.
Las células madre del cordón umbilical son relativamente fáciles de obtener y presentan una baja inmunogenicidad, debido a la baja expresión del complejo mayor de histocompatibilidad (MHC), por lo que se han comenzado a utilizar en terapias para curar diversas enfermedades:
- Enfermedades autoinmunes como el lupus.[21]
- Enfermedades hematológicas como la anemia de células falciformes.[22]
- Diabetes.[23]
Además, tienen numerosas ventajas: se pueden almacenar durante 15 años aproximadamente, pueden convertirse en cualquier tipo de célula, tienen un mayor grado de aceptación en familiares que las células de la médula, no tienen virus, se obtienen de manera sencilla sin provocar dilemas éticos y el número de células obtenidas es mayor que el de las extraídas de la médula.[cita requerida]
Células madre del líquido amniótico
Gracias a los últimos avances científicos se demostró que el líquido amniótico contiene células de tejidos embrionarios y extraembrionarios diferenciadas y no diferenciadas derivadas del ectodermo, del mesodermo y del endodermo. La tipología y las características de las células del líquido amniótico varían según el momento de la gestación y en función de la existencia de posibles patologías fetales. Recientemente, se ha tenido constancia de experimentos que demuestran la presencia de células madre fetales mesenquimales con potencial diferenciador hacia elementos celulares derivados de tres hojas embrionarias, por ejemplo. Las células madre de líquido amniótico se expanden fácilmente en cultivo, mantienen la estabilidad genética y se pueden inducir a la diferenciación (estudios de Paolo De Coppi, Antony Atala, Giuseppe Simoni, etc.) también en células hematopoyéticas. Por eso representan una nueva fuente de células que podría tener múltiples aplicaciones en ingeniería de los tejidos y en la terapia celular, sobre todo para el tratamiento de anomalías congénitas en el periodo perinatal.
Las células madre de líquido amniótico no presentan controversia ética[24] y pueden conservarse para uso propio.
Tratamientos con células madre
El científico japonés Shinya Yamanaka, galardonado con el Premio Nobel de Medicina de 2012, advirtió en declaraciones a los periodistas de los "enormes" riesgos de ciertas "terapias con células madre" que no han sido ensayadas y que están siendo ofrecidas en las clínicas y hospitales de un número creciente de países.[25]
Las células madre podrían tener multitud de usos clínicos y podrían ser empleadas en medicina regenerativa, inmunoterapia y terapia génica. De hecho en animales se han obtenido grandes éxitos con el empleo de células madre para tratar enfermedades hematológicas, diabetes de tipo 1, párkinson, destrucción neuronal e infartos. Pero aún en el 2012 no existían estudios concluyentes en humanos y la Agencia Española del Medicamento, dependiente del Ministerio de Sanidad, advirtió en octubre de 2012 sobre el riesgo de su uso indiscriminado.[26][27]
Algunos descubrimientos médicos permiten creer que los tratamientos con células madre pueden curar enfermedades y aliviar el dolor. Existen algunos tratamientos con células madre, pero la mayoría todavía se encuentran en una etapa experimental. Investigaciones médicas anticipan que un día con el uso de la tecnología, derivada de investigaciones para las células madre adultas y embrionarias, se podrá tratar el cáncer, diabetes, lesiones de la espina dorsal y daños en los músculos, entre otras enfermedades. Muchos tratamientos prometedores para enfermedades graves han sido aplicados usando células madre adultas. La ventaja de las células madre adultas sobre las embrionarias es que no hay problema en que sean rechazadas, porque normalmente las células madre son extraídas del paciente. Todavía existe un gran problema tanto científico como ético sobre esto.
En los últimos años se está investigando en la proliferación in vitro de las células madre de cordón umbilical para aumentar el número de células madre y cubrir la necesidad para un trasplante. Estos estudios son muy prometedores y pueden permitir en un futuro utilizar células madre de cordón umbilical en terapia génica: podemos así tratar enfermedades causadas por la deficiencia o defecto de un determinado gen. Introduciendo un determinado gen en la proliferación de las células madre in vitro y trasplantar tales células en el paciente receptor. El uso de otros tipos de células como portadores de genes buenos en pacientes con enfermedades causadas por deficiencias o déficits genéticos, se está experimentando clínicamente.
Tratamientos del cáncer
Recientemente han sido utilizadas las células madre encontradas en la sangre del cordón umbilical para tratar pacientes con cáncer. Durante la quimioterapia, la mayoría de las células en crecimiento mueren por los agentes cito tóxicos. El efecto secundario de la quimioterapia es lo que los trasplantes de células madre tratan de revertir; la sustancia que se encuentra sana dentro del hueso del paciente, el tuétano, es remplazada por aquellas perdidas en el tratamiento. En la mayoría de los tratamientos actuales que usan células madre, es preferible obtenerlas de un donante con el mismo tipo de sangre a usar las del paciente mismo. Solo si es necesario usar las propias células madre (siempre como último recurso y si no se encontró un donante con el mismo tipo de sangre) y si el paciente no tiene guardada su propia colección de células madre (sangre del cordón umbilical), entonces la sustancia contenedora en los huesos será removida antes de la quimioterapia, y reinyectada después.
Inmunohematología
El trasplante de células madre hematopoyéticas se ha usado desde hace 50 años con éxito para tratar múltiples enfermedades: talasemias, anemia de células falciformes, anemia de Fanconi, errores congénitos del metabolismo, anemia aplásica grave, inmunodeficiencias combinadas graves (SCID)... También han sido empleadas para el tratamiento de tumores: leucemias agudas mieloides y linfoides, leucemias crónicas mieloides, mielodisplasias, linfomas, mielomas, tumores sólidos de riños, mama, ovario y neuroblastoma, etc.
Esto se consigue mediante el trasplante de médula ósea. La médula ósea contiene las células madre precursoras de las células sanguíneas y linfáticas. Se solía sacar del hueso de la cadera, pero actualmente se está sacando de la sangre periférica tras tratamiento con factores estimulantes del crecimiento. El éxito del trasplante de médula, al igual que en cualquier otro trasplante, depende de la compatibilidad HLA. Pero además de poder producirse rechazo del individuo al tejido trasplantado, el trasplante de médula ósea presenta la particularidad de que también puede darse en sentido inverso, rechazo del tejido trasplantado al individuo (GVHD: graft versus host disease).
Sin embargo el rechazo GVHD puede presentar una ventaja y ser de interés como inmunoterapia, ya que puede reconocer a las células malignas con las que compite como extrañas y permitir una remisión más rápida de la leucemia.
Tras destruir la médula por radiación o quimioterapia se realiza el trasplante. A las dos semanas aparecen nuevas células sanguíneas y tras varios meses (autólogos) o más de un año (alotrasplantes) se restituye la función inmune.
También es posible el empleo de células madre de cordón con la misma finalidad.
Clonación
La clonación es el hecho de transferir el núcleo de una célula somática de un paciente a la célula sin núcleo de una donadora de óvulos. Ésta transferencia actuará como un óvulo fecundado y comenzará con el proceso de división de la célula. Esto obviamente traerá problemas en la sociedad puesto a que muchos ciudadanos piensan que no se debería "jugar a ser Dios" y crear un individuo exactamente igual a otro. Esto a su vez trae consigo diversos problemas genéticos a causa de hechos como, por ejemplo, que en las mitocondrias se encuentra el ADN de otro individuo. Se han hecho muchas investigaciones con la clonación. Sin embargo existen discrepancias en cuanto a ética y moral entre investigadores. La doctora Hwang fue una de ellas, ella donó sus óvulos para su investigación además de pedir a sus compañeras dentro de la investigación que también donaran. Esto trajo un problema ético, puesto que los investigadores no pueden recibir remuneración monetaria como ella así lo hizo, además un investigador no debe tener ningún éxito personal sino para toda la comunidad.[28]
Controversia sobre las células madre
El hecho de que estas células actualmente implican el uso de embriones humanos y de tejido cadavérico fetal conlleva un cuidadoso examen de las cuestiones éticas relacionados con el progreso de la investigación biomédica.[29] Contrariamente, las investigaciones médicas opinan que es necesario proceder con las investigaciones de las células madre embrionarias porque las tecnologías resultantes podrían tener un gran potencial médico, y que el exceso embrionario creado por la fertilización in vitro puede ser donado para las investigaciones. Esto en cambio, produjo conflictos con el movimiento Pro-Life (Pro-Vida), quienes adjudican la protección de embriones humanos. El constante debate ha hecho que autoridades de todo el mundo busquen regularidad en los trabajos y marquen el hecho de que las investigaciones de las células madre embrionarias representan un desafío ético y social.
De acuerdo con muchas religiones y sistemas éticos, la vida humana comienza en la fecundación. Según sus argumentos, cualquier medida intencional para detener el desarrollo después de la concepción se considera como la destrucción de una vida humana. Otros críticos no tienen un problema moral con la investigación con células madre humanas, pero tienen miedo de un precedente para la experimentación humana. Algunos críticos apoyan la idea de la investigación, pero quieren que se impongan estrictas normas legales que impidan la experimentación genética con humanos, como la clonación y que garanticen que los embriones humanos sólo se obtengan a través de fuentes apropiadas. Prevenir que la investigación con células madre humanas se convierta en una pendiente resbaladiza hacia experimentos genéticos humanos es considerado por la mayoría de la sociedad un punto importante en la controversia de las células madre humanas.
Dentro de la comunidad médica, existen diferentes posturas, entre ellas que “los blastocitos o embriones son organismos vivos que dentro de 9 meses serán seres humanos con derechos, por esto, no es ético el destruir el blastocito o embrión para obtener las células madre”,[30] mientras que otros consideran que en la edad temprana de un embrión lo que se tiene es un brote de células con su masa interna.
Además de los problemas éticos que conlleva la destrucción del blastocito, también se encuentra anti-ético el hecho de que se necesiten una cantidad alta de óvulos para la creación de embriones, que serán destruidos luego, y cómo se obtienen esos óvulos. La donante de óvulos es tratada primero con algunas drogas y hormonas para que ésta cree muchos óvulos que serán donados. Estas drogas pueden traer problemas de salud lo cual es anti-ético hacer daño a un paciente con conocimiento.
La finalidad natural, primaria y principal de la medicina y del progreso técnico-científico es la defensa y la protección de la vida humana. La ciencia tiene sentido en la medida que se ajusta a la ética natural salvaguardando la vida. Una ciencia sin la guía de los criterios éticos acaba revertiéndose en contra del ser humano, para cuyo servicio nació.[31]
Puntos de vista
Los debates han motivado al movimiento Pro-Life,[cita requerida] el cual se preocupa por los derechos y el estado de un embrión como un humano de temprana edad. Este movimiento cree que las investigaciones relacionadas con las células madre, instrumentaliza y viola lo que llaman la santidad de la vida y deberían ser consideradas como un asesinato. Las ideas fundamentales de aquellos que se oponen a estas investigaciones son la defensa de lo que llaman inviolabilidad de la vida humana y que la vida humana empezaría cuando un espermatozoide fertiliza un óvulo para formar una sola célula.
Una parte de las investigaciones usa embriones que fueron creados pero no usados en la fertilización in vitro para derivar una nueva línea de células madre. La mayoría de estos embriones tiende a ser destruida, o guardada por largos períodos, pasando su tiempo de vida. Solamente en Estados Unidos, se han estimado alrededor de 400.000 embriones en este estado.
Las investigaciones médicas señalan que las células madre tienen el potencial para alterar dramáticamente el acercamiento a la comprensión y tratamiento de enfermedades, y para aliviar sufrimiento. En el futuro, la mayoría de las investigaciones médicas anticipan el uso de tecnologías derivadas de las investigaciones de células madre para tratar varias. Heridas en la espina dorsal y el párkinson son dos ejemplos que han sido reconocidos por personas famosas (por ahora, Christopher Reeve y Michael J. Fox).
En agosto de 2000, el Instituto Nacional de Salud de Estados Unidos dijo:
"[...] Investigaciones sobre células madre pluripotentes [...] prometen nuevos tratamientos y posibles curas para muchas enfermedades y lesiones, como párkinson, diabetes, problemas del corazón, esclerosis múltiple, quemaduras y lesiones de la espina dorsal. La NIH cree que el potencial médico de las células madre pluripotentes beneficiarán las tecnologías médicas y serán compatibles con la ética”.
Recientemente, investigaciones de Advanced Cell Technology (Tecnología Celular Avanzada) en Woecester lograron obtener células madre de un ratón sin matar a los embriones. Si esta técnica se mejora será posible eliminar algunos de los problemas éticos relacionados con las investigaciones embrionarias de células madre.
En 2007 se descubrió otra técnica gracias a los equipos de investigaciones de Estados Unidos y Japón. Se reprogramaron las células de la piel humana para funcionar más como células embrionarias cuando se les introduce un virus. Extraer y clonar células madre es caro y complejo, pero el nuevo método de reprogramación es mucho más barato. Sin embargo, la técnica puede alterar el ADN de las nuevas células madre, causando cáncer de piel.
En 2007 se empezó a trabajar con células madre pluripotentes inducidas ("CPMI") mediante la manipulación de sólo cuatro genes; más tarde, se ha conseguido reducir el número a sólo dos de esos cuatro genes; e incluso, con sólo introducir en la célula las cuatro proteínas codificadas por los cuatro genes. El proceso consiste en extraer una célula del paciente a tratar, manipular dichos 4 o 2 genes o introducirle las cuatro proteínas codificadas por esos cuatro genes, cultivarlas e introducirlas en el paciente o provocar su diferenciación hacia el tipo celular que se necesite (uno o varios, ya que las células madre así creadas se comportan como células embrionarias). Aún no hay experiencia en seres humanos y está por resolver el pequeño pero cierto riesgo de tumores.
Políticas sobre células madre y clonación por países
La clonación terapéutica/embrionaria va muy de la mano con este tema. Sin embargo existen países que se oponen a ambas clonaciones o solo una o ninguna. También se oponen a la experimentación con células madre. Por ejemplo:
- Unión Europea: sí líneas celulares embrionarias, no clonación terapéutica.
- Estados Unidos: es legal la creación de líneas celulares pero sin fondos públicos. La legalidad de la clonación terapéutica depende del estado en que se encuentre. «A partir del 1 de agosto del 2001 no se utilizará fondos gubernamentales para las investigaciones de las células madre embrionarias; además que a partir de ese momento solo se utilizará las líneas celulares preexistentes antes del 1 de agosto de 2001», dijo Bush en una conferencia de prensa. A pesar de que Bush adoptó esta postura, no se opuso a que instituciones privadas experimentaran con células madre embrionarias. Es por esto que surgió la proposición 71 en noviembre de 2004 en California, que autoriza a crear el Institute for Regenerative Medicine en California por un periodo de diez años.[32]
- Reino Unido: Sí líneas celulares embrionarias. Sí a la clonación terapéutica.
- Suecia: Sí líneas celulares embrionarias. La clonación terapéutica es legal.
- Israel: legal líneas celulares embrionarias y la clonación terapéutica.
- China: legal líneas celulares embrionarias y la clonación terapéutica.
- Brasil: líneas celulares embrionarias legales de embriones creados por fertilización in-vitro con 3 años de edad/ No legal la clonación terapéutica.
- Corea del Sur: Sí líneas celulares embrionarias. Permitido con autorización del Ministro de salud del país.
- Singapur: líneas celulares embrionarias legal si el blastocito es destruido 14 días después de la fecundación. Es legal la clonación terapéutica.
- Australia: Sí líneas celulares embrionarias, no es legal la clonación terapéutica.
Véase también
Referencias
- ↑ «Plant and animal stem cells: conceptually similar, molecularly distinct?» Sablowski R. Trends Cell Biol. 2004 Nov;14(11):605-11.
- ↑ a b Hans R. Schöler (2007). «The Potential of Stem Cells: An Inventory». En Nikolaus Knoepffler, Dagmar Schipanski, and Stefan Lorenz Sorgner, ed. Humanbiotechnology as Social Challenge. Ashgate Publishing, Ltd. p. 28. ISBN 978-0-7546-5755-2.
- ↑ a b «What Are Stem Cells and Where Do They Come From?» Lori P. Knowles. Stem Cell School. Error en la cita: Etiqueta
<ref>no válida; el nombre «Knowles» está definido varias veces con contenidos diferentes - ↑ «Stem Cell Basics en el NIH.» (en inglés).
- ↑ «Asymmetric Stem Cell Division: Precision for Robustness.» Inaba M, Yamashita YM. Cell Stem Cell. 2012 Oct 5;11(4):461-9.
- ↑ «How important are adult stem cells for tissue maintenance?» Dor Y, Melton DA. Cell Cycle. 2004 Sep;3(9):1104-6.
- ↑ «Totipotency, Pluripotency and Nuclear Reprogramming.» Mitalipov S, Wolf D. Adv Biochem Eng Biotechnol. 2009;114:185-99.
- ↑ Pluripotency and cellular reprogramming: facts, hypotheses, unresolved issues. Hanna JH, Saha K, Jaenisch R. Cell. 2010 Nov 12;143(4):508-25.
- ↑ The germ cell--the mother of all stem cells. Donovan PJ. Int J Dev Biol. 1998;42(7):1043-50.
- ↑ “TheNobel Prize in Physiology or Medicine 2012”. Nobelprize.org.5 Dec 2012. Caulfield,T. & Rachul, C. (2012).
- ↑ Science Spin: iPS Cell Research in the News. Clinical Pharmacology &Therapeutics, 89, 644-646 (May 2011) | doi:10.1038/clpt.2010.309
- ↑ A family business: stem cell progeny join the niche to regulate homeostasis Hsu YC, Fuchs E. Nat Rev Mol Cell Biol. 2012 Jan 23;13(2):103-14.
- ↑ Iriberri, Ainhoa. «Utilizar embriones congelados es mejor que usar los frescos en la fecundación in vitro.» El Mundo. 5 de julio de 2012
- ↑ «Congelación de embriones y transferencia de embriones congelados.» Instituto Bernabeu de Medicina Reproductiva.
- ↑ Patient-Specific Stem Cell Lines Derived from Human Parthenogenetic Blastocysts Revazova ES, Turovets NA, Kochetkova OD, Kindarova LB, Kuzmichev LN, Janus JD, Pryzhkova MV. Cloning Stem Cells. 2007 Fall;9(3):432-49.
- ↑ «Skeletal muscle stem cells adopt a dormant cell state post mortem and retain regenerative capacity.» Latil M, Rocheteau P, Châtre L, Sanulli S, Mémet S, Ricchetti M, Tajbakhsh S, Chrétien F. Nat Commun. 2012 Jun 12;3:903.
- ↑ «Could dead bodies soon be harvested for their stem cells? Scientists find 'miracle' cells stay alive for 17 days in corpses.» Mail Online. 13 /05/12.
- ↑ a b c d Stem cells, the molecular circuitry of pluripotency and nuclear reprogramming. Jaenisch R, Young R. Cell. 2008 Feb 22;132(4):567-82. Error en la cita: Etiqueta
<ref>no válida; el nombre «Jaenisch» está definido varias veces con contenidos diferentes - ↑ Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Takahashi K, Yamanaka S. Cell. 2006 Aug 25;126(4):663-76.
- ↑ Kurtzberg, J.; Drapkin Lyerly, A.; Sugarman, J., Untying the Gordian knot: policies, practices, and ethical issues related to banking of umbilical cord blood, The Journal of clinical investigation: October 2005, volume 115, number 10
- ↑ Sun y col. [http://onlinelibrary.wiley.com/doi/10.1002/art.27548/abstract;jsessionid=A041219290709CF639357C691CEA8E6D.d03t04 Umbilical cord mesenchymal stem cell transplantation in severe and refractory systemic lupus erythematosus.] Arthritis Rheum. 2010 Aug;62(8):2467-75.
- ↑ Grewal SS y col. Successful hematopoietic stem cell transplantation for Fanconi anemia from an unaffected HLA-genotype-identical sibling selected using preimplantation genetic diagnosis. Blood. 2004 Feb 1;103(3):1147-51.
- ↑ Reversal of type 1 diabetes via islet β cell regeneration following immune modulation by cord blood-derived multipotent stem cells. Zhao y col. BMC Med. 2012 Jan 10;10:3.
- ↑ Células madre y líquido amniótico: un «descubrimiento reconfortante y seguro».
- ↑ Yamanaka alerta contra ciertas 'terapias con células madre' no ensayadas Publicado en elmundo.es el miércoles 10 de octubre de 2012. Consultado el 21 de octubre de 2012.
- ↑ Sanidad alerta del uso indiscriminado de las 'células madre' como reclamo. Publicado en elmundo.es el 22 de octubre de 2012. Consultado el 22 de octubre de 2012
- ↑ La Agencia Española de Medicamentos y Productos Sanitarios advierte sobre la posible confusión en la oferta de tratamientos con células madre . Nota informativa publicada el 22 de octubre de 2012.
- ↑ Whittaker, Peter A. (2005). Therapeutic cloning: the ethical limits Science Direct
- ↑ Nuffield Council on Bioethics. (2000). Stem Cell Therapy: the ethical issues. London WC1B3EG, 2000.
- ↑ 1. Godawa, B.(director/escritor) Lines that Divide: The Great stem cell debate [cinta cinematográfica] United States: Boulevard Pictures
- ↑ German National Ethics Council. (2004). Cloning for reproductive purposes and cloning for the purposes of biomedical research. Berlin, Germany. Sept 13, 2004.
- ↑ Rennie, J.; Barber, L. (2005) The future of stem cells. Financial Times & Scientific American Report, pg. 24
Bibliografía
- Nombela, César (2007). Células madre, encrucijadas biológicas para la Medicina. Madrid: Edaf. ISBN 978-84-414-1823-3.
- Roberto Germán Zurriaráin (Coord.) (2009). Células madre. Ciencia, Ética y Derecho. EIUNSA. ISBN 84-8469-252-3.
Enlaces externos
- International Society for Stem Cell Research (ISSCR)
- La madre de todas las células, células madre en el Museo Virtual sobre Genética y ADN "Leyendo el libro de la vida".
- Genoma España Medicina Regenerativa y Terapia Celular. Informe de Vigilancia Tecnológica
- Estudios con la celulas madre
