Diferencia entre revisiones de «Agujero de la capa de ozono»
Revertir a la revisión 26067670 |
|||
| Línea 60: | Línea 60: | ||
Otro grupo de compuestos que pueden destruir el ozono de la estratosfera son los [[óxidos de nitrógeno]] (representados como <math>NO_X</math>), como NO, <math>NO_2</math>, <math>N_2O</math> y <math>N_2O_5</math>. Estos compuestos provienen de los gases expulsados por los [[avión supersónico|aviones supersónicos]] que vuelan a gran altura, así como por procesos naturales y por otros procesos hechos por el hombre en la Tierra. La radiación solar descompone una cantidad considerable de otros óxidos de nitrógeno en óxido nítrico (NO), que también actúa como catalizador en la destrucción del ozono. El <math>NO_2</math> es el intermediario, pero también puede reaccionar con el monóxido de cloro, formando nitrato de cloro (<math>ClONO_2</math>). Este último es más o menos estable y sirve como “depósito de cloro”, otro factor que también contribuye a la destrucción del ozono estratosférico en los polos norte y sur. |
Otro grupo de compuestos que pueden destruir el ozono de la estratosfera son los [[óxidos de nitrógeno]] (representados como <math>NO_X</math>), como NO, <math>NO_2</math>, <math>N_2O</math> y <math>N_2O_5</math>. Estos compuestos provienen de los gases expulsados por los [[avión supersónico|aviones supersónicos]] que vuelan a gran altura, así como por procesos naturales y por otros procesos hechos por el hombre en la Tierra. La radiación solar descompone una cantidad considerable de otros óxidos de nitrógeno en óxido nítrico (NO), que también actúa como catalizador en la destrucción del ozono. El <math>NO_2</math> es el intermediario, pero también puede reaccionar con el monóxido de cloro, formando nitrato de cloro (<math>ClONO_2</math>). Este último es más o menos estable y sirve como “depósito de cloro”, otro factor que también contribuye a la destrucción del ozono estratosférico en los polos norte y sur. |
||
=== Causas naturales y artificiales === |
|||
Existen estudios que sostienen que la influencia de las 7.500 toneladas de cloro provenientes de CFC que ascienden anualmente a la estratosfera es mínima frente a los 600.000.000 de toneladas de cloro y flúor (otro gas agresivo) en forma de sales que escapan de los océanos como [[aerosol]]es. |
|||
A estas cantidades de compuestos químicos de origen natural habría que sumarles los aportes de metilcloro por incendios de bosques y, por lo menos, otros 36.000.000 de toneladas anuales en forma de HCl proveniente de [[erupción volcánica|erupciones volcánicas]]. Se han observado correlaciones entre erupciones volcánicas fuertes y disminuciones temporarias en el tenor de ozono estratosférico y se considera probable que los volcanes de la Antártida tengan un efecto muy directo: uno solo de ellos, el [[Monte Erebus|Erebus]], expulsa cada año unas 15.000 toneladas de cloro y, algo menos de flúor, a muy poca distancia de la estratosfera antártica. Sin embargo, se sabe que la mayor parte de este cloro regresa a la Tierra arrastrado por las lluvias antes de salir de la troposfera. Tampoco hay acuerdo sobre estas cifras relativas, que dependen de las mediciones y del método de cálculo. |
A estas cantidades de compuestos químicos de origen natural habría que sumarles los aportes de metilcloro por incendios de bosques y, por lo menos, otros 36.000.000 de toneladas anuales en forma de HCl proveniente de [[erupción volcánica|erupciones volcánicas]]. Se han observado correlaciones entre erupciones volcánicas fuertes y disminuciones temporarias en el tenor de ozono estratosférico y se considera probable que los volcanes de la Antártida tengan un efecto muy directo: uno solo de ellos, el [[Monte Erebus|Erebus]], expulsa cada año unas 15.000 toneladas de cloro y, algo menos de flúor, a muy poca distancia de la estratosfera antártica. Sin embargo, se sabe que la mayor parte de este cloro regresa a la Tierra arrastrado por las lluvias antes de salir de la troposfera. Tampoco hay acuerdo sobre estas cifras relativas, que dependen de las mediciones y del método de cálculo. |
||
Revisión del 01:26 13 may 2009
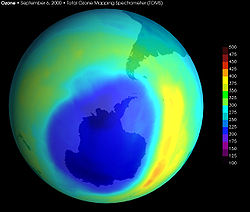
Se denomina agujero de ozono o agujero de la capa de ozono a la zona de la atmósfera terrestre donde se producen reducciones anormales de la capa de ozono, fenómeno anual observado durante la primavera en las regiones polares y que es seguido de una recuperación durante el verano. El contenido en ozono se mide en Unidades Dobson, kilogramos por Metro cúbico.
Sobre la Antártida la pérdida de ozono llega al 70%, mientras que sobre el Ártico llega al 30%. Este fenómeno fue descubierto y demostrado por Sir Gordon Dobson (G.M.B. Dobson) en 1960, que atribuyó a las condiciones meteorológicas extremas que sufre el continente Antártico.[1]
Sin embargo, un amplio sector científico achacó este fenómeno al aumento de la concentración de cloro y de bromo en la estratosfera debido tanto a las emisiones antropogénicas de compuestos clorofluorocarbonados (CFC) como del desinfectante de almácigos bromuro de metilo.
En 1995 el mexicano Mario J. Molina es el primer científico en sostener esta teoría, obteniendo el Premio Nobel de Química.
En septiembre de 1987 varios países firmaron el Protocolo de Montreal, en el que se comprometían a reducir a la mitad la producción de CFC´s en un periodo de 10 años. A pesar de estas medidas, el agujero de ozono continúa con su ciclo de aparición-desaparición, según la teoría inicial de Dobson.
Formación y equilibrio de la capa de ozono
Casi el 99% de la radiación ultravioleta del Sol que alcanza la estratosfera se convierte en calor mediante una reacción química que continuamente recicla moléculas de ozono (). Cuando la radiación ultravioleta impacta en una molécula de ozono, la energía escinde a la molécula en átomos de oxígeno altamente reactivos; casi de inmediato, estos átomos se recombinan formando ozono una vez más y liberando energía en forma de calor.
- La formación de ozono se inicia con la fotólisis (ruptura de enlaces químicos por la energía radiante) del oxígeno molecular por la radiación solar de una longitud de onda menor de 240 nm:
- El ozono por sí mismo absorbe luz UV de entre 200 y 300 nm:
- Los átomos de oxígeno, al ser muy reactivos, se combinan con las moléculas de oxígeno para formar ozono:
donde M es cualquier sustancia inerte, como por ejemplo el . El papel que tiene M en esta reacción exotérmica es absorber parte del exceso de energía liberada y prevenir la descomposición espontánea de la molécula de . La energía que no absorbe M es liberada en forma de calor. Cuando las moléculas de M regresan por sí mismas al estado basal, liberan más calor al entorno.
A pesar de que todo el ozono atmosférico en CNPT sería una capa de sólo unos 3 mm. de grosor, su concentración es suficiente para absorber la radiación solar de longitud de onda de 200 a 300 nm. Así, la capa de ozono funciona como un escudo que nos protege de la radiación UV.
La formación y destrucción del ozono por procesos naturales es un equilibrio dinámico que mantiene constante su concentración en la estratosfera. Se han registrado amplias variaciones interanuales y estacionales en todas las regiones del planeta en la densidad del ozono estratosférico; se verificó que en el hemisferio austral la concentración pasa por un mínimo en primavera y luego se regenera.
Causas de la disminución de ozono en la estratosfera
Investigaciones posteriores acerca de las variaciones en la densidad del ozono y sus causas generaron temores sobre el futuro de la capa de ozono: entre otras cosas, se descubrieron “agujeros” en la capa sobre los dos polos del planeta y un adelgazamiento de la capa alrededor de todo el globo.
Clorofluorocarbonos
Desde mediados de los años 1970, los científicos se han preocupado por los efectos nocivos de ciertos clorofluorocarbonos (CFC) en la capa de ozono. Los CFC, que se conocen con el nombre comercial de freones, se sintetizaron por primera vez en los años 30. Los más comunes son (freón 11), (freón 12), (freón 113) y (freón 114).
Como estos compuestos se licúan con facilidad, y son más o menos inertes, no tóxicos, no combustibles y volátiles, se han utilizado como refrigerantes para acondicionadores de aire y refrigeradores, en lugar del amoníaco () y del dióxido de azufre () líquido, que son muy tóxicos. Los CFC se utilizan en grandes cantidades para fabricar productos desechables, como vasos y platos, propelentes para aerosoles en lata, y disolventes para limpiar tarjetas de circuitos electrónicos. La mayor parte de los CFC que se usan en el comercio y la industria se arrojan a la atmósfera.
Como son poco reactivos, los CFC se difunden con lentitud (tardan años) hacia la estratosfera sin sufrir cambios; ahí se descomponen por la radiación UV de longitudes de onda de 175 a 220 nm:
- (freón 11)
- (freón 12)
Los átomos de cloro son muy reactivos y experimentan las siguientes reacciones:
El resultado global es la eliminación neta de una molécula de O3 de la estratosfera:
Los átomos de oxígeno de esta reacción los aporta la descomposición fotoquímica del oxígeno molecular y del ozono. Se debe notar que el átomo de Cl funciona como catalizador en el mecanismo de la reacción, y, como no se utiliza, puede participar en muchas reacciones de este tipo, pudiendo destruir más de 100.000 moléculas de antes de ser eliminado por alguna otra reacción. La especie ClO es un intermediario porque se produce en el primer paso elemental y se consume en el segundo paso. Este mecanismo de destrucción de se ha comprobado por la detección del monóxido de cloro en la estratosfera en años recientes. La concentración de disminuye en las regiones que tienen más cantidad de ClO.
Óxidos de nitrógeno
Otro grupo de compuestos que pueden destruir el ozono de la estratosfera son los óxidos de nitrógeno (representados como ), como NO, , y . Estos compuestos provienen de los gases expulsados por los aviones supersónicos que vuelan a gran altura, así como por procesos naturales y por otros procesos hechos por el hombre en la Tierra. La radiación solar descompone una cantidad considerable de otros óxidos de nitrógeno en óxido nítrico (NO), que también actúa como catalizador en la destrucción del ozono. El es el intermediario, pero también puede reaccionar con el monóxido de cloro, formando nitrato de cloro (). Este último es más o menos estable y sirve como “depósito de cloro”, otro factor que también contribuye a la destrucción del ozono estratosférico en los polos norte y sur.
A estas cantidades de compuestos químicos de origen natural habría que sumarles los aportes de metilcloro por incendios de bosques y, por lo menos, otros 36.000.000 de toneladas anuales en forma de HCl proveniente de erupciones volcánicas. Se han observado correlaciones entre erupciones volcánicas fuertes y disminuciones temporarias en el tenor de ozono estratosférico y se considera probable que los volcanes de la Antártida tengan un efecto muy directo: uno solo de ellos, el Erebus, expulsa cada año unas 15.000 toneladas de cloro y, algo menos de flúor, a muy poca distancia de la estratosfera antártica. Sin embargo, se sabe que la mayor parte de este cloro regresa a la Tierra arrastrado por las lluvias antes de salir de la troposfera. Tampoco hay acuerdo sobre estas cifras relativas, que dependen de las mediciones y del método de cálculo.
Otro factor natural que influye en la velocidad de reconstitución de la capa de ozono es la variación de la actividad solar, ya que cuando hay mayor irradiación ultravioleta se genera más ozono, pero también más óxidos de nitrógeno que deprimen el tenor de ozono. Los orígenes de la incertidumbre acerca de los factores que afectan la capa de ozono son, como se ve, muy diversos.
Agujeros en la capa de ozono
A mediados de los años 1980 se empezó a acumular pruebas de que a finales del invierno se había formado un “agujero” en la capa de ozono del Polo sur, donde el ozono se había reducido en casi 50%. Durante el invierno, en la estratosfera se forma una corriente de aire que rodea a la Antártida y que se conoce como “torbellino polar” o vortex. El aire que queda atrapado en este torbellino se vuelve extremadamente frío durante la noche polar, lo cual favorece la formación de partículas de hielo denominadas nubes polares estratosféricas. Estas nubes actúan como un catalizador heterogéneo al proporcionar una superficie para las reacciones en las que el HCl de la Tierra y el nitrato de cloro se convierten en moléculas de cloro reactivas:
Al comienzo de la primavera, la luz solar separa al cloro molecular en sus correspondientes átomos de cloro, que son los responsables de la destrucción del ozono.
La situación es menos grave en el Ártico porque en esta región más caliente el torbellino no dura tanto tiempo. El vortex sella la Antártida y evita las influencias en esta región del resto de la atmósfera. El aislamiento producido por el vortex impide que el aire más cálido y rico en ozono existente alrededor de la Antártida, proveniente de los trópicos, fluya hacia el polo, lo que ayudaría a reemplazar el ozono destruido y elevar las temperaturas en este continente. En cambio el aire rico en ozono, que es llevado hacia el polo por las ondas planetarias, se junta al borde del vortex, formando un "anillo" de aire con altas concentraciones de ozono que puede ser visto en las imágenes satelitales.
La NASA señaló que si no se hubiera firmado el tratado de Montreal, dos terceras partes de la capa habría sido destruido y el "agujero" de ozono hubiera sido destruido. El CFC habría aumentado la temperatura mundial en más de un grado centígrado. La radiación ultravioleta, que daña el ADN, hubiera aumentado seis veces. Apenas cinco minutos de de exposición al Sol habría causado quemaduras a la piel. Los niveles de rayos ultravioletas durante el verano hubieran aumentado hasta 30. Finalmente, las tormentas de verano del Hemisferio Norte hubieran sido mucho más poderosas. [1]
Actuaciones internacionales
En 1976 un informe de la Academia Nacional de Ciencias de Estados Unidos aportaba una evidencia científica sobre la disminución de ozono. A raíz de éste, unos cuantos países, incluidos Canadá, Suecia, Noruega y Estados Unidos tomaron las primeras iniciativas de eliminación de CFCs en las latas de aerosoles.
Aunque esto se concibió como un primer paso hacia una regulación más exhaustiva, los progresos posteriores se ralentizaron por factores políticos y la aparición de informes de la misma academia que indicaban que el primer informe había sobrestimado la disminución de la capa de ozono.
En 1985, 20 países, incluyendo los mayores productores de CFCs firmaron la convención de Viena, donde se establecía un marco para la negociación de regulaciones internacionales sobre sustancias que afectaran a la capa de ozono. Ese mismo año se anunció el descubrimiento del agujero de ozono en la Antártida, lo que atrajo la atención del gran público sobre el tema.
En 1987, representantes de 43 naciones firmaron el Protocolo de Montreal. Se comprometieron a mantener los niveles de producción de CFCs de 1986, y a reducirlos en un 50% en 1999. Pero al irse acumulando más evidencia científica sobre el origen humano de la disminución del ozono, se hizo necesario un nuevo acuerdo, que se firmó en 1990 en Londres. Los participantes se comprometían a eliminar totalmente los CFCs en el año 2000. Sólo se permitía un pequeño porcentaje marcado como de uso esencial, como los inhaladores para casos de asma. Una nueva reunión en 1992 en Copenhague adelantó la fecha de eliminación al año 1996.
En gran proporción los CFCs fueron sustituidos por HCFCs. Estos últimos no suponen una amenaza para la capa de ozono, pero sí son gases que potencian el efecto invernadero.
Como propuesta curiosa, en 1989 el físico italiano Antonino Zichichi llegó a proponer lanzar misiles repletos de ozono para tapar el agujero de la Antártida.
Aunque las medidas asociadas al protocolo de Montreal han reducido las emisiones de CFCs, el efecto de esta reducción sobre el agujero de ozono aún no es estadísticamente significativo. Un trabajo de Newman et al en 2006 preveía que la recuperación total no se produjese hasta el año 2050, y que una recuperación parcial estadísticamente detectable no se daría hasta el año 2024.[2]
Hay una incertidumbre relativa a estos resultados: proviene del calentamiento global causado por el CO2, que al calentar la estratosfera podría conducir a un incremento de la disminución de la capa de ozono y de la frecuencia de aparición de agujeros.
Conceptos erróneos sobre el agujero de ozono
- La capa de ozono no es un objeto real
- El concepto de "capa de ozono" quiere decir en realidad "zona donde el ozono es más abundante de lo normal", pero no es en sí misma un objeto real. Por lo tanto, el agujero tampoco existe realmente, sólo es una zona donde la concentración de ozono es menor de lo normal.
- Los CFCs son demasiado pesados para llegar a la estratosfera
- En los primeros 80 kilómetros de la atmósfera terrestre la composición de los gases es prácticamente invariable con la altura, con la excepción hecha del vapor de agua. A esta capa se la llama a veces, por este motivo, homosfera. Se ha citado a veces como ejemplo el radón, gas muy pesado y que no se observa en la estratosfera. Sin embargo, el radón es un gas radiactivo, con un periodo de semidesintegración de unos pocos días. Debido a esto, en unas pocas semanas el radón que se produce a ras de suelo ha desaparecido completamente y no le da tiempo a subir en cantidades importantes a la estratosfera. En el caso de los CFCs, como son estables, sí tienen ese tiempo.
- Los países productores de CFCs están en el hemisferio norte, pero el agujero de ozono está en el hemisferio sur
- De igual modo que en el punto anterior, los CFCs se reparten de forma homogénea. El agujero de ozono es más notorio en la Antártida debido a temperaturas que se alcanzan allí, lo que permite la formación de nubes estratosféricas.
- Las fuentes naturales de cloro son mucho más importantes que las humanas
- El cloro producido por la naturaleza, fundamentalmente en los volcanes, se disuelve fácilmente en las nubes, por lo que llega a la estratosfera en pequeñas cantidades. En cambio los CFCs son químicamente inertes en la troposfera y no se disuelven en agua.
- La aparición del agujero de ozono se produce en invierno, cuando prácticamente no llega luz solar
- El ozono es una molécula inestable, en ausencia de luz solar no se genera pero sigue su destrucción, por lo que en invierno su concentración debe disminuir. Eso ya fue observado por G.M.B. Dobson en 1968. El proceso natural marca un incremento de la concentración de ozono en primavera, cuando los rayos del sol permiten su creación. Sin embargo, lo observado en la Antártida es que en primavera la destrucción se acelera, lo que no corresponde al proceso natural.
Referencias
- ↑ ttp://www.24horaslibre.com/tecnologia/1237560099.php
- ↑ Newman, P. A., Nash, E. R., Kawa, S. R., Montzka, S. A. and Schauffler, S. M (2006). «When will the Antarctic ozone hole recover?». Geophysical Research Letters 33: L12814. doi:10.1029/2005GL025232.
- Raymond Chang, Química, sexta edición (México, McGraw-Hill Interamericana Editores, 1999)






















