Fosforibosilformilglicinamidina ciclo-ligasa
| Fosforibosilformilglicinamidina ciclo-ligasa | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 6.3.3.1 | |||
| Número CAS | 9023-53-4 | |||
| Ortólogos | ||||
| Especies |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
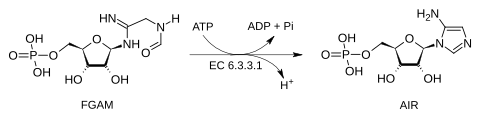
La AIR sintetasa es la quinta enzima que participa en la síntesis de novo de los nucleótidos de purina. Cataliza la reacción en la cual la 2-(formamido)-N1-(5-fosfo-β-D-ribosil)acetamidina (llamado también formilglicinamida-ribonucleótido, FGAM) se convierte en 5-amino-1-(5-fosfo-β-D-ribosil)imidazol (conocido también como 5-aminoimidazol ribonucleótido, AIR).
Esta reacción cierra sobre sí misma la cadena de FGAM para producir un anillo imidazol de cinco miembros, que luego formará el núcleo de las purinas. La AIR sintetasa cataliza la transferencia del oxígeno del grupo formilo hacia el fosfato inorgánico.
El mecanismo es secuencial, el ATP se une a la enzima en primer lugar y el ADP es el último en liberarse. La hidrólisis de ATP se utiliza para activar el oxígeno del grupo amida con el objeto de que el nitrógeno le efectúe un ataque nucleofílico. En los seres humanos, y en muchos otros organismos esta actividad catalítica está contenida dentro del polipéptido llamado proteína adenosina-3 biosintética de purina trifuncional.
Nomenclatura
[editar]El nombre sistemático de esta clase de enzimas es 2-(formamido)-N1-(5-fosforibosil)acetamidina ciclo-ligasa (formadora de ADP). Otros nombres de uso común pueden ser: AIR sintetasa, 5'-aminoimidazol ribonucleótido sintetasa, 2-(formamido)-1-N-(5-fosforibosil)acetamidina ciclo-ligase (formadora de ADP), fosforibosilaminoimidazol sintetasa, y fosforibosilformilglicinamidins ciclo-ligasa.
Síntesis de purinas
[editar]Las purinas son uno de los dos tipos de bases heterocíclicas nitrogenadas, las cuales a su vez, son uno de los tres componentes de los nucleótidos que forman los ácidos nucleicos. La síntesis de las purinas puede realizarse partiendo prácticamente desde cero de novo; o por medio de un mecanismo de reciclaje. La AIR sintetasa forma parte de la ruta de síntesis de novo. El primer paso de esta ruta metabólica comienza con fosforibosil pirofosfato (PRPP) y el producto final es inosina monofosfato (IMP). El IMP, eventualmente, termina siendo convertido en AMP o GMP. La estructura del anillo de purina se va componiendo por la adición sucesiva de uno o dos átomos a un extremo del anillo de ribosa. La vía de síntesis de novo se encuentra muy conservada en la mayoría de los organismos.
AIR sintetasa de caupí
[editar]La AIR sintetaza se encuentra tanto en mitocondrias como en plástidos; la forma mitocondrial posee 5 aminoácidos más que la forma plastídica.[1] En el caupí (Vigna unguiculata) la enzima se encuentra codificada por un único gen, a pesar del hecho de que existe en ambas formas, la plastídica y la mitocondrial. Esto sugiere que las diferentes versiones de la enzima pueden derivar de un único transcripto primario. Un estudio propone que allí se encuentra el estricto control del gen pur5, el gen que codifica para la AIR sintetasa.[2]
Referencias
[editar]- ↑ Goggin DE, Lipscombe R, Fedorova E, Millar AH, Mann A, Atkins CA, Smith PM (marzo de 2003). «Dual Intracellular Localization and Targeting of Aminoimidazole Ribonucleotide Synthetase in Cowpea». Plant Physiol. 131 (3): 1033-41. PMC 166869. PMID 12644656. doi:10.1104/pp.102.015081.
- ↑ Smith PM, Mann AJ, Goggin DE, Atkins CA (abril de 1998). «AIR synthetase in cowpea nodules: a single gene product targeted to two organelles?». Plant Mol. Biol. 36 (6): 811-20. PMID 9520274. doi:10.1023/A:1005969830314.
Lecturas adicionales
[editar]- Levenberg B, Buchanan JM (1957). «Biosynthesis of the purines. XII. Structure, enzymatic synthesis, and metabolism of 5-amino-imidazole ribotide». J. Biol. Chem. 224 (2): 1005-18. PMID 13405929.
- Levenberg B, Buchanan JM (1957). «Biosynthesis of the purines. XIII. Structure, enzymatic synthesis, and metabolism of (alpha-N-formyl)-glycinamidine ribotide». J. Biol. Chem. 224 (2): 1019-27. PMID 13405930.
- Li C, Kappock TJ, Stubbe J, Weaver TM, Ealick SE (1999). «X-ray crystal structure of aminoimidazole ribonucleotide synthetase (PurM), from the Escherichia coli purine biosynthetic pathway at 2.5 A resolution». Structure 7 (9): 1155-66. PMID 10508786. doi:10.1016/S0969-2126(99)80182-8.
Enlaces externos
[editar]- MeSH: AIR+synthetase (en inglés)