Oxalato (química)
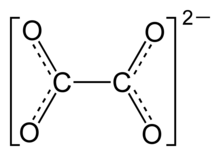
Los oxalatos son sales o ésteres del ácido oxálico. Las sales tienen en común el anión C2O42-, también escrito como (COO)22-, los ésteres tienen en común el esquema estructural R-O2CCO2-R'.
Propiedades
Se trata de sustancias habitualmente muy incoloras, reductoras y tóxicas; son tóxicas debido a que una vez absorbidas en el tubo digestivo se unen a los iones de calcio formando el oxalato de calcio, CaC2O4, una sal muy poco soluble. De esta manera, por una parte se elimina el calcio como elemento esencial del organismo, y por otra parte se cristaliza formando un cálculo que puede obstaculizar los conductos renales. Cuando esta sal se forma en el proceso digestivo (oxalato+calcio dietético) se elimina con las heces puesto que no es absorbible.
Las piedras renales también suelen estar formadas (al menos en parte) por oxalato cálcico. A los pacientes afectados de riñón se les recomienda una dieta pobre en oxalato (poco té, pocas espinacas o ruibarbo).
Frente a cationes polivalentes, el ion oxalato suele actuar como ligando quelante.
Su acumulación en ciertos órganos provoca la oxalosis.
Síntesis
Los oxalatos se forman por neutralización del ácido oxálico con la base correspondiente o por intercambio del catión. Así se puede obtener el oxalato potásico a partir del ácido oxálico y del hidróxido potásico:
HO2CCO2H + 2 KOH -> KO2CCO2K + 2 H2O
Los ésteres del ácido oxálico pueden obtenerse con las reacciones clásicas de esterificación a partir del ácido o del cloruro de oxalíl.
Usos
El oxalato potásico se encuentra en las formulaciones de algunos quitamanchas. Actúa complejando el hierro que puede estar presente.
El oxalato de hierro(III) (K3[Fe(O2CCO2])3 es una sustancia fotosensible. Expuesto a la luz, el hierro se reduce a hierro(II) y una parte del oxalato se oxida a dióxido de carbono (CO2). Los iones de hierro(II) reaccionan para formar hexacianoferrato (II) de potasio K4[Fe(CN)6] para dar un precipitado de azul de Prusia. Esta reacción fue utilizada en el pasado para hacer fotocopias. Actualmente ha sido sustituida por la xerotipia.
En la química analítica clásica se utiliza la reacción del oxalato con los iones de calcio para la determinación de estos.
Referencias
Enlaces externos
- Oxalato.com - Información sobre el oxalato
