Síntesis de Kiliani-Fischer
La síntesis de Kiliani-Fischer, nombrada así por los químicos Heinrich Kiliani y Hermann Emil Fischer, es un método para la síntesis de monosacáridos. Procede a través de la síntesis de hidrólisis de una cianhidrina del carbonilo de una aldosa, por la cual se alarga la cadena de carbono del carbohidrato precursor, conservándose así la estereoquímica en todos los carbonos quirales presentes anteriormente. El carbono quiral nuevo se produce con las dos estereoquímicas posibles, por lo que el producto de la síntesis de Fischer-Kiliani es una mezcla racémica de dos epímeros]. Por ejemplo, la D-arabinosa se convierte en una mezcla de D-glucosa y D-manosa.
Síntesis clásica de Kiliani–Fischer[editar]
La versión original de la síntesis de Kiliani-Fischer procede a través de la cianhidrina y la lactona aldónica intermedia del ácido. El primer paso consiste en hacer reaccionar el azúcar a partir de cianuro acuoso (por lo general NaCN); el cianuro se somete a la adición nucleofílica en el grupo carbonilo del azúcar (mientras que los azúcares tienden a existir sobre todo como un hemiacetal cíclico piranósico, siempre están en equilibrio químico con su apertura de cadena forma aldehído o cetona, y en el caso de estos aldosas es la forma aldehído la que reacciona en esta síntesis). La cianhidrina resultante de esta adición se calienta en agua, que hidroliza el cianuro en un grupo ácido carboxílico, que rápidamente reacciona con un grupo hidroxilo intramolecular para formar una lactona más estable. Ahora hay dos lactonas diastereoisoméricas en la mezcla de reacción. Se pueden separar separados por cromatografía o partición en diferentes solventes) y luego la lactona deseada se reduce con una amalgama de sodio. Como se ilustra a continuación, la D-arabinosa se convierte en una mezcla de D-glucononitrilo y D manononitrilo, que luego se convierten en D-gluconolactona y D-manonolactone, se separan, y se reducen a D-glucosa o D-manosa. El rendimiento químico por este método tiende a ser alrededor del 30%.
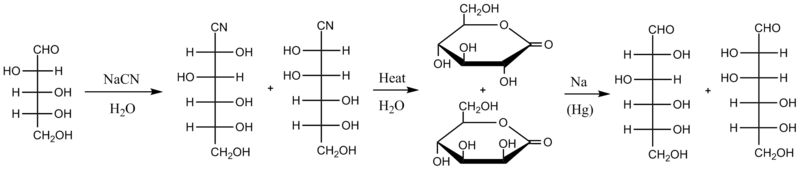
Modificaciones[editar]
Más recientemente, se ha desarrollado un método de reducción mejorado, el cual produce rendimientos más altos de los azúcares alargados. En lugar de la conversión de la cianhidrina a una lactona, la cianhidrina se reduce con hidrógeno,utilizando paladio sobre sulfato de bario como catalizador y agua como disolvente, para formar una imina. Debido a la presencia de agua, la imina rápidamente se hidroliza para formar un aldehído, por lo tanto que el extremo carbonílico de los azúcares se produce en solo dos pasos en lugar de tres. La separación de los isómeros se realiza en los productos del azúcar y no en las lactonas intermedias. Un catalizador especial es necesario para evitar una mayor reducción del grupo aldehído a un grupo hidroxilo, lo cual produciría un alditol. Estos catalizadores de hidrogenación que limitan a un solo paso se denominan venenos catalíticos; un ejemplo es el paladio Lindlar. Las reacciones que siguen ilustran este método mejorado para la conversión deL-treosa a la L-xilosa y L-lixosa.

Usos y limitaciones[editar]
Los dos enantiómeros del gliceraldehído están disponibles comercialmente, por lo que se puede acceder a cualquier estereoisómero de cualquier aldosa con cualquier longitud por un número adecuado de aplicaciones repetidas de la síntesis de Fischer-Kiliani. La triosa D-gliceraldehído (1) produce por reacción de Killiani-Fischer las tetrosas D-eritrosa (2a) y D-treosa (2b). Estas pueden producir las pentosas D-ribosa (3a), D-arabinosa (3b), D-xilosa (3c) y D-lixosa (3d). La siguiente iteración conduce a la hexosas D-alosa (4a), D-altrosa (4b), D-glucosa (4c), D-manosa (4d), D-gulosa (4e), D-idosa (4f), D-galactosa (4g) y D-talosa (4h). Las D-heptosas y otros azúcares de cadenas más largas están disponibles al seguirse la secuencia; la serie enantiomérica L está disponible al iniciar la secuencia con L-gliceraldehído.
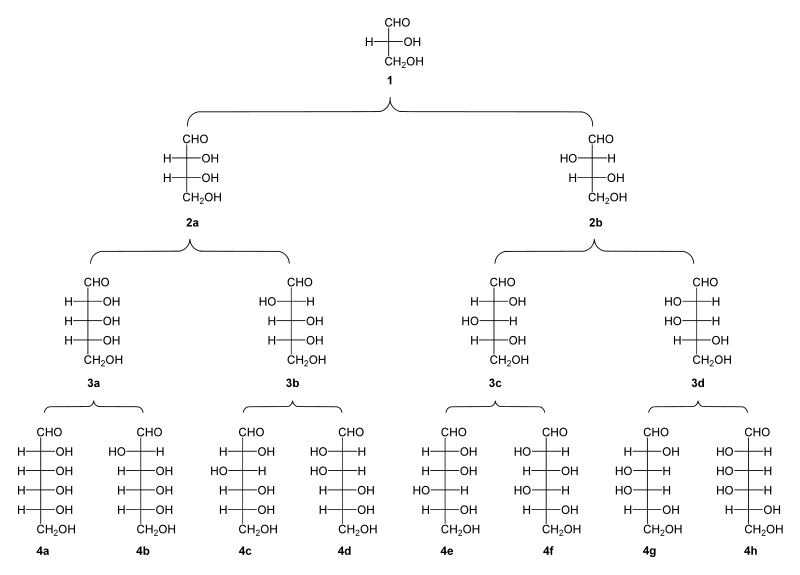
Las iteraciones sucesivas de la síntesis de Kiliani-Fischer permite el acceso a todos los diastereómeros de cualquier longitud de cadena para una estereoquímica específica absoluta de los reactivos iniciales. En la práctica, la síntesis de Kiliani-Fischer se utiliza generalmente para la producción de azúcares que son difíciles o imposibles de obtener de fuentes naturales. A pesar de que permite el acceso a todos los estereoisómeros posibles de cualquier aldosa deseada, el proceso tiene limitaciones por su bajo rendimiento y el uso de reactivos tóxicos. Además, el proceso requiere contar con un suministro de azúcares anteriores de la serie, lo cual puede requerir trabajo de síntesis sustancial si dichos azñucares no están fácilmente disponibles. Por ejemplo, si las sucesivas iteraciones de la síntesis de Kiliani-Fischer se utilizan, el rendimiento general cae aproximadamente en función exponencial para cada iteración adicional. El proceso que solo proporciona acceso directo a aldosas, mientras que algunos azúcares de interés pueden ser cetosas. Algunas cetosas pueden ser accesibles desde aldosas similares por isomerización a través de un intermediarios enodiólicos; por ejemplo, al agregar una base acuosa, la glucosa, fructosa y manosa se interconvierte, dado que comparten una forma enodiol. Algunos azúcares poco comunes son también accesibles a través de condensación aldólica.
Referencias[editar]
- Carey, Francis A. (2006). Organic Chemistry, Sixth Edition, New York, NY: McGraw-Hill. ISBN 0-07-111562-5.
