Retroalimentación planta-suelo
La retroalimentación planta-suelo es el proceso en el que una especie de planta altera los factores bióticos y abióticos del suelo en el que crece, lo que altera la aptitud del suelo para el establecimiento futuro y potencial de la propia especie en relación con otras.[1][2] Bajo esta premisa hay dos posibles escenarios. Una retroalimentación negativa entre planta y suelo se produce cuando especímenes de plantas son menos capaces de crecer en un suelo que anteriormente estaba ocupado por un miembro de la misma especie, mientras que una retroalimentación positiva se produce en el caso contrario, cuando las nuevas plantas tienen una mayor capacidad de crecer en un suelo anteriormente colonizado por sus pares conespecíficos.[2] Así, un efecto positivo puede afectar la diversidad de un ecosistema, mientras que un efecto negativo puede ayudar a la coexistencia de una comunidad.[2] El estudio de casos de retroalimentación planta-suelo tiene importantes aplicaciones en el entendimiento de las dinámicas de sucesiones ecológicas,[3][4][5] así como en la adaptabilidad y el control de especies invasoras, en cuyos procesos este fenómeno puede otorgar perspectivas nuevas para su abordaje.[6][7]
Factores y medición[editar]
- Factores
Las interacciones planta-suelo tienen un rol primordial en la articulación y el equilibrio de los sistemas naturales, de manera que los factores que inciden en esta interrelación son fundamentales para entender los procesos de retroalimentación entre ambas componentes, y las consecuencias de su variabilidad.[8] Si hemos de citar los factores directos que influyen en el intercambio de planta a suelo, se ha de considerar de este modo el sombreado de la planta y/o la exposición climática resultante en el suelo, por su influencia sobre condiciones que determinan la solarización del suelo, así como su temperatura o la retención de humedad, que luego son requeridos por la planta para sus procesos de alimentación y síntesis; también los aportes de biomasa y elementos químicos esenciales, que en su ciclo pasan a formar parte del ecosistema edáfico y que influyen en la fertilidad y/o la acidez del suelo, determinando las comunidades de microorganismos y plantas que habitarán la rizosfera a merced de los reacondicionamientos establecidos;[8] y, finalmente, la atracción de animales y el cambio de microorganismos en el suelo, que aparecen como factores indirectos de la planta al suelo, y en el cual se establecen relaciones interespecíficas en base a patogenicidad,[1] herbivorismo,[3] simbiosis,[5] mutualismo,[9] o alelopatía,[10] que pueden tener un efecto positivo o negativo a la retroalimentación en curso.[1][3][5][9][10]
- Medición
La retroalimentación planta-suelo se mide a través de una mixtura entre indicadores de vecindad,[8] pruebas por tipos de comunidad-suelo (intraespecífica o interespecífica, y dominancias propias o ajenas), e indicadores de crecimiento, desarrollo y estado de las plantas.[3] Un ejemplo es el coeficiente de interacción de (Bever et al, 1997). Este valor cuantifica cuánto está limitado el crecimiento de cada planta por su propia comunidad de suelo en comparación con cuánto limita a las demás.[2] Es para comparaciones entre dos especies. Para medir este valor, se debe sopesar el crecimiento de dos plantas, A ∩ B, tanto en el suelo condicionado por miembros de su propia especie, , como en el suelo condicionado por miembros de la otra especie, . Entonces, el coeficiente de interacción se calcula como:
Si es negativo, significa que ambas especies empeoran en su propio sitio en comparación con el suelo de su competidor, y por lo tanto, la retroalimentación planta-suelo ayuda a estas especies a coexistir.[2]
Ciclo de nutrientes[editar]
La retroalimentación planta-suelo se lleva a cabo por intermedio del ciclo de nutrientes entre ambos, el cual se realiza en dos fases: una primera etapa correspondiente a la transferencia de nutrientes en el suelo por parte de la planta, realizado a través de la hojarasca, en el cual se consigue una deposición de elementos esenciales a través de su descomposición;[11] seguido de una segunda fase donde los nutrientes insertos por la hojarasca en el suelo son químicamente procesados por la vida edáfica, hasta estar en condiciones de ser reabsorbidos de vuelta por la planta, completando así un ciclo completo con el reciclado de nutrientes.[12]
Los principales macronutrientes que son transferidos en este ciclo son el nitrógeno, el fósforo, el potasio, el calcio y el magnesio,[13][14][15][16][17] mientras, entre los microminerales se puede mencionar al cobre, el hierro, el manganeso y el zinc.[17] La hojarasca es la vía de entrada para la interconexión de nutrientes entre las plantas y el suelo, especialmente para el contenido de nitrógeno y fósforo que deposita en este último,[11] y que satisface a la vez el propio requerimiento que poseen las plantas de estos fertilizantes, puesto que más del 90% del nitrógeno y fósforo absorbidos por las plantas pueden llegar a provenir del reciclaje de nutrientes en el suelo.[18][19] Una vez en el suelo estos nutrientes pasan por un proceso de sucesivas transformaciones, en el cual se conjugan formas orgánicas a minerales, y de minerales a orgánicas de estos elementos.[20] Dependiendo del mineral tenemos lo siguiente:
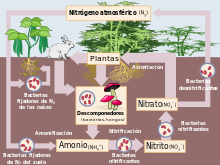
- Ciclo del nitrógeno: En el perfil de suelo el nitrógeno disuelto y parcialmente descompuesto de la hojarasca puede hallarse en forma de proteínas, aminoácidos, ácidos nucléicos y nucleótidos.[20][12] Los organismos descomponedores, usualmente bacterias y hongos, al metabolizar carbono desintegran estos compuestos hasta llevar al nitrógeno a un estado mineral, proceso llamado mineralización del nitrógeno.[20] Esta transformación puede realizarse en dos formas que son asimilables para las plantas.[20] La primera de ellas es una reorganización del nitrógeno excedente, que produce amoníaco NH3 e ion amonio NH4+, este último absorbible por las plantas.[12] A este proceso se le llama amonificación.[12] Seguidamente hay una etapa de nitrificación, en el que otros grupos bacterianos oxidan los dos compuestos anteriores, transformándolos primeramente en nitritos NO2-, y tras un subsecuente proceso de oxidación culminar en la forma de nitratos NO3- que es la segunda forma asimilable por las plantas.[12] De ambas sustancias, las plantas volverán a extraer su nitrógeno para componer proteínas, aminoácidos, ácidos nucléicos y nucleótidos, hasta una nueva senescencia y posterior caída en forma de hojarasca, cerrando el ciclo.[12]
- Ciclo del fósforo: El fósforo orgánico del suelo está conformado en buena medida por nucleoproteínas, fosfolípidos y fosfoazúcares procedentes de residuos vegetales proporcionados por la hojarasca.[21] La mineralización del fósforo por parte de bacterias adaptadas a su metabolización conduce, luego de una sucesión de transformaciones por parte de los microorganismos del suelo, a la generación de dos compuestos que son asimilables para su reabsorción de vuelta a la planta: de manera mayoritaria se compone ion fosfato diácido H2PO4-, y en menor medida ion fosfato monoácido H PO4-2.[22]
- Otras sustancias químicas: Mediante el proceso de descomposición biológica de la broza por microfauna, bacterias y hongos, se liberan adicionalmente CO2 y H2O, así como una sustancia orgánica relativamente resistente a la descomposición, llamada humus, que compone la mayor parte de la materia orgánica en horizontes más abajo en el perfil de suelo.[23] El potasio, el calcio y el magnesio orgánicos de la hojarasca, una vez incorporados a la dinámica bioquímica del suelo, deben tomar las formas de K+, ion Ca+2, e ion Mg+2 para su reabsorción por parte de las plantas.[22]
Tipos de retroalimentación planta-suelo[editar]
- Retroalimentación negativa

La retroalimentación negativa entre planta y suelo se produce cuando las plantas son menos capaces de crecer en el suelo que anteriormente estaba ocupado por un miembro de la misma especie.[2] Conforme a una recopilación de 45 estudios y 329 experimentos de retroalimentación planta-suelo, (Kulmatiski et al, 2008) constata la existencia de una tendencia proclive a una retroalimentación negativa antes que a una retroalimentación positiva para el caso de especies asociadas a biomas pastizales.[3] En específico, un 70% de los experimentos mostró una retroalimentación negativa, con una disminución del crecimiento en un 65% para aquellos casos negativos.[3]
Aunque originalmente se asumió que la retroalimentación planta-suelo negativa era causada por plantas que agotaban el suelo de nutrientes, también se ha sugerido que una causa importante de retroalimentación planta-suelo es la acumulación de patógenos transmitidos desde el suelo.[1] Se piensa que la retroalimentación negativa entre planta y suelo es un factor importante para ayudar a las plantas a coexistir.[2] Si una planta es demasiado abundante, los patógenos del suelo y otros factores negativos se volverán comunes, perjudicando su crecimiento. De manera similar, si una planta se vuelve demasiado rara, también lo serán sus patógenos del suelo y otros factores negativos, lo que ayudará a su crecimiento.[2] De este modo, la retroalimentación negativa ayuda a las poblaciones a permanecer en comunidad.[24] Esto es lo que se llama hipótesis de Janzen-Connell, y se cree que la retroalimentación negativa entre planta y suelo opera en un escenario similar.[24]
- Retroalimentación positiva

Una retroalimentación positiva se produce cuando las plantas tienen mayor capacidad de crecer en un suelo previamente poblado por un espécimen de su propia especie.[2] Este tipo de retroalimentación se ha verificado para interacciones bosque-suelo a través de la particularización de la hojarasca.[25] La composición de nutrientes de la hojarasca, así como sus modos de descomposición, determina diferentes tipos de suelo, en función de la utilidad para las especies emisoras o conductoras del deshoje, por lo general en favor del reclutamiento y/o la supervivencia de renovales de la propia especie versus la de otras especies.[8][26] En este proceso existe una alteración de la composición y estructura de las comunidades microbianas y fúngicas del suelo, las cuales dependen de la cubierta vegetal donde cae la hojarasca.[25] Al ser estas comunidades responsables de la mineralización de la materia orgánica, el efecto es un cambio en la fertilidad de esta comunidad, así como en la acidez del suelo, produciéndose un reacondicionamiento en la disponibilidad total de nutrientes, su estructura y dinámica, y repercutiendo en la adaptabilidad de las comunidades vegetacionales dependientes de la misma.[8] Potencialmente, este tipo de estrategias tienen la capacidad de alterar la composición específica de los ecosistemas forestales, e inducir una configuración determinada del sotobosque.[8]
En bosques templados y boreales, especies de coníferas con hojas reducidas en contenido de nutrientes, y cuya descomposición lenta genera un mínimo retorno mineral al sistema edáfico, son capaces de sostener suelos empobrecidos, al punto de favorecer la propagación del renoval de la especie, ya evolutivamente adaptado a estas condiciones, por sobre el renoval de otros tipos de especies.[27] En bosques caducifolios, en cambio, esta retroalimentación proviene de especies cuya hojarasca es más rica en nutrientes y más rápida en descomposición, lo cual propicia un suelo fértil, en cuyo entorno las plántulas de las especies involucradas tienen mayor capacidad de supervivencia.[28] También se ha documentado que estrategias alelopáticas a partir de hojarasca producen retroalimentaciones positivas en especies como Acacia dealbata,[29] o Eucalyptus sp,[30] que favorecen su propagación en entornos no nativos donde han sido introducidos.[29][30] De este modo, se constata que diferentes tipos de suelo, resultantes de estrategias dispares de hojarasca, han determinado modos variados de retroalimentación positiva para ciertas tipologías de especies arbóreas.[8]
Implicaciones[editar]
- En las dinámicas de sucesiones ecológicas
Se han propuesto dos teorías sobre el papel de la retroalimentación planta-suelo en el contexto de las sucesiones ecológicas.[3] (Van der Putten et al, 1993) sugirieron que la acumulación de enemigos fomenta el reemplazo de las especies, de manera que éstos, a través de una retroalimentación planta-suelo negativa, aceleran la sucesión en comunidades de sucesión temprana, mientras que en comunidades de sucesión tardía, una retroalimentación positiva promueve la persistencia de la comunidad.[4] Por su parte, (Reynolds et al, 2003), al contrario de la hipótesis de (Van der Putten et al, 1993), sugieren que la retroalimentación positiva es más común al principio de las sucesiones, dada la urgencia en formar relaciones simbióticas para asegurar un rápido crecimiento en condiciones de estrés, y que a medida que evoluciona a una fase tardía la retroalimentación se torna negativa, a expensas de la acumulación de patógenos.[5] En cualquier caso, la compresión determinista de este fenómeno sigue abierta, a falta de estudios más globales que den cuenta del panorama conducente sobre esta relación.[3]
- En la adaptabilidad de especies invasoras
La forma en que las especies alóctonas son capaces de invadir, propagarse y persistir en entornos distintos a sus orígenes, representa un punto de encuentro con las teorías de retroalimentación planta-suelo.[6] (Callaway & Aschehoug, 2000) hipotetizan que aquella rápida adaptabilidad tiene que ver con una falta de adaptación de los enemigos locales a la nueva especie, debido a que no ha existido previamente una historia evolutiva en común entre la especie invasora y los herbívoros y patógenos locales, mientras que de todas formas la especie se beneficia de la existencia de simbiontes, al ser éstos comúnmente generalistas.[10] Se señala que una retroalimentación planta-suelo menos negativa para la especie invasora que para las especies nativas puede llevar a la rápida colonización de la especie alóctona en zonas de hábitat de las especies originarias, al ser éstas competitivamente más vulnerables, y al punto de ser competitivamente excluidas,[2][31] lo cual, en última instancia, puede debilitar la resistencia o dificultar la recuperación de un ecosistema nativo, de manera que su entendimiento tiene importantes aplicaciones para un adecuado manejo de este tipo de situaciones.[7]
Referencias[editar]
- ↑ a b c d Bever, J. D. (1994). "Feeback between Plants and Their Soil Communities in an Old Field Community". Ecology 75 (7): 1965-1977. doi:10.2307/1941601 JSTOR 1941601.
- ↑ a b c d e f g h i j Bever, J. D.; Westover, K. M.; Antonovics, J. (1997). "Incorporating the Soil Community into Plant Population Dynamics: The Utility of the Feedback Approach". The Journal of Ecology. 85 (5): 561. doi:10.2307/2960528.
- ↑ a b c d e f g h i Kulmatiski, A.; Beard, K. H.; Stevens, J. R.; Cobbold, S. M. (2008). "Plant-soil feedbacks: a meta-analytical review". Ecology Letters. 11 (9): 980–992. doi:10.1111/j.1461-0248.2008.01209.x.
- ↑ a b Van der Putten, W.H., Van Dijk, C. & Peters, B.A.M. (1993). "Plant-specific soil-borne diseases contribute to succession in foredune communities". Nature, 362, 53–56. doi: 10.1038/362053a0.
- ↑ a b c d Reynolds, H.L., Packer, A., Bever, J.D. & Clay, K. (2003). "Grassroots ecology: plant–microbe–soil interactions as drivers of plant community structure and dynamics". Ecology 84: 2281–2291. doi: 10.1890/02-0298.
- ↑ a b Klironomos, John N. (2002). "Feedback with soil biota contributes to plant rarity and invasiveness in communities". Nature. 417 (6884): 67–70. doi:10.1038/417067a. PMID 11986666.
- ↑ a b S. Rodríguez-Echeverría (2009). "Organismos del suelo: la dimensión invisible de las invasiones por plantas no nativas. Ecosistemas 18 (2): 32-43.
- ↑ a b c d e f g T. Marañón-Arana, Cr. Aponte-Perales, I. M. Pérez-Ramos, B. Ibáñez-Moreno, M. T. Domínguez-Núñez, L. Ventura-García y L. Gómez-Aparicio (2012). "Interacciones árbol-suelo y funcionamiento del bosque mediterráneo". Cuadernos de la Sociedad Española de Ciencias Forestales 35:81-89. ISSN:1575-2410.
- ↑ a b Scott A. Mangan; Edward A. Herre; James D. Bever (2010). "Specificity between Neotropical tree seedlings and their fungal mutualists leads to plant–soil feedback". Ecology 91 (9): 2594-2603. doi:10.1890/09-0396.1.
- ↑ a b c Callaway, R.M. & Aschehoug, E.T. (2000). "Invasive plants versus their new and old neighbors: a mechanism for exotic invasion". Science, 290, 521–523. doi:10.1126/science.290.5491.521.
- ↑ a b Bunvong Thaiutsa; Orman Granger (1979). "El clima y la descomposición de la hojarasca en el bosque tropical Archivado el 11 de julio de 2020 en Wayback Machine.". Organización de las Naciones Unidas para la Agricultura y la Alimentación, Unasylva, 126 (31).
- ↑ a b c d e f g N. Iñón (2017): Ciclo del nitrógeno. Universidad Nacional de San Martín, Docencia de Bioquímica en Licenciatura de Biotecnología, año 2017. Consultado el 4 de julio de 2020.
- ↑ Finér L. (1996). Variation in the amount and quality of litterfall in a Pinus sylvestris L. stands growing on a bog. For. Ecol. Manage. 80:111. doi:10.1016/0378-1127(95)03652-0.
- ↑ Kavvadias V. A., D. Alifragis, A. Tsiontsis, G. Brofas, G. Stamatelos (2001). Litterfall, litter accumulation and litter decomposition rates in four forest ecosystems in northern Greece. For. Ecol. Manage. 144:113-127. doi:10.1016/S0378-1127(00)00365-0.
- ↑ González R. H., I. Cantú S., R. G. Ramírez L., M. V. Gómez M., T. G. Domínguez G., J. Bravo G., R. K. Maiti (2008). "Spatial and seasonal litterfall deposition pattern in the Tamaulipan thornscrub, Northeastern Mexico". Intern. J. Agric. Environ. Biotechnol. 1:177-181.
- ↑ Gutiérrez-Vázquez, M. H.; Méndez-González, J.; Flores-López, C.; Ramírez-Díaz, J. A.; & Gutiérrez-Vázquez, B. N. (2012). "Litterfall in Pinus greggii Engelm: And Pinus cembroides Zucc. plantations, in Coahuila, México". Revista fitotecnia mexicana, 35(2), 123-133.
- ↑ a b López-Hernández, J. M.; González-Rodríguez, H.; Ramírez-Lozano, R. G.; Cantú-Silva, I.; Gómez-Meza, M. V.; Pando-Moreno, M. & Estrada-Castillón, A. E. (2013). "Producción de hojarasca y retorno potencial de nutrientes en tres sitios del estado de Nuevo León, México". Polibotánica, (35), 41-64.
- ↑ A. Gallardo, F. Covelo, L. Morillas, M. Delgado (2009). "Ciclos de nutrientes y procesos edáficos en los ecosistemas terrestres: especificidades del caso mediterráneo y sus implicaciones para las relaciones suelo-planta". Ecosistemas 18 (2): 4-19.
- ↑ Chapin, F.S.; Matson, P.A.; Mooney, H.A. (2006). "Principles of terrestrial ecosystem ecology". Springer, Nueva York. 442 páginas.
- ↑ a b c d P.R. Solórzano-Peraza (2018): Mineralización e inmovilización de nitrógeno en el suelo. Red Agriculturers de Especialistas en Agricultura. Consultado el 4 de julio de 2020.
- ↑ Gueçaimburu, J.M.; Vázquez, J.M.; Tancredi, F.; Reposo, G.P., Rojo, V.; Martínez, M.; & Introcaso, R.M. (2019). "Evolución del fósforo disponible a distintos niveles de compactación por tráfico agrícola en un argiudol típico". Chilean journal of agricultural & animal sciences, 35(1), 81-89. doi:10.4067/S0719-38902019005000203.
- ↑ a b A.E. Pellegrini (2017). Macronutrientes del suelo: fósforo y potasio, calcio y magnesio. Facultad de Ciencias Agrarias y Forestales, Universidad Nacional de La Plata, año 2017. Consultado el 5 de julio de 2020.
- ↑ Schlesinger, W. H. (1997). "Biogeochemistry: An Analysis of Global Change". Academic Press. 108, 135, 152–158, 180–183, 191–194.
- ↑ a b Petermann, Jana S.; Fergus, Alexander J. F.; Turnbull, Lindsay A.; Schmid, Bernhard (2008). "Janzen-Connell effects are widespread and strong enough to maintain diversity in grasslands". Ecology. 89 (9): 2399–2406. doi:10.1890/07-2056.1.
- ↑ a b c Aponte-Perales, C. (2011). "Interacciones planta-suelo en un bosque mediterráneo". Ecosistemas 20(2-3): 95-100.
- ↑ Ehrenfeld, J.G.; Ravit, B. & Elgersma, K.; (2005). "Feedback in the plant-soil system". Annual Rev. Environ. Resour. 30: 75-115. doi: 10.1146/annurev.energy.30.050504.144212.
- ↑ Aerts, R. (1995). "The advantages of being evergreen". Trends in Ecology and Evolution 10:402-407. PMID 21237084.
- ↑ Hobbie, S. E. (1992). "Effects of plant species on nutrient cycling". Trends in Ecology and Evolution 7: 336-339. doi: 10.1016/0169-5347(92)90126-V PMID 21236058.
- ↑ a b P. Lorenzo & S. Rodríguez-Echeverría (2012). "Influence of soil microorganisms, allelopathy and soil origin on the establishment of the invasive Acacia dealbata". Plant Ecology & Diversity, volumen 5. doi: 10.1080/17550874.2012.713404.
- ↑ a b F. Tererai; M. Gaertner; S. M. Jacobs; D. M. Richardson (2013). "Eucalyptus invasions in riparian forests: Effects on native vegetation community diversity, stand structure and composition". Forest Ecology and Management, 297: 84-93. doi: 10.1016/j.foreco.2013.02.016.
- ↑ Bever, J. D. (2003). "Soil community feedback and the coexistence of competitors: conceptual frameworks and empirical tests". New Phytol., 157, 465–473. doi: 10.1046/j.1469-8137.2003.00714.x.
Enlaces externos[editar]
- Esta obra contiene una traducción parcial derivada de «Plant–soil feedback» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.





