Reducción del carbonilo

En química orgánica, la reducción de carbonilo es la reducción orgánica de cualquier grupo carbonilo por un agente reductor.
Los compuestos de carbonilo típicos son: cetonas, aldehídos, ácidos carboxílicos, ésteres y haluros de ácido. Los ácidos carboxílicos, los ésteres y los haluros de ácido pueden reducirse a aldehídos o un paso más adelante a alcoholes primarios, dependiendo de la fuerza del agente reductor; los aldehídos y las cetonas pueden reducirse respectivamente a alcoholes primarios y secundarios. En la desoxigenación, el alcohol puede reducirse y eliminarse por completo.
Los hidruros metálicos a base de boro y aluminio son agentes reductores comunes. La hidrogenación catalítica también es un método importante para reducir los carbonilos a escala industrial. Antes del descubrimiento de los reactivos de hidruro solubles, los ésteres se reducían mediante la técnica de Bouveault-Blanc, empleando una mezcla de sodio metálico en presencia de alcoholes.[1][2][3][4][5]
Derivados de ácidos carboxílicos, aldehídos, y cetonas a alcoholes[editar]
Reducción de hidruro[editar]
Mecanismo[editar]
El mecanismo de reacción para la reducción con un hidruro metálico se basa en la adición nucleofílica del anión hidruro al carbono carbonílico. En algunos casos, el catión de metal alcalino, especialmente Li+, activa el grupo carbonilo mediante la coordinación con el oxígeno del carbonilo, mejorando así la electrofilicidad del carbonilo.
Para las reducciones de derivados de ácido carboxílico, después de la reducción por un ion hidruro de aluminio, una reducción conduce al producto aldehído (que puede reducirse por segunda vez a un alcohol):

Para reducciones de aldehídos y cetonas, un ion de hidruro del aluminio reduce el compuesto de formar un alcóxido. Después de la reducción completa, el alcóxido se protona para dar el producto (alcohol):

Tendencias en la reactividad del carbonilo[editar]

Las cetonas son menos reactivas que los aldehídos, debido a los mayores efectos estéricos, y porque el grupo alquilo adicional puede donar densidad de electrones a la carga positiva parcial del enlace polar C = O.[6] Por lo tanto, los aldehídos se reducen más fácilmente que las cetonas y requieren reactivos más suaves y condiciones más suaves. Los ácidos y ésteres carboxílicos se estabilizan aún más por la presencia de un segundo átomo de oxígeno que puede donar un par solitario en el enlace C = O ya polar. Los haluros de acilo son los carbonilos menos estables, ya que los haluros son donantes de electrones pobres, así como grandes grupos salientes.[7]
El resultado de estas tendencias en la reactividad del carbonilo es que los halogenuros de acilo, las cetonas y los aldehídos suelen ser los compuestos que se reducen más fácilmente, mientras que los ácidos carboxílicos y sus ésteres requieren agentes reductores más fuertes.
Tendencias en reactividad de hidruro del metal[editar]
Cuatro factores principales contribuyen a la fuerza de los agentes reductores de hidruro metálico. Primero, la capacidad de los contra iones para activar los carbonilos depende de qué tan bien pueda coordinarse con el oxígeno del carbonilo. El litio es más pequeño y más electrofílico que el sodio, por lo que se coordina mucho más fuertemente y activa más el carbonilo.[8] Los metales que pueden tener múltiples cargas (como Mg, Al y Zn) forman cationes con alta densidad de carga y, por lo tanto, también son activadores más fuertes que Na+.[9]
Segundo, el metal central puede influir la fuerza de un agente de reducir. El aluminio es más grande que boro, así que se enlaza más débilmente a hidruros, los cuales son más libres de atacar; hidruros de aluminio son por tanto mejores reducers que borohydrides.[10] Un tercer factor, efectos estéricos, son lo que hace que ciertos hidruros sustituidos (hidruros en cuál o más los hidruros están reemplazados por sustituyentes) sean agentes reductores mucho más débiles que otros hidruros de metal: triacetoxiborohidruro de sodio (NaBH(OAc)3), como ejemplo, puede usarse para reducir aldehídos, y dejar las menos cetonas reactivas sin reaccionar.[11]
Finalmente, los sustituyentes pueden tener otros efectos sobre la reactividad de un agente reductor: los grupos acetoxi obstaculizan el poder reductor de NaBH(OAc)3 no solo a través del volumen estérico sino también porque son receptores de electrones. Los grupos nitrilo también impiden los agentes reductores, mientras que los grupos donadores de electrones, como los grupos alquilo, pueden mejorarlos, como el superhidruro (trietilborohidruro de litio), que es un nucleófilo lo suficientemente fuerte como para evitar reordenamientos no deseados durante la reducción.
Debido a estos efectos sustituyentes, el cianoborhidruro de sodio (NaBH3CN) es un reductor muy pobre a pH moderado (> 4), por lo que prefiere la aminación reductora a la reducción de carbonilo, como se muestra a continuación:
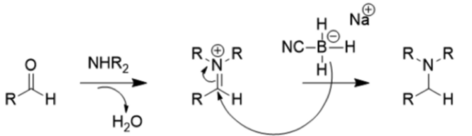
El reductor de borohidruro de sodio relativamente débil se usa típicamente para reducir cetonas y aldehídos porque, a diferencia del hidruro de litio y aluminio, tolera muchos grupos funcionales (grupo nitro, nitrilo, éster) y se puede usar con agua o etanol como solventes.[12] El hidruro de litio y aluminio y otros reductores fuertes como el hidruro de diisobutilaluminio, el selectruro de L, el diborano, el diaceno y el hidruro de aluminio también pueden reducir los aldehídos y las cetonas, pero están desfavorecidos porque son peligrosos y violentamente reactivos. Sin embargo, estos compuestos son útiles para reducir los ácidos y ésteres carboxílicos a alcoholes, ya que el borohidruro de sodio no es lo suficientemente reactivo como para realizar la reacción.[13]
La siguiente tabla ilustra qué grupos funcionales carbonilo pueden reducirse mediante qué agentes reductores (algunos de estos reactivos varían en eficacia dependiendo de las condiciones de reacción):

Derivados de ácido carboxílico a aldehídos[editar]
Utilizando hidruros metálicos[editar]
La formación de aldehídos a partir de derivados de ácido carboxílico a menudo es un desafío, porque los agentes reductores más débiles (NaBH4) son incapaces de reducir los ésteres y los ácidos carboxílicos, que son relativamente estables, y los agentes reductores más fuertes (LiAlH4) reducen inmediatamente el aldehído formado a un alcohol..[14]
Dado que los cloruros de ácido son menos estables que los aldehídos y las cetonas, a menudo se usan junto con donantes de hidruros con impedimento estérico al sintetizar aldehídos, porque el reductor relativamente débil reaccionará preferentemente con el material de partida de cloruro de ácido, dejando el producto aldehído sin reaccionar. El agente reductor DIBAL-H (hidruro de diisobutilaluminio) a menudo se usa para este propósito: aunque normalmente reduce todos los carbonilos, puede dejar de reducirse en el aldehído si solo se usa un equivalente a bajas temperaturas. LiAl(OtBu)3 (formado a partir de LiAlH4 y tBuOH in situ) también puede dejar de reducirse en el aldehído, a través de un mecanismo similar al DIBAL-H.[15][16]
Métodos alternativos[editar]
El método tradicional de formar aldehídos sin reducir a alcoholes, mediante el uso de hidruros impedidos y carbonilos reactivos, está limitado por el alcance limitado del sustrato y de la gran dependencia de las condiciones de reacción. Una solución alternativa para evitar este método es reducir el derivado del ácido carboxílico hasta un alcohol, luego oxidar el alcohol a un aldehído. Otras alternativas incluyen formar un tioéster o una amida de Weinreb, luego reducir la nueva especie a un aldehído mediante la reducción de Fukuyama o la reacción de Weinreb respectivamente, o usar hidrogenación catalítica como en la reacción de Rosenmund.

En la reducción de Fukuyama, un ácido carboxílico se convierte primero en un tioéster mediante la adición de un tiol (con un mecanismo similar a la esterificación). El tioéster se reduce luego a un aldehído mediante un hidruro de sililo con un catalizador de paladio.[17]
En la reacción de Weinreb, un cloruro de acilo se convierte primero en la amida de Weinreb, luego se trata con un reactivo organometálico para formar una cetona o hidruro de litio y aluminio para formar un aldehído:[18]

La amida de Weinreb se reduce a través de un quelato estable, en lugar del carbonilo electrofílico que se forma a través de reducciones de hidruro metálico; el quelato, por lo tanto, solo se reduce una vez, como se ilustra a continuación:

La reacción de Rosenmund reduce los cloruros de acilo a aldehídos utilizando hidrógeno gaseoso con un catalizador de paladio sobre sulfato de bario, cuya pequeña superficie evita la sobre-reducción. Para sustratos más reactivos, el catalizador debe impedirse aún más con un veneno, a menudo uno que contiene azufre.[19]
Aldehídos y cetonas a alcanos[editar]

Los aldehídos y las cetonas pueden reducirse no solo a alcoholes sino también a alcanos. El método indirecto es reducir la cetona o aldehído a alcohol, dehidratar a alqueno e hidrogenar catalíticamente. Sin embargo, existen métodos para convertir aldehídos y cetonas en alcanos de manera directa. Algunas reacciones para esta transformación incluyen la reducción de Clemmensen (en condiciones fuertemente ácidas) y la reducción de Wolff-Kishner (en condiciones muy básicas), así como las diversas modificaciones de la reacción de Wolff-Kishner. La modificación de Caglioti, por ejemplo, usa tosilhidrazona con un donante de hidruro en condiciones más suaves sin base; la modificación de Myers sustituye la hidrazina con bis (ter-butildimetilsilil)-hidrazina, utiliza condiciones más suaves a temperatura ambiente y es rápida y eficiente.[20][21]
Carbonilos α,β-insaturados[editar]

En la reducción α,β-reducción (también llamado reducción conjugada), el substrato es un carbonilo α,β-insaturado como una enona o acroleína.
Cuando se reducen estos sustratos, la reducción 1,2, que produce un alcohol alílico, compite con la reducción de 1,4, que forma la cetona o aldehído saturados. La siguiente reducción de NaBH4 de una enona muestra dos productos posibles: el primero de la reducción de 1,4 y el segundo de la reducción de 1,2.[12]

A mayor impedimento estérico, más probable es la reducción 1,2. Además, para formar selectivamente el alcohol y evitar el producto 1,4, se utiliza la reducción de Luche. Las condiciones de esta reacción utilizan borhidruro de cerio Ce(BH4)3 (derivada de NaBH4 y CeCl3 combinados in situ) como fuente de hidruro.[12][22]
La fuente de hidruro Zn(BH4)2 también muestra selectividad 1,2, así como una diastereoselectividad mayor; lo hace coordinando no solo el oxígeno del carbonilo sino también los átomos adyacentes:[23]

Estereoselectividad[editar]
Reducción diastereoselectiva[editar]
En la reducción de ciclohexanonas, la fuente de hidruro puede atacar axialmente para producir un alcohol ecuatorial, o ecuatorialmente para producir un alcohol axial. En el ataque axial (que se muestra en rojo), el hidruro encuentra tensión 1,3-diaxial. En el ataque ecuatorial (que se muestra en azul), el hidruro evita la interacción 1,3-diaxial, pero el sustrato sufre una tensión de torsión desfavorable cuando el alcohol recién formado y el átomo de hidrógeno agregado se eclipsan mutuamente en la reacción intermedia (como se muestra en la proyección de Newman para el alcohol axial).

Los grandes agentes reductores, como LiBH(Me2CHCHMe)3, se ven obstaculizados por las interacciones 1,3-axiales y, por lo tanto, atacan ecuatorialmente. Los agentes reductores pequeños, como NaBH4, atacan preferentemente de forma axial para evitar las interacciones eclipsantes, porque la interacción 1,3-diaxial para las moléculas pequeñas es mínima; También se han citado razones estereoelectrónicas por la preferencia axial de los pequeños agentes reductores. Sin embargo, hacer que el sustrato sea más voluminoso (y aumentar las interacciones 1,3-axiales) disminuye la prevalencia de ataques axiales, incluso para pequeños donantes de hidruros.[12][24][25]
Reducción Enantioselectiva[editar]
Cuando se reducen las cetonas asimétricas, el alcohol secundario resultante tiene un centro quiral que puede controlarse usando catalizadores quirales.
Las reducciones de carbonilo bien conocidas en la síntesis asimétrica son la hidrogenación asimétrica de Noyori (reducción de beta-cetoéster / Ru / BINAP) y la reducción de CBS (BH3, catalizador quiral derivado de la prolina).
Véase también[editar]
- La levadura del panadero, un biotransformation ruta para carbonyl reducciones.
Referencias[editar]
- ↑ Bouveault, Louis; Blanc, Gustave Louis (1903). «Préparation des alcools primaires au moyen des acides correspondants» [Preparation of primary alcohols by means of the corresponding acids]. Compt. Rend. (en francés) 136: 1676-1678.
- ↑ Bouveault, Louis; Blanc, Gustave Louis (1903). «Préparation des alcools primaires au moyen des acides correspondants» [Preparation of primary alcohols by means of the corresponding acids]. Compt. Rend. (en francés) 137: 60-62.
- ↑ Bouveault, Louis; Blanc, Gustave Louis (1904). «Transformation des acides monobasiques saturés dans les alcools primaires correspondants» [Transforming saturated monobasic acids into the corresponding primary alcohols]. Bull. Soc. Chim. Fr. (en francés) 31: 666-672.
- ↑ Moffett, Robert Bruce. "2-(1-Pyrrolidyl)propanol". Org. Synth. 33: 82.
- ↑ McMurry, John E.. "Isoxazole Annelation Reaction: 1-Methyl-4,4a,5,6,7,8-hexahydronaphthalen-2(3H)-one". Org. Synth. 53: 70.
- ↑ Roche, Alex. «Ketones and Aldehydes». Rutgers University. Consultado el 1 de diciembre de 2015.
- ↑ Clayden, Jonathan (2012). Organic Chemistry. OUP Oxford. pp. 200. ISBN 978-0199270293.
- ↑ König, Burkhard (2009). «Reduction Reactions». Modern Methods in Organic Synthesis. Institut für Organische Chemie, Uni Regensburg. Archivado desde el original el 24 de agosto de 2015. Consultado el 1 de diciembre de 2015.
- ↑ Cox, Liam (2007). «Nucleophilic Addition Reactions of Aldehydes and Ketones». University of Birmingham. Consultado el 1 de diciembre de 2015.
- ↑ Sweeting, Linda M. (2001). «Reducing Agents». Towson University. Archivado desde el original el 16 de noviembre de 2015. Consultado el 1 de diciembre de 2015.
- ↑ Gribble, Gordon W.; Ferguson, Duncan C. (January 1975). «Reactions of sodium borohydride in acidic media. Selective reduction of aldehydes with sodium triacetoxyborohydride». Journal of the Chemical Society, Chemical Communications 0 (13): 535-536. doi:10.1039/C39750000535.
- ↑ a b c d Banfi, Luca; Narisano, Enrica; Riva, Renata (1 de enero de 2001). Sodium Borohydride. John Wiley & Sons, Ltd. ISBN 9780470842898. doi:10.1002/047084289x.rs052.
- ↑ Chaikin, Saul W.; Brown, Weldon G. (1 de enero de 1949). «Reduction of Aldehydes, Ketones and Acid Chlorides by Sodium Borohydride». Journal of the American Chemical Society 71 (1): 122-125. ISSN 0002-7863. doi:10.1021/ja01169a033.
- ↑ Gaylord, Norman G. (1 de agosto de 1957). «Reduction with complex metal hydrides». Journal of Chemical Education 34 (8): 367. Bibcode:1957JChEd..34..367G. doi:10.1021/ed034p367.
- ↑ Zakharkin, L.I.; Khorlina, I.M. (1962). «Reduction of esters of carboxylic acids into aldehydes with diisobutylaluminium hydride». Tetrahedron Letters 3 (14): 619-620. doi:10.1016/s0040-4039(00)70918-x.
- ↑ Cortes, Sergio (2010). «Using Hydrogen as a Nucleophile in Hydride Reductions». Dr. Sergio Cortes' Organic Chemistry Page. University of Texas at Dallas. Consultado el 1 de diciembre de 2015.
- ↑ Fukuyama, Tohru; Lin, Shao Cheng; Li, Leping (1 de septiembre de 1990). «Facile reduction of ethyl thiol esters to aldehydes: application to a total synthesis of (+)-neothramycin A methyl ether». Journal of the American Chemical Society 112 (19): 7050-7051. ISSN 0002-7863. doi:10.1021/ja00175a043.
- ↑ Nahm, Steven; Weinreb, Steven M. (1981). «N-methoxy-n-methylamides as effective acylating agents». Tetrahedron Letters 22 (39): 3815-3818. doi:10.1016/s0040-4039(01)91316-4.
- ↑ Mosettig, Erich; Mozingo, Ralph (1 de enero de 2004). The Rosenmund Reduction of Acid Chlorides to Aldehydes. John Wiley & Sons, Inc. ISBN 9780471264187. doi:10.1002/0471264180.or004.07.
- ↑ Caglioti, L.; Magi, M. (1 de enero de 1963). «The reaction of tosylhydrazones with lithium aluminium hydride». Tetrahedron 19 (7): 1127-1131. doi:10.1016/S0040-4020(01)98571-0.
- ↑ Furrow, Michael E.; Myers, Andrew G. (1 de mayo de 2004). «Practical Procedures for the Preparation of N-tert-Butyldimethylsilylhydrazones and Their Use in Modified Wolff−Kishner Reductions and in the Synthesis of Vinyl Halides and gem-Dihalides». Journal of the American Chemical Society 126 (17): 5436-5445. ISSN 0002-7863. PMID 15113215. doi:10.1021/ja049694s.
- ↑ Strategic Applications of Named Reactions in Organic Synthesis (Paperback) by Laszlo Kurti, Barbara Czako ISBN 0-12-429785-4
- ↑ Greeves, Nick (2015). «Diastereoselective Ketone Reduction». ChemTube3D. University of Liverpool. Consultado el 1 de diciembre de 2015.
- ↑ Wong, Stephen S.; Paddon-Row, Michael N. (January 1990). «Theoretical evidence in support of the Anh?Eisenstein electronic model in controlling ?-facial stereoselectivity in nucleophilic additions to carbonyl compounds». Journal of the Chemical Society, Chemical Communications 0 (6): 456-458. doi:10.1039/c39900000456.
- ↑ Krishnamurthy, S.; Brown, Herbert C. (1 de mayo de 1976). «Lithium trisiamylborohydride. A new sterically hindered reagent for the reduction of cyclic ketones with exceptional stereoselectivity». Journal of the American Chemical Society 98 (11): 3383-3384. ISSN 0002-7863. doi:10.1021/ja00427a061.
