Presión de vapor


La presión de vapor es la presión que ejerce la fase gaseosa o vapor sobre la fase líquida en un sistema cerrado a una temperatura determinada, cuando la fase líquida y el vapor se encuentran en equilibrio dinámico. Su valor es independiente de las cantidades de líquido y vapor presentes mientras existan ambas. Este fenómeno también lo presentan los sólidos; cuando un sólido pasa al estado gaseoso sin pasar por el estado líquido (proceso denominado sublimación o el proceso opuesto, llamado sublimación inversa o deposición) también hablamos de presión de vapor. En la situación de equilibrio, las fases reciben la denominación de líquido saturado y vapor saturado. Esta propiedad posee una relación directamente proporcional con las fuerzas moleculares, debido a que cuanto mayor sea el módulo de las mismas, mayor deberá ser la cantidad de energía entregada (ya sea en forma de calor u otra manifestación) para vencerlas y producir el cambio de estado.
Inicialmente solo se produce la evaporación, ya que no hay vapor; sin embargo, a medida que la cantidad de vapor aumenta, y por tanto la presión en el interior de la ampolla, se va incrementando también la velocidad de condensación, hasta que transcurrido un cierto tiempo ambas velocidades se igualan. Llegado este punto se habrá alcanzado la presión máxima posible en la ampolla (presión de vapor o de saturación): la presión total del volumen de gas (mezcla vapor-aire) es equivalente a la presión parcial de la fase vapor (presión de saturación). Esta presión de saturación solo podrá superarse aportando más energía (temperatura) a la mezcla, acción que incrementaría la presión de vapor (la tasa de evaporación), y a su vez, la presión total de la mezcla (ya que es un recipiente cerrado).
El equilibrio dinámico se alcanzará más rápidamente cuanto mayor sea la superficie de contacto entre el líquido y el vapor, pues así se favorece la evaporación del líquido; del mismo modo que un charco de agua extenso pero de poca profundidad se seca más rápido que uno más pequeño pero de mayor profundidad que contenga igual cantidad de agua. Sin embargo, el equilibrio se alcanza en ambos casos para igual presión.
El factor más importante que determina el valor de la presión de saturación es la propia naturaleza del líquido, encontrándose que, en general, entre líquidos de naturaleza similar, la presión de vapor a una temperatura dada es tanto menor cuanto mayor es la masa molecular del líquido.
Por ejemplo, el aire al nivel del mar saturado con vapor de agua a 20 °C tiene una presión parcial de 23 mbar de agua y alrededor de 780 mbar de nitrógeno, 210 mbar de oxígeno y 9 mbar de argón.
La presión de vapor de cualquier sustancia aumenta de forma no lineal con la temperatura, a menudo descrita por la ecuación de Clausius-Clapeyron. La presión atmosférica [de un líquido (también conocido como punto de ebullición normal) es la temperatura a la que la presión de vapor es igual a la presión atmosférica ambiente. Al aumentar la temperatura, la presión de vapor es suficiente para superar la presión atmosférica y hacer que el líquido forme burbujas de vapor. La formación de burbujas en profundidades de líquido elevadas requiere una temperatura ligeramente superior debido a la mayor presión del líquido, debida a la presión hidrostática de la masa de líquido superior. Más importante a poca profundidad es la mayor temperatura necesaria para iniciar la formación de burbujas. La tensión superficial de la pared de la burbuja provoca una sobrepresión en las burbujas iniciales muy pequeñas.
La presión de vapor que un solo componente de una mezcla aporta a la presión total del sistema se denomina presión parcial. Por ejemplo, el aire a nivel del mar, y saturado de vapor de agua a 20 °C, tiene presiones parciales de unos 2,3 kPa de agua, 78 kPa de nitrógeno, 21 kPa de oxígeno y 0,9 kPa de argón, totalizando 102,2 kPa, lo que constituye la base de la presión atmosférica estándar.
Medición y unidades
[editar]La presión de vapor es medida en unidades estándar de presión. El Sistema Internacional de Unidades (SI) reconoce la presión como una unidad derivada de la fuerza ejercida a través de un área determinada; a esta unidad se le conoce por el nombre de pascal (Pa). Un pascal es equivalente a un newton por metro cuadrado (N·m-2 o kg·m-1·s-2).
La medición experimental de la presión de vapor es un procedimiento simple para presiones similares que estén entre 1 y 200 kPa. Resultados más exactos son obtenidos cerca del punto de ebullición de cada sustancia en particular y con índice de error más significativo en mediciones menores a 1 kPa. Con frecuencia, algunos procedimientos consisten en purificar las sustancias que son analizadas, aislando la sustancia deseada en un contenedor, evitando cualquier gas indeseado y midiendo la presión de equilibrio de la fase gaseosa de la sustancia en el sistema cerrado a distintas temperaturas. El uso de herramientas, como un isoteniscopio, genera una mayor exactitud en el proceso.
Estimación de las presiones de vapor con la ecuación de Antoine
[editar]La ecuación de Antoine[1][2] es una expresión matemática pragmática de la relación entre la presión de vapor y la temperatura de sustancias líquidas o sólidas puras. Se obtiene por ajuste de curvas y se adapta al hecho de que la presión de vapor suele ser creciente y cóncava en función de la temperatura. La forma básica de la ecuación es
y puede transformarse en esta forma explícita de temperatura:
donde:
- es la presión absoluta de vapor de una sustancia.
- es la temperatura de la sustancia
- , y son coeficientes específicos de la sustancia (es decir, constantes o parámetros).
- puede ser o [2]
A veces se utiliza una forma más simple de la ecuación con sólo dos coeficientes:
que a veces puede transformarse en:
Las sublimaciones y vaporizaciones de la misma sustancia tienen conjuntos separados de coeficientes de Antoine, al igual que los componentes de las mezclas.[1] Cada conjunto de parámetros para un compuesto específico sólo es aplicable en un intervalo de temperatura específico. Generalmente, los rangos de temperatura se eligen para mantener la precisión de la ecuación de unos pocos hasta un 8-10 por ciento. Para muchas sustancias volátiles, se dispone de varios conjuntos de parámetros diferentes que se utilizan para distintos intervalos de temperatura. La ecuación de Antoine tiene poca precisión con cualquier conjunto de parámetros cuando se utiliza desde el punto de fusión de un compuesto hasta su temperatura crítica. La precisión también suele ser escasa cuando la presión de vapor es inferior a 10 Torr debido a las limitaciones del aparato[cita requerida] utilizado para establecer los valores de los parámetros de Antoine.
La ecuación de Wagner[3] da "uno de los mejores"[4] se ajusta a los datos experimentales, pero es bastante complejo. Expresa la presión de vapor reducida en función de la temperatura reducida.
Presión de vapor y punto de ebullición de un líquido
[editar]Un líquido está, a cualquier temperatura, en equilibrio con su propio vapor cuando las moléculas de este están presentes en una cierta concentración. En este caso hablamos de equilibrio cuando se alcanzan las condiciones de saturación (se iguala evaporación con condensación). La presión que corresponde a esta concentración de moléculas gaseosas se llama presión de vapor del líquido a la temperatura dada, y es una relación directa entre la presión parcial de la fase vapor (presión de vapor), y la presión total de la fase vapor (donde existe el componente evaporado, y, en general el componente que previamente ocupaba el volumen, aire). Por lo tanto, conociendo la presión de vapor de un líquido a cierta temperatura, podemos conocer qué concentración de vapor obtendremos en aire en condiciones de saturación: el agua, a 20 °C, tiene aproximadamente una presión de vapor de 23,4 mbar, que en relación con 1 bar de presión atmosférica representa un 2,34 % de concentración en volumen). Así sabemos que cuando a 20 °C nos indican que existe una humedad relativa del 100 % (condiciones de saturación, capacidad máxima de vapor de agua en aire), nos están informando que un 2,3 % del volumen de aire a nuestro alrededor es vapor de agua. La presión de vapor de cada líquido aumenta con la temperatura (las moléculas de líquido tienen más energía para superar la presión externa). Siguiendo con el ejemplo, en condiciones tropicales (40 °C) una humedad del 100 % implica una cantidad mucho mayor de agua (presión de vapor de 73,8 mbar, equivalente a 7,38 % de vapor en aire), hecho que explica que sea un ambiente tan agobiante.
La temperatura para la cual la presión de vapor de un líquido iguala a la presión externa se denomina punto de ebullición del líquido, asimilado al cambio de fase. A esta temperatura aparecen en el líquido burbujas de vapor que escapan de la superficie. Por ejemplo, en una olla con agua hirviendo se puede observar que las burbujas aparecen en la parte inferior de la olla, donde se alcanzan más rápidamente los 100 °C.
Variación de la presión de vapor con la temperatura
[editar]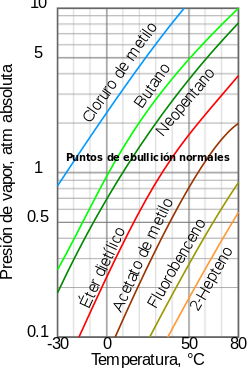
Como una tendencia general, la presión de vapor de los líquidos a presión atmosférica disminuye con el aumento en la temperatura de ebullición. Este fenómeno es ilustrado en el diagrama adjunto, que muestra, para varios líquidos, el comportamiento de su presión de vapor versus la temperatura. Por ejemplo, a cualquier temperatura, el clorometano (cloruro de metilo) tiene la más alta presión de vapor de todos los líquidos expuestos en el gráfico. También se observa la baja temperatura de ebullición del propano, cuya curva de presión de vapor (línea cian) se interseca con la línea horizontal correspondiente a 1 atmósfera en -41 °C.
Aunque la relación entre la presión de vapor y la temperatura no es lineal, el gráfico usa un eje logarítmico vertical para obtener una línea poco curva y así poder representar en un solo gráfico el comportamiento de varios líquidos.
Mezclas líquidas: Ley de Raoult
[editar]La ley de Raoult da una aproximación a la presión de vapor de las mezclas de líquidos. Establece que la actividad (presión o fugacidad) de una mezcla monofásica es igual a la suma ponderada por fracción molar de las presiones de vapor de los componentes:
donde es la presión de vapor de la mezcla, es la fracción molar del componente en fase líquida y es la fracción molar del componente en fase vapor respectivamente. es la presión de vapor del componente . La ley de Raoult sólo es aplicable a los no electrolitos (especies sin carga); es más apropiada para moléculas no polares con sólo débiles atracciones intermoleculares (como Fuerzas de dispersión de London).
Se dice que los sistemas que tienen presiones de vapor superiores a las indicadas por la fórmula anterior tienen desviaciones positivas. Tal desviación sugiere una atracción intermolecular más débil que en los componentes puros, de modo que se puede pensar que las moléculas están "retenidas" en la fase líquida con menos fuerza que en el líquido puro. Un ejemplo es el azeótropo de aproximadamente 95% de etanol y agua. Como la presión de vapor del azeótropo es superior a la predicha por la ley de Raoult, hierve a una temperatura inferior a la de cualquiera de los componentes puros.
También hay sistemas con desviaciones negativas que tienen presiones de vapor inferiores a las esperadas. Estas desviaciones indican que la atracción intermolecular entre los componentes de la mezcla es mayor que en los componentes puros. Así, las moléculas se "retienen" en el líquido con más fuerza cuando hay una segunda molécula presente. Un ejemplo es una mezcla de triclorometano (cloroformo) y 2-propanona (acetona), que hierve por encima del punto de ebullición de cualquiera de los componentes puros.
Las desviaciones negativas y positivas pueden utilizarse para determinar los coeficientes de actividad termodinámica de los componentes de las mezclas.
Sólidos
[editar]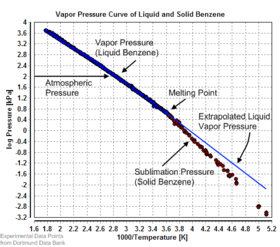
La presión de vapor de equilibrio puede definirse como la presión alcanzada cuando una fase condensada está en equilibrio con su propio vapor. En el caso de un sólido en equilibrio, como un cristal, puede definirse como la presión cuando la velocidad de sublimación de un sólido coincide con la velocidad de deposición de su fase vapor. Para la mayoría de los sólidos esta presión es muy baja, pero algunas excepciones notables son el naftaleno, el hielo seco (la presión de vapor del hielo seco es de 5,73 MPa (831 psi, 56,5 atm) a 20 °C, lo que provoca la rotura de la mayoría de los recipientes sellados) y el hielo. Todos los materiales sólidos tienen una presión de vapor. Sin embargo, debido a sus valores a menudo extremadamente bajos, su medición puede resultar bastante difícil. Las técnicas típicas incluyen el uso de la termogravimetría y la transpiración de gases.
Existen varios métodos para calcular la presión de sublimación (es decir, la presión de vapor) de un sólido. Un método consiste en estimar la presión de sublimación a partir de presiones de vapor de líquido extrapoladas (del líquido sobreenfriado), si se conoce la calor de fusión, utilizando esta forma particular de la relación Clausius-Clapeyron:[5]
donde:
- es la presión de sublimación del componente sólido a la temperatura .
- es la presión de vapor extrapolada del componente líquido a la temperatura .
- es el calor de fusión.
- es la constante de los gases.
es la temperatura de sublimación. es la temperatura de fusión.
Este método supone que el calor de fusión es independiente de la temperatura, ignora las temperaturas de transición adicionales entre las distintas fases sólidas y da una estimación justa para temperaturas no muy alejadas del punto de fusión. También muestra que la presión de sublimación es menor que la presión de vapor líquido extrapolada (ΔfusH > 0) y la diferencia crece con el aumento de la distancia al punto de fusión.
Importancia para el derecho ambiental
[editar]El índice de peligrosidad (Ip) de una sustancia está determinado por el cociente entre la presión de vapor de la sustancia y su CMP (concentración máxima permitida) en condiciones estándar (25 °C y 1 atm), por lo que esta propiedad nos permite analizar la viabilidad del uso de una sustancia para actividades determinadas, debido a que indica la probabilidad de que la misma se volatilice.
Significado en meteorología
[editar]En meteorología, el término presión de vapor se usa para referirse a la presión parcial del vapor de agua en la atmósfera, incluso si no está en equilibrio,[6] y la "presión de vapor de equilibrio" se especifica de otro modo. Los meteorólogos también utilizan el término "presión de vapor de saturación" para referirse a la presión de vapor de equilibrio del agua o salmuera sobre una superficie plana, para distinguirla de la presión de vapor de equilibrio, que tiene en cuenta la forma y el tamaño de las gotitas del agua y partículas en la atmósfera.[7]
Véase también
[editar]Referencias
[editar]- ↑ a b ¿Qué es la ecuación de Antoine? (Departamento de Química, Frostburg State University, Maryland)
- ↑ a b Sinnot, R.K. (2005). Diseño de ingeniería química (4th edición). Butterworth-Heinemann. p. 331. ISBN 978-0-7506-6538-4.
- ↑ Wagner, W. (1973), «Nuevas medidas de presión de vapor para argón y nitrógeno y un nuevo método para establecer ecuaciones racionales de presión de vapor», Cryogenics 13 (8): 470-482, Bibcode:1973Cryo...13..470W.
- ↑ Manual del Ingeniero Químico de Perry, 7ª Ed. pp. 4-15
- ↑ Moller B.; Rarey J.; Ramjugernath D. (2008). «Estimación de la presión de vapor de compuestos orgánicos no electrolíticos mediante contribuciones de grupo e interacciones de grupo». Journal of Molecular Liquids 143: 52-63. doi:10.1016/j.molliq.2008.04.020.
- ↑ Glossary Archivado el 15 de abril de 2011 en Wayback Machine. (Developed by the American Meteorological Society)
- ↑ A Brief Tutorial. jhuapl.edu (An article about the definition of equilibrium vapor pressure)


























