Girificación


La girificación es el proceso por el cual se forman los pliegues que son característicos de la corteza cerebral.[1] Las partes más elevadas de estos pliegues reciben el nombre de giros, y las partes más deprimidas reciben el nombre de surcos. Las neuronas de la corteza cerebral se encuentran en una capa muy delgada llamada materia gris, de solo entre 2 y 4 mm de grosor, en la superficie del cerebro.[2] Gran parte del volumen del interior lo ocupa la materia blanca, la cual está formada por proyecciones axonales de gran tamaño que van desde y hasta las neuronas de la corteza que se encuentran cerca de la superficie. La girificación permite que la superficie de la corteza tenga una área más grande y que, por lo tanto, que quepa más funcionalidad cognitiva dentro de un cráneo más pequeño. La girificación comienza durante el desarrollo fetal en la mayor parte de los mamíferos. A excepción de algunas especies, los primates, los cetáceos y los ungulados tienen una gran cantidad de giros cerebrales, mientras que los roedores no tienen ninguna por lo general. En algunos animales, como por ejemplo en el hurón, la girificación no se detiene tras el parto.[3]
La girificación durante el desarrollo del cerebro humano
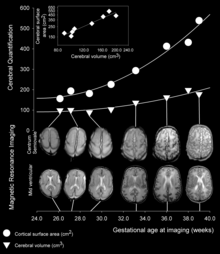
A medida que avanza el desarrollo fetal, la formación de hendiduras cada vez más profundas dan forma a los giros y a los surcos en la superficie de la corteza. No todos los giros se empiezan a desarrollar al mismo tiempo, sino que los giros cerebrales primarios se forman primero (en los seres humanos, se empiezan a formar a partir de la décima semana de gestación) y, más tarde, se forman los giros secundarios y terciarios.[4] Uno de los surcos principales y más prominentes es el surco lateral (también conocido como fisura lateral o cisura de Silvio), y también es importante el surco central, el cual separa la corteza motora (giro precentral) de la corteza somatosensorial (giro postcentral).[5] La mayor parte de los surcos y de los giros cerebrales se empiezan a formar entre las semanas 24 y 38 de la gestación, y siguen haciéndose más grandes y madurando tras el nacimiento.
Ventajas evolutivas
Se cree que una ventaja de la girificación es el aumento de la velocidad en la comunicación de las células neuronales, ya que gracias a los pliegues cerebrales las células están más cerca unas de las otras, y la transmisión de los impulsos eléctricos neuronales, llamados potenciales de acción, requieren menos tiempo y energía.[6] Existe evidencia que señala que cuando la girificación es mayor se produce una mayor velocidad de procesamiento de la información cognitiva, así como una mejor memoria de trabajo verbal.[7] Además, ya que para un cráneo más grande hace falta una pelvis más grande durante el parto, lo cual supone dificultades en la bipedestación, es más fácil dar a luz si el cráneo es más pequeño.[8][9]
Teorías sobre la causa de la girificación
Deformación debida a un proceso mecánico
Aún no se comprenden bien los mecanismos que producen la girificación de la corteza cerebral, y en la literatura científica se proponen varias hipótesis. Una hipótesis popular que apareció por primera vez en la época de Retzius a finales del siglo XIX afirma que las fuerzas de deformación mecánica que se producen debido a la expansión del tejido cerebral son las que hacen que la superficie de la corteza se doble.[10] Desde aquella, una gran cantidad de teorías han estado vinculadas indirectamente a esta hipótesis.
Se cree que la girificación no se debe a la restricción externa del crecimiento del cráneo, ya que el primordio del cráneo todavía no se ha osificado (no se ha endurecido hasta convertirse en hueso mediante el proceso de calcificación) durante el periodo de desarrollo del cerebro del feto. El tejido que cubre la corteza cerebral embrionaria se compone de varias capas finas de ectodermo (que se convertirán en piel en el futuro) y de tejido mesenquimal (que se convertirá en músculo y en tejido conjuntivo en el futuro, incluyendo el cráneo). Estas capas finas crecen durante la expansión de la corteza pero, posteriormente, el tejido mesenquimal del cerebro se convertirá en cartílago; y la osificación de las placas craneales no se produce hasta una fase posterior en el desarrollo. Tras el nacimiento, el cráneo humano sigue creciendo de forma sustancial, junto con el cerebro, hasta la fusión de las placas craneales varios años más tarde. Además, existen estudios experimentales en animales que han revelado que los pliegues de la corteza pueden ocurrir incluso sin restricciones externas.[11] Por tanto, se cree que es el crecimiento del cerebro lo que impulsa el crecimiento del cráneo; hoy se cree que los impulsores de la girificación más importantes son los factores mecánicos y genéticos que se producen en el cerebro.[6] El único papel constatado del cráneo en la girificación es el aplanamiento de los giros durante la maduración del cerebro tras la fusión de las placas craneales.[11]
Tensión axonal
Existe una teoría alternativa, la cual afirma que lo que produce los pliegues son las fuerzas de tensión axonal entre áreas de la corteza extremadamente interconectadas, por lo que distintas áreas corticales en una zona se atraen unas a las otras.[12] Hay evidencias que apoyan esta hipótesis. Por ejemplo, los axones en las áreas del cerebro con altos niveles de girificación son rectos, cortos y conectan las paredes de los giros. Sin embargo, no se puede demostrar que esto sea lo que causa o que es resultado del plegado cortical. A pesar de que puede que estas conexiones cortas se produzcan debido a axones tirando de las paredes de los giros en formación, también puede ser que los axones se mantengan cortos de forma adaptable debido a patrones de crecimiento mecánicos.[6] Además, un estudio mostró que se puede inducir la girificación de forma experimental en los embriones de ratones, pero tiene que ser durante las etapas tempranas, cuando aún no se formaron las conexiones axonales.[13]
Expansión tangencial diferencial
Más recientemente, apareció la teoría de la expansión tangencial diferencial, la cual afirma que los patrones de pliegue del cerebro se producen debido a que la expansión tangencial ocurre a ritmos diferentes entre distintas áreas de la corteza cerebral.[14] Esto puede ser debido a las diferencias de área en las tasas de división temprana de los progenitores.
Factores mecánicos
Grosor de la corteza
Las condiciones tempranas del cerebro tienen una gran influencia en el nivel de girificación que se alcanzarán. En concreto, existe una relación inversa entre el grosor de la corteza y la girificación. Aquellas áreas del cerebro donde hay menos grosor son las que tienen una mayor girificación, y viceversa.[6]
Velocidad de crecimiento
Existe cierto desacuerdo sobre a qué ritmo de crecimiento se desarrollan las capas de la corteza y de debajo de la corteza del cerebro. El modelo de crecimiento completamente isotrópico propone que las capas de materia gris (envoltura exterior) y blanca (núcleo interior) crecen a ritmos distintos, pero que son uniformes en todas las dimensiones. El modelo de crecimiento tangencial propone que la materia gris crece a un ritmo más rápido que la materia blanca del interior, y que el ritmo de crecimiento de la materia gris es el que determina el ritmo de crecimiento de la materia blanca. A pesar de que los dos métodos son diferenciales, y de que los dos dicen que la corteza crece más rápidamente que las capas inferiores, es el modelo de crecimiento tangencial el que se considera que es más correcto.[6]
Los pliegues en la superficie del cerebro se forman debido a la inestabilidad, y en los modelos de crecimiento tangencial se obtiene más a menudo que en los modelos isotrópicos el nivel de inestabilidad que producen los pliegues. A este nivel de inestabilidad se le llama punto crítico, en el cual los modelos prefieren liberar energía potencial perdiendo estabilidad y formando pliegues para adquirir más estabilidad.[6]
Factores genéticos
El patrón de giros y de surcos en la corteza no se produce al azar, ya que la mayor parte de las convoluciones de gran tamaño que se mantienen entre individuos distintos también se mantienen entre especies distintas. Esto puede indicar que los mecanismos genéticos pueden determinar la ubicación de los giros más importantes. Esta idea está respaldada por estudios de gemelos monocigóticos y dicigóticos de finales de la década de 1990,[15] sobre todo con respecto a los giros y surcos primarios, ya que en los giros secundarios y terciarios suele haber más variabilidad entre gemelos.[16] Por lo tanto, se puede especular que los pliegues secundarios y terciarios dependen en mayor medida de factores ambientales y genéticos.[17] El gen Trnp1 fue el primero que se descubrió que tenía influencia en el proceso de girificación.[18] La posición en el cerebro humano de los pliegues/giros que se están desarrollando puede estar determinada por los niveles de expresión local del Trnp1.[18][19][20] En la girificación pueden contribuir genes que influyen en las dinámicas de los progenitores en la corteza, en la neurogénesis y en la migración neuronal, así como genes que influyen en el desarrollo de circuitos en la corteza y en las proyecciones axonales. El Trnp1 es un factor de unión al ADN que se ha comprobado que regula otros genes que regulan la proliferación de las células progenitoras de la corteza - y por tanto actúa como un gen regulador maestro.[6][18] Además, se ha demostrado hace poco que las vías de señalización de factor de crecimiento de fibroblastos (FCF)- y de Sonic hedgehog (SHH)-son capaces de producir pliegues en la corteza, con todas las capas que los forman, en ratones que viven hasta la edad adulta.[13][21] Estos factores FCF y Shh regulan la proliferación de las células madre de la corteza y las dinámicas de la neurogénesis. La existencia de niveles apropiados de muerte celular de los progenitores en la corteza, y la catenina beta (parte de la vía de señalización WNT), también influyen.[22][23]
Factores determinantes biológicos celulares
Las células madre de la corteza, llamadas células radiales gliales (CRG), se encuentran en la zona ventricular y generan las neuronas glutamatérgicas excitatorias de la corteza cerebral.[24][25] Estas células se propagan rápidamente renovándose a sí mismas durante las etapas tempranas del desarrollo, expandiendo así la reserva de progenitores y aumentando el área de la superficie de la corteza. Durante esta etapa, el patrón de las áreas de la corteza cerebral está programado genéticamente mediante un sistema de centros de señalización mediante el proceso de modelado de la corteza, y al mapa primordial de las áreas funcionales de la corteza durante esta etapa se le llama 'protomapa'.[26] La neurogénesis en la corteza comienza a mermar la reserva de células progenitoras, sujeta a las reservas de muchas señales genéticas como los factores de crecimiento de fibroblastos (FCF) y la proteína Notch.[27] Las CRG generan precursores neuronales intermedios que se continúan dividiendo en la zona subventricular (ZSV), aumentando el número de neuronas que se producen en la corteza.[28] Las fibras de CRG son muy largas y se extienden desde la corteza en desarrollo hasta la superficie de la piamadre del cerebro, y sirven como guías físicas para las migraciones neuronales.[29] Existe un segundo tipo de las CRG, llamadas CRG basales (CRGb), que forman una tercera reserva de progenitores en la zona subventricular exterior.[30] Las CRG basales en general son mucho más abundantes en los mamíferos superiores. Tanto las CRG clásicas y las CRGb representan señales guía que conducen a las neuronas recién nacidas a su destino en la corteza cerebral. Cuando la cantidad de CRGb aumenta, también aumenta la densidad de las fibras guía y, en el caso contrario, se formaría un arreglo desperdigado en el cual se perdería densidad de fibras.[31] Existe cierta bibliografía científica que indica que hay diferencias entre especies de mamíferos en las dinámicas de propagación y diferenciación neuronal en cada una de estas zonas de progenitores, y dichas diferencias podrían explicar por qué el tamaño de la corteza y la girificación en los mamíferos son tan diferentes entre especies. Se ha planteado la idea de que algunas células progenitoras generan una gran cantidad de neuronas que se dirigen hacia las capas exteriores de la corteza, lo que causa un aumento mayor del área de la superficie en las capas exteriores, en comparación con las capas interiores de la corteza.[31] Todavía no está claro cómo podría ser esto posible sin más elementos mecánicos.[32][33]
Variación entre especies
Para medir la cantidad de circunvoluciones en la superficie de los cerebros de los mamíferos se utiliza el 'índice de girificación' (IG).[34][35] En los cerebros de los reptiles y de las aves no hay girificación. Aquellos mamíferos que tienen un IG elevado, suelen ser más grandes que aquellos con un IG más pequeño; por ejemplo, las ballenas piloto y los delfines nariz de botella tienen IGs mayores. Sin embargo, el cerebro humano muestra un IG similar al de un caballo, a pesar de ser más grande que éste. Los roedores son los que tienen en general un IG más bajo. A pesar de todo, hay algunos roedores que tienen muchos giros en el cerebro y hay algunas especies de primates cuyo cerebro es bastante liso.[36]
Mota y Herculano-Houzel encontraron una relación lineal en mamíferos expresada en términos de girificación. [37] Propusieron un modelo que combina distintas medidas morfométricas (grosor del córtex, área expuesta y área total) que podría ser una forma de describir la girificación.
Enfermedades neurológicas relacionadas con la girificación
Lisencefalia
A una corteza cerebral que no tenga pliegues en la superficie se le llama lisencefálica, palabra que significa 'de cerebro liso'.[38] A principios del desarrollo embrionario, los cerebros de todos los mamíferos son estructuras lisencefálicas que proceden del tubo neural. Algunos, como los cerebros de los ratones, permanecen lisencefálicos a lo largo de toda la edad adulta. Se ha demostrado que las especies lisencefálicas poseen muchas de las señales moleculares necesarias para formar giros en la corteza, pero no lo hacen debido a que hay una gran cantidad de genes que están implicados en la regulación de la proliferación de progenitores neurales y procesos neurógenos que son la base de la girificación. Una hipótesis dice que las diferencias espaciotemporales en estas vías moleculares, entre las que se encuentran el FCF, el Shh y el Trnp1, y probablemente muchas otras, son las que determinan el ritmo de la girificación y su alcance en distintas especies.[18][21]
La lisencefalia es un estado patológico humano y, en aquellos seres humanos que lo padecen, una gran porción de neuronas son incapaces de llegar hasta la corteza externa durante la migración neuronal, y se quedan bajo la placa cortical.[39] Este movimiento no solo produce defectos en las conexiones de la corteza, sino también una corteza más gruesa, lo cual es consistente con la idea de que aquellos cerebros que tengan una corteza más gruesa sufrirán una girificación menor.[40]
Polimicrogiria
La polimicrogiria es una enfermedad en la cual el cerebro tiene una corteza con demasiadas convoluciones. A pesar de que parece que la superficie del cerebro es lisa y que tiene pocos surcos, en su interior existe una estructura compleja con un número de pliegues secundarios y terciarios enorme.[40] Al utilizar IRM para obtener imágenes del cerebro, se puede observar que los cerebros con polimicrogiria tienen una corteza más fina, lo cual es consistente con la idea de que aquellos cerebros que tengan una corteza más fina sufrirán una girificación mayor.[39][40] Se ha constatado que una amplia gama de genes, cuando mutan, causan polimicrogiria en seres humanos, que van desde enfermedades relacionadas con la proteína mTOR (por ejemplo, AKT3) hasta canalopatías (canales de sodio, "SCN3A").[41]
Autismo
Los pacientes que sufren autismo por lo general tienen un nivel de girificación mayor en sus cerebros,[42] pero solo en los lóbulos temporal, parietal y occipital, así como en parte de la corteza cingulada.[43] Se ha determinado que la presencia de niveles de girificación elevados está correlacionada con una conectividad local más grande en cerebros autistas, lo cual es un indicativo de hiperconectividad.
Se ha identificado el Trnp1, que también se ha usado para inducir la girificación en modelos de animales, en pacientes con enfermedades del espectro autista, lo cual indica que el Trnp1 cumple un papel molecular en el autismo.[44]
Se ha determinado que, desde durante las primeras etapas de desarrollo del cerebro, los pliegues de los cerebros humanos con autismo no se encuentran en la misma posición que los de un cerebro sano, sino que han cambiado ligeramente de sitio. Más concretamente, existen patrones diferentes en el surco frontal superior, en la cisura de Silvio, en el giro frontal inferior, en el giro temporal superior y en el surco olfatorio.[45] Estas áreas están relacionadas con la memoria de trabajo, el procesamiento de emociones, el lenguaje y el contacto visual,[46] y sus diferencias en comparación con un cerebro humano sano en su posición y en su grado de girificación podrían explicar algunas de las alteraciones del comportamiento en pacientes autistas.
Esquizofrenia
La esquizofrenia, una enfermedad que está más extendida, también está correlacionada con anomalías estructurales en el cerebro. Al igual que en los cerebros autistas, los cerebros esquizofrénicos tienen menos grosor de la corteza y más girificación que un cerebro sano.[39][47]
Malformaciones debidas al virus del Zika
Debido a la infección durante el embarazo, el virus del Zika produce malformaciones en la corteza, que en general se clasifican como microcefalia, palabra que significa 'cerebro pequeño'. No es extraño que se produzcan cambios en la girificación, debido a la gran pérdida de volumen de la corteza cerebral durante la microcefalia. Sin embargo, existen estudios recientes sobre el mecanismo de las malformaciones debidas al Zika que indican que las deformidades más importantes se deben a la infección y muerte celular de las CRG.[48][49] La muerte de las células madre de la corteza produce la pérdida de todas las células hijas que producirían, y el alcance de las malformaciones depende por tanto del momento de la infección, así como de su gravedad, durante el periodo de proliferación y neurogénesis de las células madre neuronales. Por lo general, la existencia de infecciones previas provoca malformaciones más graves.[50][51] La microcefalia y las malformaciones de la girificación son permanentes y no existe tratamiento para curarlas.
Métodos para medir la girificación
Se puede medir la girificación de la corteza mediante el Índice de Girificación (IG),[52] la Dimensionalidad Fractal[53] y mediante una combinación de valores morfométricos (área, grosor, volumen).[37] El IG se define como el cociente entre el Área Total y el Área Expuesta ("perímetro del cerebro delimitado en secciones frontales bidimensionales"). [54] Una herramienta muy útil para medir el IG es FreeSurfer, un programa de reconstrucción de superficies.[55]
Imágenes adicionales
-
Distintos cerebros. En sentido de las agujas del reloj empezando por arriba a la izquierda: Macaco Rhesus adulto; Ratón adulto; Humano durante la gestación; Humano recién nacido; Humano adulto (abajo izquierda).
-
Encéfalo de un adulto humano normal (en la izquierda), polimicrogiria (en el centro) y lisencefalia (a la derecha).
Referencias
- ↑ Rakic, P (Octubre de 2009). «Evolution of the neocortex: a perspective from developmental biology.». Nature Reviews Neuroscience 10 (10): 724-35. PMC 2913577. PMID 19763105. doi:10.1038/nrn2719.
- ↑ Kandel, Eric R.; Schwartz, James H.; Jessell, Thomas M.; Siegelbaum, Steven A.; Hudspeth, A.J., eds. (2012) [1981]. Principles of Neural Science (5th edición). Nueva York: McGraw Hill. ISBN 978-0-07-139011-8.
- ↑ Smart, IH; McSherry, GM (Junio de 1986). «Gyrus formation in the cerebral cortex in the ferret. I. Description of the external changes.». Journal of Anatomy 146: 141-52. PMC 1166530. PMID 3693054.
- ↑ Rajagopalan, V; Scott, J; Habas, PA; Kim, K; Corbett-Detig, J; Rousseau, F; Barkovich, AJ; Glenn, OA et al. (23 de febrero de 2011). «Local tissue growth patterns underlying normal fetal human brain gyrification quantified in utero.». The Journal of Neuroscience 31 (8): 2878-87. PMC 3093305. PMID 21414909. doi:10.1523/jneurosci.5458-10.2011.
- ↑ Bayer, Shirley A; Altman, Joseph (2005). The Human Brain during the Second Trimester. Boca Ratón, Florida, EE.UU.: CRC Press. ISBN 978-0-8493-1422-3.
- ↑ a b c d e f g Striedter, Georg F.; Srinivasan, Shyam; Monuki, Edwin S. (1 de enero de 2015). «Cortical Folding: When, Where, How, and Why?». Annual Review of Neuroscience 38 (1): 291-307. PMID 25897870. doi:10.1146/annurev-neuro-071714-034128.
- ↑ Gautam, Prapti; Anstey, Kaarin J.; Wen, Wei; Sachdev, Perminder S.; Cherbuin, Nicolas (1 de julio de 2015). «Cortical gyrification and its relationships with cortical volume, cortical thickness, and cognitive performance in healthy mid-life adults». Behavioural Brain Research 287: 331-339. PMID 25804360. doi:10.1016/j.bbr.2015.03.018.
- ↑ Jordaan, HV (Marzo de 1976). «Newborn: adult brain ratios in hominid evolution.». American Journal of Physical Anthropology 44 (2): 271-8. PMID 816206. doi:10.1002/ajpa.1330440209.
- ↑ Weiner, S; Monge, J; Mann, A (Septiembre de 2008). «Bipedalism and parturition: an evolutionary imperative for cesarean delivery?». Clinics in Perinatology 35 (3): 469-78, ix. PMID 18952015. doi:10.1016/j.clp.2008.06.003.
- ↑ Ronan, L; Voets, N; Rua, C; Alexander-Bloch, A; Hough, M; Mackay, C; Crow, TJ; James, A; Giedd, JN; Fletcher, PC (Agosto de 2014). «Differential tangential expansion as a mechanism for cortical gyrification.». Cerebral Cortex 24 (8): 2219-28. PMC 4089386. PMID 23542881. doi:10.1093/cercor/bht082.
- ↑ a b Tallinen, Tuomas; Chung, Jun Young; Biggins, John S.; Mahadevan, L. (2 de septiembre de 2014). «Gyrification from constrained cortical expansion». Proceedings of the National Academy of Sciences (en inglés) 111 (35): 12667-12672. Bibcode:2014PNAS..11112667T. ISSN 0027-8424. PMC 4156754. PMID 25136099. arXiv:1503.03853. doi:10.1073/pnas.1406015111.
- ↑ Van Essen, DC (23 de enero de 1997). «A tension-based theory of morphogenesis and compact wiring in the central nervous system». Nature 385 (6614): 313-8. Bibcode:1997Natur.385..313E. PMID 9002514. doi:10.1038/385313a0.
- ↑ a b Rash, BG; Tomasi, S; Lim, HD; Suh, CY; Vaccarino, FM (26 de junio de 2013). «Cortical gyrification induced by fibroblast growth factor 2 in the mouse brain.». The Journal of Neuroscience 33 (26): 10802-14. PMC 3693057. PMID 23804101. doi:10.1523/jneurosci.3621-12.2013.
- ↑ Ronan, L; Voets, N; Rua, C; Alexander-Bloch, A; Hough, M; Mackay, C; Crow, TJ; James, A; Giedd, JN; Fletcher, PC (Agosto de 2014). «Differential tangential expansion as a mechanism for cortical gyrification.». Cerebral Cortex 24 (8): 2219-28. PMC 4089386. PMID 23542881. doi:10.1093/cercor/bht082.
- ↑ Bartley, AJ; Jones, DW; Weinberger, DR (Febrero de 1997). «Genetic variability of human brain size and cortical gyral patterns.». Brain 120 (2): 257-69. PMID 9117373. doi:10.1093/brain/120.2.257.
- ↑ White, Tonya; Su, Shu; Schmidt, Marcus; Kao, Chiu-Yen; Sapiro, Guillermo (1 de febrero de 2010). «The development of gyrification in childhood and adolescence». Brain and Cognition. Adolescent Brain Development: Current Themes and Future Directions 72 (1): 36-45. PMC 2815169. PMID 19942335. doi:10.1016/j.bandc.2009.10.009.
- ↑ Gómez-Robles, Aida; Hopkins, William D.; Sherwood, Chet C. (22 de junio de 2013). «Increased morphological asymmetry, evolvability and plasticity in human brain evolution». Proc. R. Soc. B (en inglés) 280 (1761): 20130575. ISSN 0962-8452. PMC 3652445. PMID 23615289. doi:10.1098/rspb.2013.0575.
- ↑ a b c d Stahl, Ronny; Walcher, Tessa; De Juan Romero, Camino; Pilz, Gregor Alexander; Cappello, Silvia; Irmler, Martin; Sanz-Aquela, José Miguel; Beckers, Johannes et al. (25 de abril de 2013). «Trnp1 regulates expansion and folding of the mammalian cerebral cortex by control of radial glial fate». Cell 153 (3): 535-549. ISSN 1097-4172. PMID 23622239. doi:10.1016/j.cell.2013.03.027.
- ↑ de Juan Romero, Camino; Bruder, Carl; Tomasello, Ugo; Sanz-Anquela, José Miguel; Borrell, Víctor (14 de julio de 2015). «Discrete domains of gene expression in germinal layers distinguish the development of gyrencephaly». The EMBO Journal 34 (14): 1859-1874. ISSN 1460-2075. PMC 4547892. PMID 25916825. doi:10.15252/embj.201591176.
- ↑ Fernández, Virginia; Llinares-Benadero, Cristina; Borrell, Víctor (17 de mayo de 2016). «Cerebral cortex expansion and folding: what have we learned?». The EMBO Journal 35 (10): 1021-1044. ISSN 1460-2075. PMC 4868950. PMID 27056680. doi:10.15252/embj.201593701.
- ↑ a b Wang, L; Hou, S; Han, YG (23 de mayo de 2016). «Hedgehog signaling promotes basal progenitor expansion and the growth and folding of the neocortex». Nature Neuroscience 19 (7): 888-96. PMC 4925239. PMID 27214567. doi:10.1038/nn.4307.
- ↑ Chenn, A; Walsh, CA (19 de julio de 2002). «Regulation of cerebral cortical size by control of cell cycle exit in neural precursors». Science 297 (5580): 365-9. Bibcode:2002Sci...297..365C. PMID 12130776. doi:10.1126/science.1074192.
- ↑ Kuida, K; Haydar, TF; Kuan, CY; Gu, Y; Taya, C; Karasuyama, H; Su, MS; Rakic, P et al. (7 de agosto de 1998). «Reduced apoptosis and cytochrome c-mediated caspase activation in mice lacking caspase 9.». Cell 94 (3): 325-37. PMID 9708735. doi:10.1016/s0092-8674(00)81476-2.
- ↑ Noctor, SC; Flint, AC; Weissman, TA; Dammerman, RS; Kriegstein, AR (8 de febrero de 2001). «Neurons derived from radial glial cells establish radial units in neocortex.». Nature 409 (6821): 714-20. PMID 11217860. doi:10.1038/35055553.
- ↑ Malatesta, P; Hartfuss, E; Götz, M (Diciembre de 2000). «Isolation of radial glial cells by fluorescent-activated cell sorting reveals a neuronal lineage.». Development 127 (24): 5253-63. PMID 11076748.
- ↑ Rakic, P (8 de julio de 1988). «Specification of cerebral cortical areas». Science 241 (4862): 170-6. Bibcode:1988Sci...241..170R. PMID 3291116. doi:10.1126/science.3291116.
- ↑ Rash, BG; Lim, HD; Breunig, JJ; Vaccarino, FM (26 de octubre de 2011). «FGF signaling expands embryonic cortical surface area by regulating Notch-dependent neurogenesis.». The Journal of Neuroscience 31 (43): 15604-17. PMC 3235689. PMID 22031906. doi:10.1523/jneurosci.4439-11.2011.
- ↑ Noctor, SC; Martínez-Cerdeño, V; Ivic, L; Kriegstein, AR (Febrero de 2004). «Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases.». Nature Neuroscience 7 (2): 136-44. PMID 14703572. doi:10.1038/nn1172.
- ↑ Rakic, P (Mayo de 1972). «Mode of cell migration to the superficial layers of fetal monkey neocortex.». The Journal of Comparative Neurology 145 (1): 61-83. PMID 4624784. doi:10.1002/cne.901450105.
- ↑ LaMonica, BE; Lui, JH; Wang, X; Kriegstein, AR (Octubre de 2012). «OSVZ progenitors in the human cortex: an updated perspective on neurodevelopmental disease.». Current Opinion in Neurobiology 22 (5): 747-53. PMC 3402619. PMID 22487088. doi:10.1016/j.conb.2012.03.006.
- ↑ a b Hansen, DV; Lui, JH; Parker, PR; Kriegstein, AR (25 de marzo de 2010). «Neurogenic radial glia in the outer subventricular zone of human neocortex». Nature 464 (7288): 554-561. Bibcode:2010Natur.464..554H. PMID 20154730. doi:10.1038/nature08845.
- ↑ Hevner, RF; Haydar, TF (Febrero de 2012). «The (not necessarily) convoluted role of basal radial glia in cortical neurogenesis.». Cerebral Cortex 22 (2): 465-8. PMC 3256413. PMID 22116731. doi:10.1093/cercor/bhr336.
- ↑ García-Moreno, F; Vasistha, NA; Trevia, N; Bourne, JA; Molnár, Z (Febrero de 2012). «Compartmentalization of cerebral cortical germinal zones in a lissencephalic primate and gyrencephalic rodent.». Cerebral Cortex 22 (2): 482-92. PMID 22114081. doi:10.1093/cercor/bhr312.
- ↑ Striedter, GF; Srinivasan, S; Monuki, ES (8 de julio de 2015). «Cortical folding: when, where, how, and why?». Annual Review of Neuroscience 38: 291-307. PMID 25897870. doi:10.1146/annurev-neuro-071714-034128.
- ↑ Zilles, K; Armstrong, E; Moser, KH; Schleicher, A; Stephan, H (1989). «Gyrification in the cerebral cortex of primates.». Brain, Behavior and Evolution 34 (3): 143-50. PMID 2512000. doi:10.1159/000116500.
- ↑ Hevner, RF; Haydar, TF (Febrero de 2012). «The (not necessarily) convoluted role of basal radial glia in cortical neurogenesis.». Cerebral Cortex 22 (2): 465-8. PMC 3256413. PMID 22116731. doi:10.1093/cercor/bhr336.
- ↑ a b Mota, Bruno; Herculano-Houzel, Suzana (3 de julio de 2015). «Cortical folding scales universally with surface area and thickness, not number of neurons». Science (en inglés) 349 (6243): 74-77. Bibcode:2015Sci...349...74M. ISSN 0036-8075. PMID 26138976. doi:10.1126/science.aaa9101.
- ↑ Armstrong, E; Schleicher, A; Omran, H; Curtis, M; Zilles, K (1991). «The ontogeny of human gyrification.». Cerebral Cortex 5 (1): 56-63. PMID 7719130. doi:10.1093/cercor/5.1.56.
- ↑ a b c Budday, Silvia; Raybaud, Charles; Kuhl, Ellen (10 de julio de 2014). «A mechanical model predicts morphological abnormalities in the developing human brain». Scientific Reports (en inglés) 4: 5644. Bibcode:2014NatSR...4E5644B. PMC 4090617. PMID 25008163. doi:10.1038/srep05644.
- ↑ a b c Ross, M. Elizabeth; Walsh, Christopher A. (1 de enero de 2001). «Human Brain Malformations and Their Lessons for Neuronal Migration». Annual Review of Neuroscience 24 (1): 1041-1070. PMID 11520927. doi:10.1146/annurev.neuro.24.1.1041.
- ↑ Smith RS, Kenny CJ, Ganesh V, Jang A, Borges-Monroy R, Partlow JN, Hill RS, Shin T, Chen AY, Doan RN, Anttonen AK, Ignatius J, Medne L, Bönnemann CG, Hecht JL, Salonen O, Barkovich AJ, Poduri A, Wilke M, de Wit MC, Mancini GM, Sztriha L, Im K, Amrom D, Andermann E, Paetau R, Lehesjoki AE, Walsh CA, Lehtinen MK (Septiembre de 2018). «Sodium Channel SCN3A (NaV1.3) Regulation of Human Cerebral Cortical Folding and Oral Motor Development». Neuron 99 (5): 905-913.e7. PMC 6226006. PMID 30146301. doi:10.1016/j.neuron.2018.07.052.
- ↑ Wallace, Gregory L.; Robustelli, Briana; Dankner, Nathan; Kenworthy, Lauren; Giedd, Jay N.; Martin, Alex (1 de junio de 2013). «Increased gyrification, but comparable surface area in adolescents with autism spectrum disorders». Brain (en inglés) 136 (6): 1956-1967. ISSN 0006-8950. PMC 3673467. PMID 23715094. doi:10.1093/brain/awt106.
- ↑ Yang, Daniel Y.-J.; Beam, Danielle; Pelphrey, Kevin A.; Abdullahi, Sebiha; Jou, Roger J. (25 de enero de 2016). «Cortical morphological markers in children with autism: a structural magnetic resonance imaging study of thickness, area, volume, and gyrification». Molecular Autism (en inglés) 7 (1): 11. PMC 4727390. PMID 26816612. doi:10.1186/s13229-016-0076-x.
- ↑ Stahl, Ronny (2012). Identification and functional analysis of Trnp1: a novel DNA associated protein with a key role in neurogenesis. https://edoc.ub.uni-muenchen.de/15432/. pp. 86-88.
- ↑ Chen, Jason A.; Peñagarikano, Olga; Belgard, T. Grant; Swarup, Vivek; Geschwind, Daniel H. (1 de enero de 2015). «The Emerging Picture of Autism Spectrum Disorder: Genetics and Pathology». Annual Review of Pathology: Mechanisms of Disease 10 (1): 111-144. PMID 25621659. doi:10.1146/annurev-pathol-012414-040405.
- ↑ Levitt, Jennifer G.; Blanton, Rebecca E.; Smalley, Susan; Thompson, P. M.; Guthrie, Donald; McCracken, James T.; Sadoun, Tania; Heinichen, Laura et al. (1 de julio de 2003). «Cortical Sulcal Maps in Autism». Cerebral Cortex (en inglés) 13 (7): 728-735. ISSN 1047-3211. PMID 12816888. doi:10.1093/cercor/13.7.728.
- ↑ Palaniyappan, Lena; Mallikarjun, Pavan; Joseph, Verghese; White, Thomas P.; Liddle, Peter F. (2011). «Folding of the Prefrontal Cortex in Schizophrenia: Regional Differences in Gyrification». Biological Psychiatry 69 (10): 974-979. PMID 21257157. doi:10.1016/j.biopsych.2010.12.012.
- ↑ Nowakowski, TJ; Pollen, AA; Di Lullo, E; Sandoval-Espinosa, C; Bershteyn, M; Kriegstein, AR (5 de mayo de 2016). «Expression Analysis Highlights AXL as a Candidate Zika Virus Entry Receptor in Neural Stem Cells.». Cell Stem Cell 18 (5): 591-6. PMC 4860115. PMID 27038591. doi:10.1016/j.stem.2016.03.012.
- ↑ Li, C; Xu, D; Ye, Q; Hong, S; Jiang, Y; Liu, X; Zhang, N; Shi, L; Qin, CF; Xu, Z (11 de mayo de 2016). «Zika Virus Disrupts Neural Progenitor Development and Leads to Microcephaly in Mice». Cell Stem Cell 19 (1): 120-6. PMID 27179424. doi:10.1016/j.stem.2016.04.017.
- ↑ Wu, Kong-Yan; Zuo, Guo-Long; Li, Xiao-Feng; Ye, Qing; Deng, Yong-Qiang; Huang, Xing-Yao; Cao, Wu-Chun; Qin, Cheng-Feng et al. (13 de mayo de 2016). «Vertical transmission of Zika virus targeting the radial glial cells affects cortex development of offspring mice». Cell Research (en inglés) 26 (6): 645-654. ISSN 1748-7838. PMC 4897185. PMID 27174054. doi:10.1038/cr.2016.58.
- ↑ Tang, Hengli; Hammack, Christy; Ogden, Sarah C.; Wen, Zhexing; Qian, Xuyu; Li, Yujing; Yao, Bing; Shin, Jaehoon et al. (5 de mayo de 2016). «Zika Virus Infects Human Cortical Neural Progenitors and Attenuates Their Growth». Cell Stem Cell (en inglés) 18 (5): 587-590. ISSN 1934-5909. PMC 5299540. PMID 26952870. doi:10.1016/j.stem.2016.02.016.
- ↑ Zilles, Karl; Armstrong, Este; Schleicher, Axel; Kretschmann, Hans-Joachim (1 de noviembre de 1988). «The human pattern of gyrification in the cerebral cortex». Anatomy and Embryology (en inglés) 179 (2): 173-179. ISSN 0340-2061. doi:10.1007/BF00304699.
- ↑ Madan, Christopher R.; Kensinger, Elizabeth A. (1 de julio de 2016). «Cortical complexity as a measure of age-related brain atrophy». NeuroImage (en inglés) 134: 617-629. ISSN 1053-8119. PMC 4945358. PMID 27103141. doi:10.1016/j.neuroimage.2016.04.029.
- ↑ «LGI - Free Surfer Wiki». surfer.nmr.mgh.harvard.edu. Consultado el 2 de mayo de 2018.
- ↑ Schaer, M.; Cuadra, M.B.; Tamarit, L.; Lazeyras, F.; Eliez, S.; Thiran, J.-P. (Febrero de 2008). «A Surface-Based Approach to Quantify Local Cortical Gyrification». IEEE Transactions on Medical Imaging (en inglés estadounidense) 27 (2): 161-170. ISSN 0278-0062. PMID 18334438. doi:10.1109/tmi.2007.903576.
Enlaces externos
- Esta obra contiene una traducción derivada de «Gyrification» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
 Wikimedia Commons alberga una categoría multimedia sobre Girificación.
Wikimedia Commons alberga una categoría multimedia sobre Girificación.

