Etoxido de tántalo(V)
| Etoxido de tántalo(V) | ||
|---|---|---|
| General | ||
| Fórmula estructural |
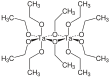 | |
| Fórmula molecular | Ta2(OC2H5)10 | |
| Identificadores | ||
| Número CAS | 6074-84-6[1] | |
| ChemSpider | 21169490 | |
| PubChem | 2733710 | |
| Propiedades físicas | ||
| Masa molar | 406,1181947 g/mol | |
El etóxido de tántalo (V) es un compuesto metalorgánico de fórmula Ta2(OC2H5)10, a menudo abreviado como Ta2(OEt)10. Es un sólido incoloro que se disuelve en algunos disolventes orgánicos, pero se hidroliza con facilidad.[2] Se utiliza para preparar películas de óxido de tántalo(V).
Estructura[editar]
Los alcóxidos de tántalo(V) existen típicamente como dímeros[3]con centros metálicos octaédricos de tántalo de seis coordenadas.[4]Análisis cristalográficos posteriores establecieron que el metóxido y los isopropóxidos de niobio adoptan estructuras bioctaédricas.[5][6]Desde una perspectiva geométrica, los diez átomos de oxígeno del ligando etoxido de la molécula Ta2(OEt)10 en disolución definen un par de octaedros que comparten una arista común con los dos átomos de tántalo situados en sus centros.[5]Desde una perspectiva de enlace, cada centro de tántalo está rodeado octaédricamente por cuatro ligandos etoxido monodentados y dos ligandos puente. Los átomos de oxígeno de los etóxidos puente están unidos a ambos centros de tántalo, y estos dos ligandos son cis entre sí dentro de la esfera de coordinación. La fórmula [(EtO)4Ta(μ-OEt)]2 representa de forma más completa esta estructura dimérica, aunque la fórmula simplificada se utiliza habitualmente para la mayoría de los fines.
Preparación[editar]

Se conocen varios métodos para preparar el etóxido de tántalo (V). La metátesis salina a partir de cloruro de tántalo (V) suele ser la más eficaz. El pentacloruro de tántalo, Ta2Cl10, proporciona un punto de partida conveniente. Para evitar la generación de especies mixtas de cloruro y etóxido, se suele añadir una base como el amoníaco para atrapar el HCl liberado:[7]
10 EtOH + Ta2Cl10 + 10 NH3 → Ta2(OEt)10 + 10 NH4Cl
También se puede utilizar la metátesis salina utilizando un alcóxido de metal alcalino:[7]
10 NaOEt + Ta2Cl10 → Ta2(OEt)10 + 10 NaCl
El mismo compuesto puede prepararse electroquímicamente.[5] [8]Las dos semiecuaciones y la ecuación global[8] para esta reacción son:
- cátodo: 2 EtOH + 2 e− → 2 EtO− + H2
- ánodo: Ta → "Ta5+" + 5 e−
- global: 2 Ta + 10 EtOH → 2 "Ta5+" + 10 EtO− + 5 H2 → Ta2(OEt)10 + 5 H2
La producción comercial de etóxido de tántalo (V) mediante este método electroquímico se ha empleado en Rusia.[8] El compuesto también puede prepararse por reacción directa del metal de tántalo con etanol, en cuyo caso la ecuación general es la misma que la mostrada anteriormente para el método electroquímico.[7]
Desde la década de 1970, Bayer de Alemania había estado produciendo etoxido de tántalo (V) en Leverkusen, sin embargo, tras la disolución de Bayer, la producción se trasladó a Heraeus. Por su parte, Inorgtech (posteriormente MultiValent) inició la producción en 1974 en Cambridge (Reino Unido). Ambas rutas implicaban la reacción directa del cloruro metálico con alcohol en presencia de disolventes para obtener un producto con una pureza superior al 99,999%.
Reacciones[editar]
La reacción más importante de los alcóxidos de tántalo es la hidrólisis para producir películas y geles de óxidos de tántalo. Aunque estas reacciones son complejas, la formación de una película de óxido de tántalo(V) por hidrólisis[2] puede describirse mediante esta ecuación simplificada:
- Ta2(OC2H5)10 + 5 H2O → Ta2O5 + 10 C2H5OH
Los revestimientos ópticos de etóxido de tántalo(V) pueden producirse por deposición química en fase vapor a baja presión.[9] A presiones tan bajas como 1,33 mPa y temperaturas de 700 °C, se deposita primero una película de sílice de la profundidad deseada mediante la descomposición de tetraetoxisilano, Si(OEt)4, o di-t-butioxidiacetoxisilano, Si(OC(CH3)3)2(OOCCH3)2, y después se introduce el etóxido de tántalo(V).[9] Como en el caso del etóxido de niobio(V), el precursor de etóxido se descompone térmicamente para producir la capa de óxido con la consiguiente liberación de éter dietílico:
Ta2(OEt)10 → Ta2O5 + 5 Et–O–Et
La pirólisis también produce una película de óxido de tántalo (V) por deposición química de vapor, en cuyo caso el etóxido de tántalo (V) se oxida completamente, produciendo dióxido de carbono y vapor de agua:[10]
Ta2(OC2H5)10 + 30 O2 → Ta2O5 + 20 CO2 + 25 H2O
Las películas amorfas de óxido de tántalo(V) también pueden prepararse mediante deposición en capas atómicas o mediante una técnica de deposición química en fase vapor pulsada en la que se aplican alternativamente etoxido de tántalo(V) y cloruro de tántalo(V).[11] A temperaturas cercanas a los 450 °C, las películas producidas tienen índices de refracción y propiedades de permitividad similares a las producidas a partir de enfoques convencionales.[11]La preparación de estas películas se produce con la pérdida de cloroetano:[11]
Ta2(OC2H5)10 + Ta2Cl10 → 2 Ta2O5 + 10 C2H5Cl
El procesamiento sol-gel también produce películas finas de óxido de tántalo(V)[12] utilizando un enfoque químico similar. También se han desarrollado rutas sol-gel que utilizan etóxido de tántalo(V) para generar materiales de perovskita en capas.[13]
Aplicaciones[editar]
Se utiliza principalmente para la fabricación de materiales de capa fina de óxido de tántalo(V) mediante enfoques que incluyen la deposición química de vapor,[9]la deposición atómica de capas,[11] y el procesamiento sol-gel.[12] Estos materiales tienen aplicaciones semiconductoras,[11]electrocrómicas,[14] y ópticas.[9]
Las películas de óxido de tántalo(V) tienen diversas aplicaciones, como películas ópticas con índices de refracción de hasta 2,039[15]y como material dieléctrico de película fina en memorias dinámicas de acceso aleatorio y transistores semiconductores de efecto de campo.[11] El método elegido para la preparación de estos materiales viene determinado por las propiedades deseadas. La hidrólisis directa es apropiada cuando la presencia de agua residual o el uso de altas temperaturas para el secado son aceptables. Los micropatrones pueden producirse mediante deposición selectiva por sitios utilizando el método de hidrólisis mediante la formación de una monocapa autoensamblada seguida de un recocido a alta temperatura.[16]La deposición química en fase vapor permite controlar el grosor de la película a escala nanométrica, lo que resulta esencial para algunas aplicaciones. La pirólisis directa es conveniente para aplicaciones ópticas,[9]en las que son importantes los materiales transparentes con baja pérdida de luz por absorción,[15] y también se ha utilizado para preparar memorias de sólo lectura de nitruro.[10] El electrocromismo es la propiedad de algunos materiales de cambiar de color cuando se les aplica una carga,[17]y es el medio por el que funciona el llamado vidrio inteligente. Las películas producidas por hidrólisis de óxido de tántalo (V) se han utilizado para preparar películas amorfas de óxido de tántalo (V) adecuadas para aplicaciones electrocrómicas.[14]
También se han preparado películas finas de metales mixtos a partir de este compuesto. Por ejemplo, las películas de tantalato de litio, LiTaO3, son deseables por sus propiedades ópticas no lineales y se han preparado haciendo reaccionar primero el etoxido de tantalio(V) con dipivaloilmetanato de litio, LiCH(COC(CH3)3)2, para preparar un precursor adecuado para la epitaxia metalorgánica en fase vapor (una forma de deposición química en fase vapor). [18] También se han preparado películas de tantalato de estroncio, Sr(TaO3)2, utilizando métodos de deposición de capas atómicas y se han investigado sus propiedades.[19]
El etóxido de tantalio(V) se condensa con ácidos carboxílicos para dar oxoalcoxido-carboxilatos, por ejemplo, Ta4O4(OEt)8(OOCCH3)4.[7] El núcleo de Ta4O4 de tales compuestos forma un cúmulo de tipo cubano.
Referencias[editar]
- ↑ Número CAS
- ↑ a b Lide, David R., ed. (2006). CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data (87. ed., 2006-2007 edición). CRC, Taylor & Francis. ISBN 978-0-8493-0487-3.
- ↑ Bradley, D. C.; Holloway, C. E. (1968). «Nuclear Magnetic Resonance Studies on Niobium and Tantalum Penta-alkoxides». J. Chem. Soc. A: 219-223. S2CID 98638647. doi:10.1039/J19680000219.
- ↑ Bradley, D. C.; Holloway, H. (1961). «Metal Oxide Alkoxide Polymers: Part II. The Hydrolysis Of Tantalum Pentaethoxide». Can. J. Chem. 39 (9): 1818-1826. doi:10.1139/v61-239.
- ↑ a b c Turova, N. Y.; Korolev, A. V.; Tchebukov, D. E.; Belokon, A. I.; Yanovsky, A. I.; Struchkov, Y. T. (1996). «Tantalum(V) Alkoxides: Electrochemical Synthesis, Mass-Spectral Investigation and Oxoalkoxocomplexes». Polyhedron 15 (21): 3869-3880. doi:10.1016/0277-5387(96)00092-7.
- ↑ Mehrotra, Ram C.; Singh, Anirudh (1997). «Recent Trends in Metal Alkoxide Chemistry». En Karlin, Kenneth D., ed. Progress in Inorganic Chemistry 46. John Wiley & Sons. pp. 239-454. ISBN 9780470167045. doi:10.1002/9780470166475.ch4.
- ↑ a b c d Schubert, U. (2003). «Sol–Gel Processing of Metal Compounds». En McCleverty, J. A.; Meyer, T. J., eds. Comprehensive Coordination Chemistry II. Reference Module in Chemistry, Molecular Sciences and Chemical Engineering 7. Pergamon. pp. 629-656. ISBN 978-0-12-409547-2. doi:10.1016/B0-08-043748-6/06213-7.
- ↑ a b c Bradley, Don C.; Mehrotra, Ram C.; Rothwell, Ian P.; Singh, A. (2001). Alkoxo and Aryloxo Derivatives of Metals. San Diego: Academic Press. p. 18. ISBN 978-0-08-048832-5.
- ↑ a b c d e Baumeister, P. W. (2004). Optical Coating Technology. SPIE Press. p. 7. ISBN 9780819453136.
- ↑ a b US patent 6461949, Chang, K. K. & Chen, C.-H., "Method For Fabricating A Nitride Read-Only-Memory (NROM)", issued 2002-10-08, assigned to Macronix International Co. Ltd.
- ↑ a b c d e f Kukli, K.; Ritala, M.; Leskelä, M. (2000). «Atomic Layer Deposition and Chemical Vapor Deposition of Tantalum Oxide by Successive and Simultaneous Pulsing of Tantalum Ethoxide and Tantalum Chloride». Chem. Mater. 12 (7): 1914-1920. doi:10.1021/cm001017j.
- ↑ a b Winter, S.; Velten, D.; Aubertin, F.; Hoffmann, B.; Heidenau, F.; Ziegler, G. (2008). «Chemical Surface Modifications». En Breme, J.; Kirkpatrick, C. J.; Thull, R., eds. Metallic Biomaterial Interfaces. John Wiley & Sons. p. 51. ISBN 9783527318605.
- ↑ Nalwa, H. S. (2001). Handbook of Advanced Electronic and Photonic Materials and Devices: Chalcogenide Glasses and Sol-Gel Materials. Academic Press. p. 208. ISBN 9780125137553.
- ↑ a b Tepehan, F. Z.; Ghodsi, F. E.; Ozer, N.; Tepehan, G. G. (1999). «Optical Properties Of Sol-Gel Dip-Coated Ta2O5 Films For Electrochromic Applications». Solar Energy Materials and Solar Cells 59 (3): 265-275. doi:10.1016/S0927-0248(99)00041-0.
- ↑ a b Oubaha, M.; Elmaghrum, S.; Copperwhite, R.; Corcoran, B.; McDonagh, C.; Gorin, A. (2012). «Optical Properties of High Refractive Index Thin Films Processed at Low-Temperature». Opt. Mater. 34 (8): 1366-1370. Bibcode:2012OptMa..34.1366O. doi:10.1016/j.optmat.2012.02.023.
- ↑ Masuda, Y.; Wakamatsu, S.; Koumoto, K. (2004). «Site-Selective Deposition And Micropatterning Of Tantalum Oxide Thin Films Using A Monolayer». J. Eur. Ceram. Soc. 24 (2): 301-307. doi:10.1016/S0955-2219(03)00230-9.
- ↑ Mortimer, R. J. (2011). «Electrochromic Materials». Annual Review of Materials Research 41 (Pt 3): 241-268. Bibcode:2011AnRMS..41..241M. PMC 10361188. PMID 12449538. doi:10.1146/annurev-matsci-062910-100344.
- ↑ Wernberg, A. A.; Braunstein, G.; Paz-Pujalt, G.; Gysling, H. J.; Blanton, T. N. (1993). «Solid-Phase Epitaxial-Growth Of Lithium Tantalate Thin-Films Deposited By Spray-Metalorganic Chemical-Vapor-Deposition». Appl. Phys. Lett. 63 (3): 331-333. Bibcode:1993ApPhL..63..331W. doi:10.1063/1.110061.
- ↑ Lee, W. J.; You, I. K.; Ryu, S. O.; Yu, B. G.; Cho, K. I.; Yoon, S. G.; Lee, C. S. (2001). «SrTa2O6 Thin Films Deposited By Plasma-Enhanced Atomic Layer Deposition». Jpn. J. Appl. Phys. 40 (12): 6941-6944. Bibcode:2001JaJAP..40.6941L. S2CID 94199325. doi:10.1143/JJAP.40.6941.
Enlaces externos[editar]
- Esta obra contiene una traducción derivada de «Tantalum(V) ethoxide» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
