Deposición de capas atómicas
La deposición de capas atómicas (ALD por sus siglas en inglés) es una técnica de deposición de películas finas basada en el uso secuencial de un proceso químico en fase gaseosa; es una subclase de la deposición química en fase vapor. La mayoría de las reacciones de ALD utilizan dos sustancias químicas llamadas precursores (también denominadas "reactantes"). Estos precursores reaccionan con la superficie de un material de uno en uno de forma secuencial y autolimitada. Una fina película se deposita lentamente mediante la exposición repetida a los distintos precursores. La ALD es un proceso clave en la fabricación de dispositivos semiconductores y forma parte del conjunto de herramientas para sintetizar nanomateriales.
Introducción[editar]

Durante el proceso de deposición de capas atómicas, se forma una película sobre un sustrato exponiendo su superficie a especies gaseosas alternas (normalmente denominadas precursores o reactivos). A diferencia de la deposición química en fase vapor, los precursores nunca están presentes simultáneamente en el reactor, sino que se introducen como una serie de pulsos secuenciales no solapados. En cada uno de estos pulsos, las moléculas precursoras reaccionan con la superficie de forma autolimitada, de modo que la reacción termina cuando se consumen todos los sitios disponibles en la superficie. Por consiguiente, la cantidad máxima de material depositado en la superficie tras una única exposición a todos los precursores (lo que se denomina ciclo ALD) viene determinada por la naturaleza de la interacción precursor-superficie.[1][2] Variando el número de ciclos es posible cultivar materiales de manera uniforme y con gran precisión en sustratos arbitrariamente complejos y grandes.
ALD es un método de deposición con un gran potencial para producir películas muy finas y conformadas con control del espesor y la composición de las películas posible a nivel atómico. Una de las principales razones del reciente interés por este método son las posibilidades que ofrece para reducir la escala de los dispositivos microelectrónicos de acuerdo con la ley de Moore. El ALD es un campo de investigación muy activo, con cientos de procesos diferentes publicados en la literatura científica,[3][2] [4]aunque algunos de ellos presentan comportamientos que se alejan del proceso ALD ideal.[4] Actualmente existen varios artículos de revisión exhaustivos que ofrecen un resumen de los procesos ALD publicados, entre los que se incluyen los trabajos de Puurunen,[5] Miikkulainen et al, [4] Knoops et al.,[6]y Mackus & Schneider et al.[7] También está disponible en línea una base de datos interactiva de procesos ALD impulsada por la comunidad[8] que genera una visión general actualizada en forma de tabla periódica anotada.
La técnica hermana de la deposición de capas atómicas, la deposición de capas moleculares (LDM), utiliza precursores orgánicos para depositar polímeros. Combinando las técnicas ALD/(LDM, es posible fabricar películas híbridas altamente conformadas y puras para muchas aplicaciones.
Otra tecnología relacionada con la ALD es la síntesis por infiltración secuencial (SIS), que utiliza exposiciones alternas de vapores precursores para infiltrar y modificar polímeros. La SIS también se conoce como infiltración en fase vapor (VPI) e infiltración en fase vapor secuencial (SVI).
Mecanismos de reacción superficial[editar]
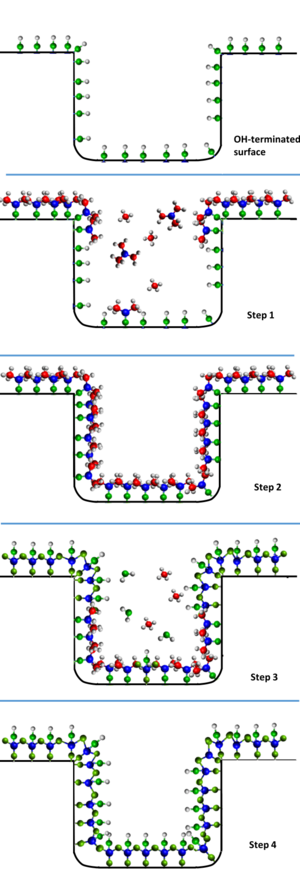
En un proceso ALD prototípico, un sustrato se expone a dos reactivos A y B de forma secuencial y no solapada. A diferencia de otras técnicas, como la deposición química en fase vapor (CVD), en las que el crecimiento de la capa fina se produce de forma continua, en el proceso ALD cada reactivo reacciona con la superficie de forma autolimitada: las moléculas reactivas sólo pueden reaccionar con un número finito de sitios reactivos de la superficie. Una vez que se han consumido todos esos sitios en el reactor, el crecimiento se detiene. Las moléculas reactivas restantes se eliminan y sólo entonces se introduce el reactivo B en el reactor. Mediante exposiciones alternas de A y B, se deposita una fina película. Este proceso se muestra en la figura lateral. Por consiguiente, cuando se describe un proceso ALD se hace referencia tanto a los tiempos de dosis (el tiempo que una superficie está expuesta a un precursor) como a los tiempos de purga (el tiempo que transcurre entre las dosis para que el precursor evacúe la cámara) para cada precursor. La secuencia dosis-purga-dosis-purga de un proceso ALD binario constituye un ciclo ALD. Además, en lugar de utilizar el concepto de tasa de crecimiento, los procesos de ALD se describen en términos de su crecimiento por ciclo.[9]
En ALD, debe dejarse el tiempo suficiente en cada paso de la reacción para que pueda alcanzarse una densidad de adsorción completa. Cuando esto ocurre, el proceso ha alcanzado la saturación. Este tiempo dependerá de dos factores clave: la presión del precursor y la probabilidad de adherencia.[10] Por tanto, la tasa de adsorción por unidad de superficie puede expresarse como:
Donde R es la tasa de adsorción, S es la probabilidad de adherencia y F es el flujo molar incidente.[11] Sin embargo, una característica clave del ALD es que la S cambiará con el tiempo, a medida que más moléculas hayan reaccionado con la superficie esta probabilidad de adherencia será menor hasta alcanzar un valor de cero una vez alcanzada la saturación.
Los detalles específicos sobre los mecanismos de reacción dependen en gran medida del proceso ALD concreto. Con cientos de procesos disponibles para depositar óxidos, metales, nitruros, sulfuros, calcogenuros y materiales fluorados,[4]el desentrañamiento de los aspectos mecanísticos de los procesos ALD es un campo de investigación activo.[12] A continuación se muestran algunos ejemplos representativos.
ALD térmica[editar]

La ALD térmica requiere temperaturas que oscilan entre la temperatura ambiente (~20 °C) y los 350 °C para el intercambio de ligandos o las reacciones superficiales de tipo combustión.[13] Se produce mediante reacciones superficiales, lo que permite un control preciso del espesor independientemente de la geometría del sustrato (sujeto a la relación de aspecto) y del diseño del reactor.[1]
La síntesis de Al2O3 a partir de trimetilaluminio (TMA) y agua es uno de los ejemplos de ALD térmico más conocidos. Durante la exposición al TMA, el TMA se quimisorbe disociativamente en la superficie del sustrato y el TMA restante se bombea fuera de la cámara. La quimisorción disociativa del TMA deja una superficie cubierta de AlCH3. A continuación, la superficie se expone a vapor de H2O, que reacciona con el -CH3 superficial formando CH4 como subproducto de la reacción y dando lugar a una superficie de Al2O3 hidroxilada.[1]
ALD asistido por plasma[editar]
En el ALD asistido por plasma (PA-ALD), la alta reactividad de las especies de plasma permite reducir la temperatura de deposición sin comprometer la calidad de la película; además, se puede utilizar una gama más amplia de precursores y, por tanto, se puede depositar una gama más amplia de materiales en comparación con el ALD térmico.[1]
ALD espacial[editar]

En la ALD temporal, las dosis separadas de precursor y co-reactivo se separan en el tiempo mediante un paso de purga. En cambio, en el ALD espacial (s-ALD), estos gases se suministran en lugares diferentes, por lo que están separados en el espacio. En la s-ALD a presión atmosférica, el precursor y el co-reactivo se suministran de forma continua y están separados entre sí por una cortina de gas para evitar reacciones en fase gaseosa. Dicha cortina de gas suele consistir en posiciones de inyección y escape de nitrógeno (véase la figura 1). A medida que un sustrato se desplaza por las distintas zonas de gas, se producen reacciones autolimitadas en la superficie del sustrato y tiene lugar el proceso de ALD. Dado que este proceso puede acelerarse fácilmente, la tasa de deposición para ALD espacial puede ser mucho mayor que para ALD convencional. Por ejemplo, para el ALD de Al2O3, la velocidad de deposición pasa de 100-300 nm por hora a 60 nm por minuto.[5]
La naturaleza en línea del ALD espacial lo hace adecuado para líneas de producción de gran volumen y producción rollo a rollo. En general, el s-ALD se ha empleado para aplicar barreras de permeación de humedad, capas de pasivación en células solares de silicio y capas funcionales en baterías. La química de los procesos ALD espaciales es comparable a la de los procesos ALD temporales típicos, y los materiales que se han explorado incluyen óxidos metálicos inorgánicos como Al2O3, ZnO (dopado con Al o Ga), SiO2, In2O3, InZnO, LIPON, Zn(O,S), SnOx y TiOx ,pero también pueden depositarse metales PMG (Pt, Ir, Ru). Además, las moléculas orgánicas pueden crecer en combinación con átomos inorgánicos para permitir la deposición de capas moleculares (MLD). Se ha demostrado la ALD espacial mejorada con plasma u ozono, que suele reducir las temperaturas de deposición necesarias.
ALD fotoasistida[editar]
En esta variedad de ALD, se utiliza luz UV para acelerar las reacciones superficiales en el sustrato. De este modo, la temperatura de reacción puede reducirse, como en el ALD asistido por plasma. En comparación con el ALD asistido por plasma, la activación es más débil, pero suele ser más fácil de controlar ajustando la longitud de onda, la intensidad y el momento de la iluminación.[1]
ALD de metal[editar]
El ALD de cobre metálico ha atraído mucha atención debido a la demanda de cobre como material de interconexión y a la relativa facilidad con la que el cobre puede depositarse térmicamente.[14] El cobre tiene un potencial electroquímico estándar positivo[15] y es el metal que se reduce más fácilmente de los metales de transición de la primera fila. Por ello, se han desarrollado numerosos procesos de ALD, incluyendo varios que utilizan gas hidrógeno como reactivo principal[14][16]Idealmente, el ALD de cobre metálico debería realizarse a ≤100 °C para conseguir películas continuas con baja rugosidad superficial,[17]ya que temperaturas más altas pueden provocar la aglomeración del cobre depositado.[18]
Algunos metales pueden crecer por ALD mediante reacciones de eliminación de fluorosilano utilizando un haluro metálico y un precursor de silicio (por ejemplo, SiH4, Si2H6) como reactivos. Estas reacciones son muy exotérmicas debido a la formación de enlaces estables Si-F.[12] Entre los metales depositados por eliminación de fluorosilano se incluyen el wolframio[19] y el molibdeno.[20] Como ejemplo, las reacciones superficiales para ALD de wolframio metálico utilizando WF6 y Si2H6 como reactivos pueden expresarse como.[19][21]
- WSiF2H* + WF6 → WWF5* + SiF3H
- WF5* + Si2H6 → WSiF2H* + SiF3H + 2 H2
- La reacción global de ALD es[12]
WF6 + Si2H6 → W + SiF3H + 2 H2, ∆H = –181 kcal
La velocidad de crecimiento puede variar de 4 a 7 Å/ciclo dependiendo de la temperatura de deposición (177 a 325 °C) y de la exposición del reactivo Si2H6 (~104 a 106 L), factores que pueden influir en la inserción del Si2H6 en los enlaces Si-H[22][23]y dar lugar a una contribución del silicio CVD al crecimiento ALD del wolframio.
El ALD térmico de muchos otros metales es un reto (o actualmente imposible) debido a sus potenciales electroquímicos muy negativos. Recientemente, la aplicación de nuevos agentes reductores fuertes ha dado lugar a los primeros informes sobre procesos de ALD térmico a baja temperatura para varios metales electropositivos. El cromo metálico se depositó utilizando un precursor de alcóxido de cromo y BH3(NHMe2).[24]Los metales titanio y estaño se cultivaron a partir de sus respectivos cloruros metálicos (MCl4, M = Ti, Sn) y un compuesto de anillo bis(trimetilsililo) de seis miembros.[25] [26]El aluminio metálico se depositó utilizando un precursor de dihidruro de aluminio y AlCl3.[27]
ALD de SiO2 catalizada[editar]

El uso de catalizadores es de vital importancia para conseguir métodos fiables de ALD del SiO2. Sin catalizadores, las reacciones superficiales que conducen a la formación de SiO2 suelen ser muy lentas y sólo se producen a temperaturas excepcionalmente altas. Los catalizadores típicos para la ALD de SiO2 incluyen bases de Lewis como NH3 o piridina y SiO2; la ALD también puede iniciarse cuando estas bases de Lewis se acoplan con otros precursores de silicio como el tetraetoxisilano (TEOS).[12]Se cree que el enlace de hidrógeno se produce entre la base de Lewis y la especie superficial SiOH* o entre el reactivo basado en H2O y la base de Lewis. El oxígeno se convierte en un nucleófilo más fuerte cuando la base de Lewis se une por enlace de hidrógeno con la especie superficial SiOH* porque el enlace SiO-H se debilita de forma efectiva. Como tal, el átomo de Si electropositivo del reactivo SiCl4 es más susceptible al ataque nucleofílico. Del mismo modo, el enlace de hidrógeno entre una base de Lewis y un reactivo H2O hace que el O electronegativo del H2O sea un nucleófilo fuerte capaz de atacar al Si en una especie superficial de SiCl* existente.[28]El uso de un catalizador de base de Lewis es más o menos un requisito para la ALD del SiO2, ya que sin un catalizador de base de Lewis, las temperaturas de reacción deben superar los 325 °C y las presiones deben superar los 103 torr. Generalmente, la temperatura más favorable para realizar la ALD del SiO2 es a 32 °C y una velocidad de deposición común es de 1,35 angstroms por secuencia de reacción binaria. A continuación se presentan dos reacciones superficiales para la ALD del SiO2, una reacción global y un esquema que ilustra la catálisis de la base de Lewis en la ALD de SiO2.Aplicaciones
- Reacciones primarias en la superficie:
- SiOH* + SiCl4 → SiOSiCl3* + HCl
- SiCl* + H2O → SiOH* + HCl
- Reacción global ALD:
- SiCl4 + 2H2O → SiO2 + 4 HCl
| Tipo de ALD | Temperatura | Precursores viables | Reactantes | Aplicaciones |
|---|---|---|---|---|
| ALD catalítica | >32 °C con catalizador de base Lewis[12] | Óxidos metálicos (es decir TiO2 ZrO2,SnO2)[12] | (Metal)Cl4, H2O[12] | Capas de alto k-dieléctrico, capas protectoras, capas antirreflectantes, etc.[12] |
| Al2O3 ALD | 30–300 °C | Al2O3, óxidos metálicos [29] | (Metal)Cl4, H2O, Ti(OiPr)4, (Metal)(Et)2[12] | Capas dieléctricas, capas aislantes, etc., pasivaciones superficiales de células solares[12] |
| ALD de metales mediante química térmica | 175–400 °C[30] | Fluoruros metálicos, organometálicos, metales catalíticos[30] | M(C5H5)2, (CH3C5H4)M(CH3)3, Cu(thd)2, Pd(hfac)2, Ni(acac)2, H2[30] | Vías conductoras, superficies catalíticas, dispositivos MOS[30] |
| ALD en polímeros | 25–100 °C[12] | Polímeros comunes (polietileno, PMMA, PP, PS, PVC, PVA, etc.)[12] | Al(CH3)3, H2O, M(CH3)3[12] | Funcionalización de superficies poliméricas, creación de compuestos, barreras de difusión, etc.[12] |
| ALD en partículas | 25-100 °C para partículas de polímero, 100-400 °C
para partículas de metal/aleación[12] |
BN, ZrO2, CNTs, partículas poliméricas | Gases diversos: Los reactores de lecho fluidizado se utilizan para permitir el recubrimiento de partículas individuales[12] | Deposición de revestimientos protectores y aislantes, modificación de propiedades ópticas y mecánicas, formación de estructuras compuestas, medios conductores |
| ALD mejorada por plasma o radicales para materiales ALD de un solo elemento | 20–800 °C[12][31] | Metales puros (por ej. Ta, Ti, Si, Ge, Ru, Pt), nitruros metálicos, (por ej. TiN, TaN, etc.)[12] | Organometálicos, MH2Cl2, terbutilimidotris(dietilamido)tántalo (TBTDET), bis(etilciclopentadienil)rutenio), NH3[12] | Estructuras DRAM, dispositivos MOSFET y semiconductores, condensadores[32] |
| ALD mejorada por plasma de óxidos y nitruros metálicos | 20–300 °C | Al2O3, SiO2, ZnOx, InOx, HfO2, SiNx, TaNx[33][34][35] | Similar a la ALD térmica |
Aplicaciones[editar]
Aplicaciones microelectrónicas[editar]
La ALD es un proceso útil para la fabricación de microelectrónica debido a su capacidad para producir espesores precisos y superficies uniformes, además de la producción de películas de alta calidad utilizando varios materiales diferentes. En microelectrónica, La ALD se estudia como una técnica potencial para depositar óxidos de puerta de altaκ (alta permitividad), dieléctricos de condensador de memoria de alta κ, ferroeléctricos y metales y nitruros para electrodos e interconexiones. En el caso de los óxidos de puerta de alta k, en los que es esencial el control de las películas ultrafinas, es probable que la técnica ALD no comience a utilizarse hasta la tecnología de 45 nm. En las metalizaciones, se requieren películas conformadas; actualmente se espera que la ALD se utilice en la producción general en el nodo de 65 nm. En las memorias dinámicas de acceso aleatorio (DRAM), los requisitos de conformalidad son aún mayores y ALD es el único método que puede utilizarse cuando el tamaño de las características es inferior a 100 nm. Algunos de los productos que utilizan ALD son los cabezales de grabación magnética, las pilas de compuertas MOSFET, los condensadores DRAM, las memorias ferroeléctricas no volátiles y muchos otros.
Óxidos de puerta[editar]
El depósito de los óxidos de alta kp Al2O3, ZrO2 y HfO2 ha sido una de las áreas de ALD que más se han estudiado. La motivación de los óxidos de alta κ proviene del problema de la elevada corriente túnel que atraviesa el dieléctrico de puerta de SiO2 utilizado habitualmente en los MOSFET cuando se reduce a un grosor de 1,0 nm o inferior. Con el óxido de alta κ, se puede fabricar un dieléctrico de puerta más grueso para la densidad de capacitancia requerida, con lo que se puede reducir la corriente de túnel a través de la estructura.
Nitruros de metales de transición[editar]
Los nitruros de metales de transición, como el TiN y el TaN, pueden utilizarse como barreras metálicas y como metales de puerta. Las barreras metálicas se utilizan para recubrir las interconexiones de cobre utilizadas en los circuitos integrados modernos para evitar la difusión del Cu en los materiales circundantes, como los aislantes y el sustrato de silicio, y también, para evitar la contaminación del Cu por elementos que se difunden desde los aislantes rodeando cada interconexión de Cu con una capa de barreras metálicas. Las barreras metálicas tienen requisitos estrictos: deben ser puras, densas, conductoras, conformadas, finas y tener una buena adherencia a los metales y aislantes. Los requisitos relativos a la técnica de proceso pueden cumplirse mediante ALD. El nitruro ALD más estudiado es el TiN, que se deposita a partir de TiCl4 y NH3.[36]
Películas metálicas[editar]
Las motivaciones de un interés en ALD de metal son:
- Interconexiones de Cu y tapones de W, o al menos capas semilla de Cu para electrodeposición de Cu[37] y semillas de W para CVD de W,
- nitruros de metales de transición (por ejemplo, TiN, TaN, WN) para barreras de interconexión de Cu
- metales nobles para memorias ferroeléctricas de acceso aleatorio (FRAM) y electrodos de condensadores DRAM
- metales de alta y baja función de trabajo para MOSFET de doble puerta.
Cabezales de grabación magnética[editar]
Los cabezales de grabación magnética utilizan campos eléctricos para polarizar partículas y dejar un patrón magnetizado en un disco duro. El ALD de Al2O3 se utiliza para crear capas uniformes y finas de aislamiento.[38] El ALD permite controlar el grosor del aislamiento con gran precisión.[39] Esto permite obtener patrones más precisos de partículas magnetizadas y, por tanto, grabaciones de mayor calidad.
Condensadores DRAM[editar]
Los condensadores DRAM son otra aplicación de ALD. Una célula DRAM puede almacenar un solo bit de datos y consta de un transistor MOS y un condensador. Se están realizando grandes esfuerzos para reducir el tamaño del condensador, lo que permitirá aumentar la densidad de memoria. Para cambiar el tamaño del condensador sin afectar a la capacitancia, se están utilizando diferentes orientaciones de las celdas. Algunas de ellas son los condensadores apilados o en zanja.[40] Con la aparición de los condensadores en zanja, surge el problema de la fabricación de estos condensadores, especialmente a medida que disminuye el tamaño de los semiconductores. La tecnología ALD permite escalar las características de las zanjas más allá de los 100 nm. La capacidad de depositar capas individuales de material permite un gran control sobre el material. Salvo algunos problemas de crecimiento incompleto de la película (en gran parte debido a una cantidad insuficiente o a sustratos de baja temperatura), la ALD proporciona un medio eficaz para depositar películas finas como dieléctricos o barreras.[41]
Aplicaciones fotovoltaicas[editar]
El uso de la técnica ALD en células solares es cada vez más importante. En el pasado, se ha utilizado para depositar capas de pasivación superficial en células solares de silicio cristalino (c-Si), capas tampón en células solares de seleniuro de cobre, indio y galio (CIGS) y capas barrera en células solares sensibilizadas por colorantes (DSSC).[42] Por ejemplo, Schmidt et al. demostraron el uso de Al2O3 cultivado mediante ALD para aplicaciones de células solares.[43] Se utilizó como capa de pasivación superficial para el desarrollo de células solares PERC (emisor pasivado y célula posterior). También se está explorando ampliamente el uso de la técnica ALD para depositar capas de transporte de carga (CTL) para células solares de perovskita. La capacidad de ALD para depositar películas de alta calidad y conformadas con un control preciso del espesor puede proporcionar una gran ventaja en el ajuste fino de las interfaces entre la CTL y la capa de perovskita. Además, puede ser útil para obtener películas uniformes y sin agujeros en grandes superficies. Estos aspectos hacen de la ALD una técnica prometedora para mejorar y estabilizar el rendimiento de las células solares de perovskita.[44]
Aplicaciones electroópticas[editar]
Acopladores de película fina[editar]
A medida que surgen los circuitos integrados fotónicos (PIC), a menudo de forma similar a los circuitos integrados electrónicos, se hace necesaria una amplia variedad de estructuras de dispositivos ópticos en chip. Un ejemplo es el acoplador nanofotónico que se comporta como un divisor de haces de tamaño micrométrico en la intersección de guías de ondas ópticas[45] en las que las zanjas de alta relación de aspecto (~100 nm de ancho x 4 micrómetros de profundidad) se definen primero mediante grabado y luego se rellenan con óxido de aluminio mediante ALD para formar interfaces de calidad óptica.
Aplicaciones biomédicas[editar]
Comprender y poder especificar las propiedades superficiales de los dispositivos biomédicos es fundamental en la industria biomédica, especialmente en lo que respecta a los dispositivos que se implantan en el cuerpo. Un material interactúa con el entorno en su superficie, por lo que las propiedades superficiales dirigen en gran medida las interacciones del material con su entorno. La química y la topografía superficiales afectan a la adsorción de proteínas, las interacciones celulares y la respuesta inmunitaria.[46]
Algunos usos actuales en aplicaciones biomédicas son la creación de sensores flexibles, la modificación de membranas nanoporosas, la ALD de polímeros y la creación de recubrimientos biocompatibles finos. La ALD se ha utilizado para depositar películas de TiO2 para crear sensores de guía de ondas ópticas como herramientas de diagnóstico.[47] Además, la ALD es beneficioso para crear dispositivos sensores flexibles que pueden utilizarse, por ejemplo, en la ropa de los deportistas para detectar el movimiento o la frecuencia cardiaca. El ALD es un posible proceso de fabricación de transistores orgánicos flexibles de efecto de campo (OFET) porque es un método de deposición a baja temperatura.[48]
Los materiales nanoporosos están surgiendo en toda la industria biomédica para la administración de fármacos, los implantes y la ingeniería de tejidos. La ventaja de utilizar ALD para modificar las superficies de materiales nanoporosos es que, a diferencia de muchos otros métodos, la saturación y la naturaleza autolimitante de las reacciones hacen que incluso las superficies e interfaces profundamente incrustadas se recubran con una película uniforme.[8] El tamaño de los poros de las superficies nanoporosas puede reducirse aún más en el proceso ALD, ya que el recubrimiento conforme recubrirá completamente el interior de los poros. Esta reducción del tamaño de los poros puede resultar ventajosa en determinadas aplicaciones.[49]
Como barrera de permeación para plásticos[editar]
La ALD puede utilizarse como barrera de permeación para plásticos.[50] Por ejemplo, está bien establecido como método de encapsulación de OLED en plástico.[51][52] El ALD también puede utilizarse para inocular piezas de plástico impresas en 3D para su uso en entornos de vacío mediante la mitigación de la desgasificación, lo que permite crear herramientas personalizadas de bajo coste tanto para el procesamiento de semiconductores como para aplicaciones espaciales.[53] El ALD puede utilizarse para formar una barrera en plásticos en procesos rollo a rollo.[54]
La calidad y su control[editar]
La calidad de un proceso ALD puede controlarse mediante diversas técnicas de imagen para garantizar que el proceso ALD se desarrolla sin problemas y produce una capa conforme sobre una superficie. Una opción es el uso de microscopía electrónica de barrido (SEM) transversal o microscopía electrónica de transmisión (TEM). Las imágenes de gran aumento son pertinentes para evaluar la calidad de una capa de ALD. La reflectividad de rayos X (XRR) es una técnica que mide las propiedades de las películas finas, como el grosor, la densidad y la rugosidad de la superficie. Otra herramienta óptica de evaluación de la calidad es la elipsometría espectroscópica. Su aplicación entre las deposiciones de cada capa por ALD proporciona información sobre la velocidad de crecimiento y las características del material de la película.[55]
La aplicación de esta herramienta de análisis durante el proceso de ALD, a veces denominada elipsometría espectroscópica in situ, permite un mayor control de la velocidad de crecimiento de las películas durante el proceso de ALD. Este tipo de control de calidad se realiza durante el proceso de ALD, en lugar de evaluar las películas a posteriori, como en el caso de las imágenes TEM o XRR. Además, la espectroscopia de retrodispersión de Rutherford (RBS), la espectroscopia de fotoelectrones de rayos X (XPS), la espectroscopia de electrones Auger (AES) y la detección de cuatro terminales pueden utilizarse para proporcionar información de control de calidad con respecto a las películas finas depositadas por ALD.[55]
Ventajas y limitaciones[editar]
Ventajas[editar]
La ALD proporciona un método muy controlado para producir una película con un grosor especificado atómicamente. Además, el crecimiento de diferentes estructuras multicapa es sencillo. Debido a la sensibilidad y precisión del equipo, es muy beneficioso para los que trabajan en el campo de la microelectrónica y la nanotecnología en la producción de semiconductores pequeños pero eficientes. La ALD suele implicar el uso de temperaturas relativamente bajas y un catalizador favorecido termoquímicamente. La temperatura más baja es beneficiosa cuando se trabaja con sustratos blandos, como muestras orgánicas y biológicas. Algunos precursores térmicamente inestables pueden utilizarse siempre que su velocidad de descomposición sea relativamente lenta.[8][12]
Desventajas[editar]
La alta pureza de los sustratos es muy importante, por lo que los costes son elevados. Aunque este coste puede no ser mucho en relación con el coste del equipo necesario, puede ser necesario realizar varias pruebas antes de encontrar las condiciones que favorezcan su producto deseado. Una vez realizada la capa y completado el proceso, puede ser necesario eliminar el exceso de precursores del producto final. En algunos productos finales hay menos de un 1% de impurezas presentes.[56]
Viabilidad económica[editar]
Los instrumentos de deposición de capas atómicas pueden oscilar entre 200.000 y 800.000 dólares en función de la calidad y la eficacia del instrumento. No hay un coste fijo para hacer funcionar un ciclo de estos instrumentos; el coste varía en función de la calidad y pureza de los sustratos utilizados, así como de la temperatura y el tiempo de funcionamiento de la máquina. Algunos sustratos están menos disponibles que otros y requieren condiciones especiales, ya que algunos son muy sensibles al oxígeno y pueden aumentar entonces la velocidad de descomposición. Los óxidos multicomponentes y ciertos metales tradicionalmente necesarios en la industria microelectrónica no suelen ser rentables.[57]
Tiempo de reacción[editar]
El proceso de ALD es muy lento y se sabe que ésta es su principal limitación. Por ejemplo, el Al2O3 se deposita a una velocidad de 0,11 nm por ciclo, lo que puede corresponder a una velocidad media de deposición de 100-300 nm por hora, dependiendo de la duración del ciclo y de la velocidad de bombeo. Este problema puede superarse utilizando ALD espacial, en el que el sustrato se desplaza en el espacio por debajo de un cabezal de ducha ALD especial, y ambos gases precursores se separan mediante cortinas/soportes de gas. De este modo, se pueden alcanzar velocidades de deposición de 60 nm por minuto. La ALD se suele utilizar para producir sustratos para microelectrónica y nanotecnología, por lo que no se necesitan capas atómicas gruesas. Muchos sustratos no pueden utilizarse debido a su fragilidad o impureza. Las impurezas suelen encontrarse en el 0,1-1 at.% debido a que se sabe que algunos de los gases portadores dejan residuos y también son sensibles al oxígeno.[56]
Limitaciones químicas[editar]
Los precursores deben ser volátiles, pero no sujetos a descomposición, ya que la mayoría de los precursores son muy sensibles al oxígeno/aire, lo que provoca una limitación en los sustratos que pueden utilizarse. Algunos sustratos biológicos son muy sensibles al calor y pueden tener tasas de descomposición rápidas que no se ven favorecidas y producen mayores niveles de impurezas. Existen multitud de materiales para sustratos de capa fina, pero los sustratos importantes necesarios para su uso en microelectrónica pueden ser difíciles de obtener y muy caros.[56]
- ↑ a b c d e Oviroh, Peter Ozaveshe; Akbarzadeh, Rokhsareh; Pan, Dongqing; Coetzee, Rigardt Alfred Maarten; Jen, Tien-Chien (2019). «New Development of Atomic Layer Deposition: Processes, Methods, and Applications». Science and Technology of Advanced Materials 20 (1): 465-496. Bibcode:2019STAdM..20..465O. PMC 6534251. PMID 31164953. doi:10.1080/14686996.2019.1599694.
- ↑ a b Puurunen, Riikka L. (15 de junio de 2005). «Surface chemistry of atomic layer deposition: A case study for the trimethylaluminum/water process». Journal of Applied Physics 97 (12): 121301-121301-52. Bibcode:2005JAP....97l1301P. doi:10.1063/1.1940727.
- ↑ Puurunen, Riikka L. (15 de junio de 2005). «Surface chemistry of atomic layer deposition: A case study for the trimethylaluminum/water process». Journal of Applied Physics 97 (12): 121301-121301-52. Bibcode:2005JAP....97l1301P. doi:10.1063/1.1940727.
- ↑ a b c d Miikkulainen, Ville; Leskelä, Markku; Ritala, Mikko; Puurunen, Riikka L. (14 de enero de 2013). «Crystallinity of inorganic films grown by atomic layer deposition: Overview and general trends». Journal of Applied Physics 113 (2): 021301-021301-101. Bibcode:2013JAP...113b1301M. doi:10.1063/1.4757907.
- ↑ a b Puurunen, Riikka L. (15 de junio de 2005). «Surface chemistry of atomic layer deposition: A case study for the trimethylaluminum/water process». Journal of Applied Physics 97 (12): 121301-121301-52. Bibcode:2005JAP....97l1301P. doi:10.1063/1.1940727.
- ↑ Knoops, Harm C. M.; Faraz, Tahsin; Arts, Karsten; Kessels, Wilhelmus M. M. (Erwin) (May 2019). «Status and prospects of plasma-assisted atomic layer deposition». Journal of Vacuum Science & Technology A 37 (3): 030902. Bibcode:2019JVSTA..37c0902K. S2CID 108003079. doi:10.1116/1.5088582.
- ↑ Mackus, Adriaan J. M.; Schneider, Joel R.; MacIsaac, Callisto; Baker, Jon G.; Bent, Stacey F. (10 de diciembre de 2018). «Synthesis of Doped, Ternary, and Quaternary Materials by Atomic Layer Deposition: A Review». Chemistry of Materials 31 (4): 1142-1183. S2CID 104385650. doi:10.1021/acs.chemmater.8b02878.
- ↑ a b c Kessels, W.M.M. (2019). ALD Database. Eindhoven University of Technology. doi:10.6100/alddatabase.
- ↑ "How Atomic Layer Deposition Works". Youtube (2011).
- ↑ Butt, Hans-Jurgen; Graf, Karlheinz; Kappl, Michael (2013). Physics and Chemistry of Interfaces (Third, Revised edición). John Wiley & Sons. ISBN 978-3-527-41216-7.
- ↑ «2.3 Adsorption Kinetics – The Rate of Adsorption». www.chem.qmul.ac.uk.
- ↑ a b c d e f g h i j k l m n ñ o p q r s George, S.M. (2010). «Atomic Layer Deposition: An Overview». Chem. Rev. 110 (1): 111-131. PMID 19947596. doi:10.1021/cr900056b.
- ↑ Güder, Firat (2012). Atomlagenabscheidung unterstützt Nanostrukturelle Transformationen [Atomic layer deposition assisted nanostructural transformations] (Doctoral thesis) (en alemán). University of Freiburg. Front cover image.
- ↑ a b Knisley, Thomas J.; Kalutarage, Lakmal C.; Winter, Charles H. (December 2013). «Precursors and chemistry for the atomic layer deposition of metallic first row transition metal films». Coordination Chemistry Reviews 257 (23–24): 3222-3231. doi:10.1016/j.ccr.2013.03.019.
- ↑ Haynes, William M., ed. (2011). CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data (92nd edición). Boca Raton, FL.: CRC Press. ISBN 9781439855119. OCLC 730008390.
- ↑ Gordon, Peter G.; Kurek, Agnieszka; Barry, Seán T. (2015). «Trends in Copper Precursor Development for CVD and ALD Applications». ECS Journal of Solid State Science and Technology 4 (1): N3188-N3197. ISSN 2162-8769. S2CID 97668427. doi:10.1149/2.0261501jss.
- ↑ Knisley, Thomas J.; Ariyasena, Thiloka C.; Sajavaara, Timo; Saly, Mark J.; Winter, Charles H. (25 de octubre de 2011). «Low Temperature Growth of High Purity, Low Resistivity Copper Films by Atomic Layer Deposition». Chemistry of Materials 23 (20): 4417-4419. ISSN 0897-4756. doi:10.1021/cm202475e.
- ↑ Guo, Zheng; Li, Hao; Chen, Qiang; Sang, Lijun; Yang, Lizhen; Liu, Zhongwei; Wang, Xinwei (8 de septiembre de 2015). «Low-Temperature Atomic Layer Deposition of High Purity, Smooth, Low Resistivity Copper Films by Using Amidinate Precursor and Hydrogen Plasma». Chemistry of Materials 27 (17): 5988-5996. ISSN 0897-4756. doi:10.1021/acs.chemmater.5b02137.
- ↑ a b Klaus, J.W; Ferro, S.J; George, S.M (February 2000). «Atomic layer deposition of tungsten using sequential surface chemistry with a sacrificial stripping reaction». Thin Solid Films 360 (1–2): 145-153. Bibcode:2000TSF...360..145K. doi:10.1016/S0040-6090(99)01076-7.
- ↑ Seghete, D.; Rayner, G.B.; Cavanagh, A.S.; Anderson, V.R.; George, S.M. (12 de abril de 2011). «Molybdenum Atomic Layer Deposition Using MoF 6 and Si 2 H 6 as the Reactants». Chemistry of Materials 23 (7): 1668-1678. ISSN 0897-4756. doi:10.1021/cm101673u.
- ↑ Grubbs, R. K.; Steinmetz, N. J.; George, S. M. (2004). «Gas phase reaction products during tungsten atomic layer deposition using WF[sub 6] and Si[sub 2]H[sub 6]». Journal of Vacuum Science & Technology B: Microelectronics and Nanometer Structures 22 (4): 1811. Bibcode:2004JVSTB..22.1811G. doi:10.1116/1.1767105.
- ↑ Fabreguette, F.H.; Sechrist, Z.A.; Elam, J.W.; George, S.M. (September 2005). «Quartz crystal microbalance study of tungsten atomic layer deposition using WF6 and Si2H6». Thin Solid Films 488 (1–2): 103-110. Bibcode:2005TSF...488..103F. doi:10.1016/j.tsf.2005.04.114.
- ↑ Elam, J.W; Nelson, C.E; Grubbs, R.K; George, S.M (May 2001). «Kinetics of the WF6 and Si2H6 surface reactions during tungsten atomic layer deposition». Surface Science 479 (1–3): 121-135. Bibcode:2001SurSc.479..121E. doi:10.1016/S0039-6028(01)00969-4.
- ↑ Kalutarage, Lakmal C.; Martin, Philip D.; Heeg, Mary Jane; Winter, Charles H. (28 de agosto de 2013). «Volatile and Thermally Stable Mid to Late Transition Metal Complexes Containing α-Imino Alkoxide Ligands, a New Strongly Reducing Coreagent, and Thermal Atomic Layer Deposition of Ni, Co, Fe, and Cr Metal Films». Journal of the American Chemical Society 135 (34): 12588-12591. ISSN 0002-7863. PMID 23947400. doi:10.1021/ja407014w.
- ↑ Klesko, Joseph P.; Thrush, Christopher M.; Winter, Charles H. (28 de julio de 2015). «Thermal Atomic Layer Deposition of Titanium Films Using Titanium Tetrachloride and 2-Methyl-1,4-bis(trimethylsilyl)-2,5-cyclohexadiene or 1,4-Bis(trimethylsilyl)-1,4-dihydropyrazine». Chemistry of Materials 27 (14): 4918-4921. ISSN 0897-4756. doi:10.1021/acs.chemmater.5b01707.
- ↑ Stevens, Eric C.; Mousa, Moataz Bellah M.; Parsons, Gregory N. (November 2018). «Thermal atomic layer deposition of Sn metal using SnCl 4 and a vapor phase silyl dihydropyrazine reducing agent». Journal of Vacuum Science & Technology A 36 (6): 06A106. Bibcode:2018JVSTA..36fA106S. ISSN 0734-2101. S2CID 104844454. doi:10.1116/1.5055212.
- ↑ Blakeney, Kyle J.; Winter, Charles H. (27 de marzo de 2018). «Atomic Layer Deposition of Aluminum Metal Films Using a Thermally Stable Aluminum Hydride Reducing Agent». Chemistry of Materials 30 (6): 1844-1848. ISSN 0897-4756. doi:10.1021/acs.chemmater.8b00445.
- ↑ Brown, S.; Howe, J.Y.; Ma, Z.; Et (2008). «Surface Modification of Au/TiO2 Catalysts by SiO2 via Atomic Layer Deposition». The Journal of Physical Chemistry C 112 (25): 9448-9457. doi:10.1021/jp801484h.
- ↑ Werner, Florian; Stals, Walter; Gortzen, Roger; Veith, Boris; Brendel, Rolf; Schmidt, Jan (2011). «Deposición de capas atómicas de alta velocidad de Al2Ol3para la pasivación superficial de células solares de Si». Energy Procedia 8: 1301-306. doi:10.1016/j.egypro.2011.06.140.
- ↑ a b c d Kim, H. (2003). «Atomic layer deposition of metal and nitride thin films: Current research efforts and applications for semiconductor device processing». Journal of Vacuum Science and Technology 21 (6): 2231. Bibcode:2003JVSTB..21.2231K. doi:10.1116/1.1622676.
- ↑ Mackus, Adriaan J. M.; Garcia-Alonso, Diana; Knoops, Harm C. M.; Bol, Ageeth A.; Kessels, Wilhelmus M. M. (2013). «Room-Temperature Atomic Layer Deposition of Platinum». Chemistry of Materials 25 (9): 1769-1774. doi:10.1021/cm400274n.
- ↑ Greer, Frank; Fraser, D.; Coburn, J.W. and Graves, David B. (2002) "Fundamental Vacuum Beam Studies of Radical Enhanced Atomic Layer Chemical Vapor Deposition (REAL-CVD) of TiN". NCCAVS.
- ↑ Potts, S.E.; Kessels, W.M.M. (December 2013). «Energy-enhanced atomic layer deposition for more process and precursor versatility». Coordination Chemistry Reviews 257 (23–24): 3254-3270. doi:10.1016/j.ccr.2013.06.015.
- ↑ Knoops, Harm C. M.; Braeken, Eline M. J.; de Peuter, Koen; Potts, Stephen E.; Haukka, Suvi; Pore, Viljami; Kessels, Wilhelmus M. M. (9 de septiembre de 2015). «Atomic Layer Deposition of Silicon Nitride from Bis(tert-butylamino)silane and N2 Plasma». ACS Applied Materials & Interfaces 7 (35): 19857-19862. PMID 26305370. doi:10.1021/acsami.5b06833.
- ↑ Langereis, E.; Knoops, H. C. M.; Mackus, A. J. M.; Roozeboom, F.; van de Sanden, M. C. M.; Kessels, W. M. M. (15 de octubre de 2007). «Synthesis and in situ characterization of low-resistivity TaNx films by remote plasma atomic layer deposition». Journal of Applied Physics 102 (8): 083517-083517-11. Bibcode:2007JAP...102h3517L. doi:10.1063/1.2798598.
- ↑ Elers, K.-E.; Saanila, V.; Soininen, P.J.; Li, W.-M.; Kostamo, J.T.; Haukka, S.; Juhanoja, J.; Besling, W.F.A. (2002). «Diffusion Barrier Deposition on a Copper Surface by Atomic Layer Deposition». Chemical Vapor Deposition 8 (4): 149. doi:10.1002/1521-3862(20020704)8:4<149::AID-CVDE149>3.0.CO;2-F.
- ↑ Waechtler, T. (2011). «ALD-grown seed layers for electrochemical copper deposition integrated with different diffusion barrier systems». Microelectron. Eng. 88 (5): 684-689. doi:10.1016/j.mee.2010.07.004.
- ↑ Magnetic Recording Theory. stanford.edu
- ↑ Leskelä, Markku (2010). «Industrial Applications of Atomic Layer Deposition (ALD)». 10th MIICS Conference. Archivado desde el original el 30 de mayo de 2012.
- ↑ Matas, Brian; de Suberbasaux, Christian (1997). «Ch. 7. DRAM Technology». Memory, 1997: Complete Coverage of DRAM, Sram, EPROM, and Flash Memory IC's. Scottsdale, AZ, USA: Integrated Circuit Engineering Corp. ISBN 978-1877750595.
- ↑ Gutsche, M. (2003). «Atomic Layer Deposition for Advanced DRAM Applications». Future Fab Intl. 14. Archivado desde el original el 8 de septiembre de 2005.
- ↑ van Delft, J A; Garcia-Alonso, D; Kessels, W M M (11 de julio de 2012). «Atomic layer deposition for photovoltaics: applications and prospects for solar cell manufacturing». Semiconductor Science and Technology 27 (7): 074002. Bibcode:2012SeScT..27g4002V. ISSN 0268-1242. S2CID 55670928. doi:10.1088/0268-1242/27/7/074002.
- ↑ Schmidt, J.; Merkle, A.; Brendel, R.; Hoex, B.; de Sanden, M. C. M. van; Kessels, W. M. M. (September 2008). «Surface passivation of high-efficiency silicon solar cells by atomic-layer-deposited Al 2 O 3». Progress in Photovoltaics: Research and Applications (en inglés) 16 (6): 461-466. S2CID 97771156. doi:10.1002/pip.823.
- ↑ Seo, Seongrok; Jeong, Seonghwa; Park, Hyoungmin; Shin, Hyunjung; Park, Nam-Gyu (2019). «Atomic layer deposition for efficient and stable perovskite solar cells». Chemical Communications (en inglés) 55 (17): 2403-2416. ISSN 1359-7345. PMID 30719523. S2CID 73448015. doi:10.1039/C8CC09578G.
- ↑ MacFarlane, D. L; M. P. Christensen; A. E. Nagdi; G. A. Evans; L. R. Hunt; N. Huntoon; J. Kim; T. W. Kim; J. Kirk; T. LaFave Jr; K. Liu; V. Ramakrishna; M. Dabkowski; N. Sultana (2012). «Experiment and Theory of an Active Optical Filter». IEEE J. Of Quantum Electronics 48 (3): 307-317. Bibcode:2012IJQE...48..307M. S2CID 46191619. doi:10.1109/JQE.2011.2174615.
- ↑ Chen, Hong; Yuan, Lin; Song, Wei; Wu, Shongkui; Li, Dan (2008). «Biocompatible Polymer Materials: Role of Protein-surface Interactions». Progress in Polymer Science 33 (11): 1059-1087. doi:10.1016/j.progpolymsci.2008.07.006.
- ↑ Purniawan, A.; French, P.J.; Pandraud, G.; Sarro, P.M. (2010). «TiO2 ALD nanolayer as evanescent waveguide for biomedical sensor applications». Procedia Engineering 5: 1131-1135. doi:10.1016/j.proeng.2010.09.310.
- ↑ Pang, Changhyun; Lee, Chanseok; Suh, Kahp-Yang (2013). «Recent Advances in Flexible Sensors for Wearable and Implantable Devices». Journal of Applied Polymer Science 130 (3): 1429-1441. doi:10.1002/app.39461.
- ↑ Adiga, Shashishekar P.; Curtiss, Larry A.; Elam, Jeffrey W.; Pellin, Michael J.; Shih, Chun-Che; Shih, Chun-Ming; Lin, Shing-Jong; Su, Yea-Yang; Gittard, Shaun D.; Zhang, Junping; Narayan, Roger J. (2008). «Nanoporous Materials for Biomedical Devices». Biological Materials Science 60 (3): 26-32. Bibcode:2008JOM....60c..26A. S2CID 135635044. doi:10.1007/s11837-008-0028-9.
- ↑ Lei Wenwen; Li Xingcun; Chen Qiang; Wang Zhengduo (February 2012). «Plasma-Assisted ALD of an Al2O3 Permeation Barrier Layer on Plastic». Plasma Science and Technology (en inglés) 14 (2): 129. Bibcode:2012PlST...14..129L. ISSN 1009-0630. S2CID 250740101. doi:10.1088/1009-0630/14/2/09.
- ↑ Park, Sang-Hee Ko; Oh, Jiyoung; Hwang, Chi-Sun; Yang, Yong Suk; Lee, Jeong-Ik; Chu, Hye Yong (January 2004). «Ultra thin film encapsulation of OLED on plastic substrate». Journal of Information Display (en inglés) 5 (3): 30-34. ISSN 1598-0316. S2CID 135967211. doi:10.1080/15980316.2004.9651953.
- ↑ Park, Sang-Hee Ko; Oh, Jiyoung; Hwang, Chi-Sun; Lee, Jeong-Ik; Yang, Yong Suk; Chu, Hye Yong; Kang, Kwang-Yong (14 de octubre de 2005). «Ultra Thin Film Encapsulation of OLED on Plastic Substrate». ETRI Journal (en inglés) 27 (5): 545-550. ISSN 1225-6463. S2CID 58156645. doi:10.4218/etrij.05.0905.0006.
- ↑ Heikkinen, Ismo T.S.; Marin, Giovanni; Bihari, Nupur; Ekstrum, Craig; Mayville, Pierce J.; Fei, Yuhuan; Hu, Yun Hang; Karppinen, Maarit; Savin, Hele; Pearce, Joshua M. (March 2020). «Atomic layer deposited aluminum oxide mitigates outgassing from fused filament fabrication–based 3-D printed components». Surface and Coatings Technology (en inglés) 386: 125459. S2CID 212841294. doi:10.1016/j.surfcoat.2020.125459.
- ↑ Hirvikorpi, Terhi; Laine, Risto; Vähä-Nissi, Mika; Kilpi, Väinö; Salo, Erkki; Li, Wei-Min; Lindfors, Sven; Vartiainen, Jari; Kenttä, Eija; Nikkola, Juha; Harlin, Ali (January 2014). «Barrier properties of plastic films coated with an Al2O3 layer by roll-to-toll atomic layer deposition». Thin Solid Films (en inglés) 550: 164-169. Bibcode:2014TSF...550..164H. doi:10.1016/j.tsf.2013.10.148.
- ↑ a b Langereis, E.; Heil, S B S.; Knoops, H C M.; Keuning, W.; Van De Sanden, M C M.; Kessels, W M M. (2009). «In situ spectroscopic ellipsometry as a versatile tool for studying atomic layer deposition». Journal of Physics D: Applied Physics 42 (7): 1-19. S2CID 97244909. doi:10.1088/0022-3727/42/7/073001.
- ↑ a b c Leskelä, M.; Ritala, M. (2003). «Atomic layer deposition chemistry: Recent developments and future challenges». Angewandte Chemie 42 (45): 5548-54. PMID 14639717. doi:10.1002/anie.200301652. Archivado desde el original el 14 de julio de 2014.
- ↑ «Molecular Beam Epitaxy & Atomic Layer Deposition Systems». SVT Associates.
Enlaces externos[editar]
- Esta obra contiene una traducción derivada de «Atomic layer deposition» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.

