Diferencia entre revisiones de «Bicarbonato de sodio»
Sin resumen de edición |
Revertidos los cambios de 84.125.188.167 a la última edición de Poska con monobook-suite |
||
| Línea 87: | Línea 87: | ||
Ayuda a facilitar la digestión. |
Ayuda a facilitar la digestión. |
||
== Referencias == |
== Referencias == |
||
<references /> |
<references /> |
||
Revisión del 19:12 4 feb 2010
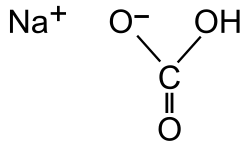  | ||
| Nombre IUPAC | ||
| Carbonato ácido de sodio | ||
| General | ||
| Otros nombres |
Bicarbonato de sodio Hidrogenocarbonato de sodio | |
| Fórmula semidesarrollada | NaHCO3 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 144-55-8[1] | |
| ChEBI | 32139 | |
| ChEMBL | CHEMBL1353 | |
| ChemSpider | 8609 | |
| DrugBank | 01390 | |
| PubChem | 516892 | |
| UNII | 8MDF5V39QO | |
| KEGG | D01203 C12603, D01203 | |
| Propiedades físicas | ||
| Apariencia | blanco cristalino | |
| Densidad | 2,173 kg/m³; 0,002173 g/cm³ | |
| Masa molar | 840 g/mol | |
| Punto de fusión | 323,15 K (50 °C) | |
| Punto de descomposición | 543,15 K (270 °C) | |
| Índice de refracción (nD) | 1.3344 | |
| Propiedades químicas | ||
| Solubilidad en agua | 10,3 g⁄100 g de H2O | |
| Termoquímica | ||
| ΔfH0sólido | -951 kJ/mol | |
| S0sólido | 102 J·mol–1·K–1 | |
| Riesgos | ||
| Riesgos principales | HSci - Safety data | |
| Ingestión | No peligroso excepto en cantidades muy grandes | |
| Inhalación | Puede causar irritación | |
| Piel | Puede causar irritación | |
| Ojos | Puede causar ceguera | |
| LD50 | 4220 mg/kg | |
| Más información | Hazardous Chemical Database (en inglés) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El bicarbonato de sodio (también llamado bicarbonato sódico o hidrogenocarbonato de sodio o carbonato ácido de sodio) es un compuesto sólido cristalino de color blanco muy soluble en agua, con un ligero sabor alcalino parecido al del carbonato de sodio, de fórmula NaHCO3. Se puede encontrar como mineral en la naturaleza o se puede producir artificialmente.[2]
Cuando se expone a un ácido moderadamente fuerte se descompone en dióxido de carbono y agua. La reacción es la siguiente:
Debido a la capacidad del bicarbonato de sodio de liberar dióxido de carbono se usa junto con compuestos acídicos como aditivo leudante en panadería y en la producción de gaseosas. Algunas levaduras panarias contienen bicarbonato de sodio. Antiguamente se usaba como fuente de dióxido de carbono para la gaseosa Coca Cola.
Es el componente fundamental de los polvos extintores de incendios o polvo BC.
Obtención
Mediante el Proceso de Solvay. Aunque es utilizado para obtener Na2CO3, es posible obtener en una de las reacciones intermedias bicarbonato sódico. El proceso consiste en la siguiente reacción:
Na+ + Cl- + NH3 + H2O + CO2 → NaHCO3(s) + NH4+ + Cl-
En la cual precipita el bicarbonato de sodio.
Usos
En gastronomía
El bicarbonato de sodio se usa principalmente en la repostería, donde reacciona con otros componentes para liberar CO2, que ayuda a la masa a elevarse, dándole sabor y volumen. Los compuestos ácidos que inducen esta reacción incluyen bitartrato de potasio (también conocido como crema de tártaro), jugo de limón, yogur, ácido acético
Uso Cultural
El bicarbonato de sodio se utiliza como un agente alcalinizante que actua en combinación a la saliva en el coqueo, de manera que se suaviza y se produce la extraccion de los metabolitos de la hoja de coca haciendose de esa manera el coqueo un proceso placentero y duradero en contraposicion si no se usara el bicarbonato de sodio, de ahora en más bica. El bica es a la coca lo que el azúcar al cafe, de manera que en el norte de la república Argentina (zona donde se practica el coqueo) el consumo de bicarbonato es alto.
En Medicina
Manejo Electrolitico en Eclampsia. Ayuda a facilitar la digestión.
Referencias
- ↑ Número CAS
- ↑ Hoja de seguridad elaborada por Química Básica, S.A., que incluye prácticamente todos los datos básicos del bicarbonato de sodio: características físicas, químicas y microbiológicas, información toxicológica, primeros auxilios, controles de exposición y protección personal, estabilidad y reactividad, manejo y almacenamiento, fecha de duración mínima, fecha de vencimiento o de caducidad, identificación de riesgos, etc.
Véase también
 Wikimedia Commons alberga una categoría multimedia sobre Bicarbonato de sodio.
Wikimedia Commons alberga una categoría multimedia sobre Bicarbonato de sodio.- Levadura
- Lista de minerales
- Carbonato de sodio
- Ácido carbónico
