Diferencia entre revisiones de «Bicarbonato de sodio»
m Revertidos los cambios de 190.204.140.51 a la última edición de 189.136.192.163 |
|||
| Línea 35: | Línea 35: | ||
=== En gastronomía === |
=== En gastronomía === |
||
El bicarbonato de sodio se usa principalmente en la [[repostería]], donde reacciona con otros componentes para liberar CO<sub>2</sub>, que ayuda a la masa a elevarse, dándole sabor y volumen. Los compuestos ácidos que inducen esta reacción incluyen [[bitartrato de potasio]] (también conocido como ''crema de tártaro''), jugo de [[Citrus × limon|limón]], [[yogur]], [[ácido acétizo)) |
El bicarbonato de sodio se usa principalmente en la [[repostería]], donde reacciona con otros componentes para liberar CO<sub>2</sub>, que ayuda a la masa a elevarse, dándole sabor y volumen. Los compuestos ácidos que inducen esta reacción incluyen [[bitartrato de potasio]] (también conocido como ''crema de tártaro''), jugo de [[Citrus × limon|limón]], [[yogur]], [[ácido acétizo)) |
||
SE PUEDE TOMAR CON UN POCO DE LIMON PARA BAJAR LA PESADEZEN EL ESTOMAGO LUEGO DE UNA COMIDA EXELENTE |
|||
=== En Medicina === |
=== En Medicina === |
||
Revisión del 16:54 2 nov 2009
| Bicarbonato de sodio | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Carbonato ácido de sodio | ||
| General | ||
| Otros nombres |
Bicarbonato de sodio Hidrogenocarbonato de sodio | |
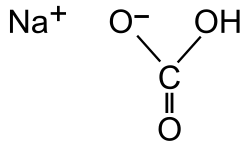
| Fórmula semidesarrollada | NaHCO3 | |
| Fórmula estructural |
 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 144-55-8[1] | |
| Número RTECS | VZ0950000 | |
| ChEBI | 32139 | |
| ChEMBL | CHEMBL1353 | |
| ChemSpider | 8609 | |
| DrugBank | 01390 | |
| PubChem | 516892 | |
| UNII | 8MDF5V39QO | |
| KEGG | D01203 C12603, D01203 | |
| Propiedades físicas | ||
| Apariencia | blanco cristalino | |
| Densidad | 2,2×10³ kg/m³; 22 g/cm³ | |
| Masa molar | 840 g/mol | |
| Punto de descomposición | 543 K (270 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 10,3 g⁄100 g de H2O | |
| Termoquímica | ||
| ΔfH0sólido | -951 kJ/mol | |
| S0sólido | 102 J·mol–1·K–1 | |
| Riesgos | ||
| Ingestión | No peligroso excepto en cantidades muy grandes. | |
| Inhalación | Puede causar irritación. | |
| Piel | Puede causar irritación. | |
| Ojos | puede causar ceguera | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El bicarbonato de sodio (también llamado bicarbonato sódico o hidrogenocarbonato de sodio o carbonato ácido de sodio) es un compuesto sólido cristalino de color blanco muy soluble en agua, con un ligero sabor alcalino parecido al del carbonato de sodio, de fórmula NaHCO3. Se puede encontrar como mineral en la naturaleza o se puede producir artificialmente.[2]
Cuando se expone a un ácido moderadamente fuerte se descompone en dióxido de carbono y agua. La reacción es la siguiente:
Debido a la capacidad del bicarbonato de sodio de liberar dióxido de carbono se usa junto con compuestos acídicos como aditivo leudante en panadería y en la producción de gaseosas. Algunas levaduras panarias contienen bicarbonato de sodio. Antiguamente se usaba como fuente de dióxido de carbono para la gaseosa Coca Cola.
Es el componente fundamental de los polvos extintores de incendios o polvo BC.
Usos
En gastronomía
El bicarbonato de sodio se usa principalmente en la repostería, donde reacciona con otros componentes para liberar CO2, que ayuda a la masa a elevarse, dándole sabor y volumen. Los compuestos ácidos que inducen esta reacción incluyen bitartrato de potasio (también conocido como crema de tártaro), jugo de limón, yogur, [[ácido acétizo))
En Medicina
Manejo Electrolitico en Eclampsia
Referencias
- ↑ Número CAS
- ↑ Hoja de seguridad elaborada por Química Básica, S.A., que incluye prácticamente todos los datos básicos del bicarbonato de sodio: características físicas, químicas y microbiológicas, información toxicológica, primeros auxilios, controles de exposición y protección personal, estabilidad y reactividad, manejo y almacenamiento, fecha de duración mínima, fecha de vencimiento o de caducidad, identificación de riesgos, etc.
Véase también
 Wikimedia Commons alberga una categoría multimedia sobre Bicarbonato de sodio.
Wikimedia Commons alberga una categoría multimedia sobre Bicarbonato de sodio.- Levadura
- Lista de minerales
- Carbonato de sodio
- Ácido carbónico
