Carboxilación
La carboxilación es una reacción química en la que se produce un grupo carboxílico al tratar un sustrato con dióxido de carbono.[1] La reacción opuesta es la descarboxilación. En química, el término carbonatación a veces se usa como sinónimo de carboxilación, especialmente cuando se aplica a la reacción de reactivos carbaniónicos con CO2. Más generalmente, la carbonatación generalmente describe la producción de carbonatos.[1]
Carboxilación en química orgánica[editar]
La carboxilación es una reacción estándar en química orgánica.[2] Específicamente, la carbonatación (es decir, la carboxilación) de los reactivos de Grignard y los compuestos de organolitio es una forma clásica de convertir haluros orgánicos en ácidos carboxílicos:[3]

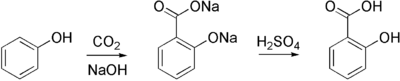
El salicilato de sodio, precursor de la aspirina, se prepara comercialmente tratando el fenóxido de sodio (la sal de sodio del fenol) con dióxido de carbono a alta presión (100 atm) y alta temperatura (390 K), un método conocido como reacción de Kolbe-Schmitt. La acidificación de la sal de salicilato resultante da el ácido salicílico:
Muchos procedimientos detallados se describen en Organic Syntheses.[4][5][6]
Los catalizadores de carboxilación incluyen carbenos N-heterocíclicos.[7] y catalizadores a base de plata.[8]
Carboxilación en bioquímica[editar]
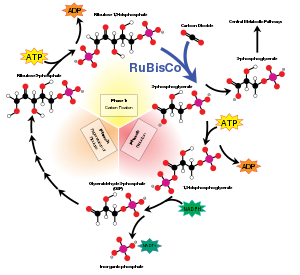
La vida basada en el carbono se origina en la carboxilación que une el dióxido de carbono atmosférico a un azúcar. El proceso generalmente es catalizado por la enzima RuBisCO. La RuBisCO (Ribulosa-1,5-bisfosfato carboxilasa/oxigenasa), la enzima que cataliza esta carboxilación, es posiblemente la proteína más abundante en la Tierra.[9][10]
La transferencia de grupos carboxilo desempeña un papel importante en los sistemas bioquímicos y está mediada por enzimas, llamadas carboxilasas (carboxi-transferasas):
Referencias[editar]
- ↑ a b Oxford English Dictionary. Oxford University Press. 2018.
- ↑ Braunstein, Pierre; Matt, Dominique; Nobel, Dominique (August 1988). «Reactions of Carbon Dioxide with Carbon-Carbon Bond Formation Catalyzed by Transition-Metal Complexes». Chemical Reviews 88 (5): 747-764. doi:10.1021/cr00087a003.
- ↑ A. M. Appel (2013). «Frontiers, Opportunities, and Challenges in Biochemical and Chemical Catalysis of CO2 Fixation». Chem. Rev. 113 (8): 6621-6658. PMC 3895110. PMID 23767781. doi:10.1021/cr300463y.
- ↑ Akira Yanagisawa; Katsutaka Yasue; Hisashi Yamamoto (1997). «Regio- and Stereoselective Carboxylation of Allylic Barium Reagents: (E)-4,8-Dimethyl-3,7-Nonadienoic Acid». Organic Syntheses 74: 178. doi:10.15227/orgsyn.074.0178.
- ↑ H. Koch; W. Haaf (1964). «1-Adamantanecarboxylic Acid». Organic Syntheses 44: 1. doi:10.15227/orgsyn.044.0001.
- ↑ W. Haaf (1966). «1-Methylcyclohexanecarboxylic Acid». Organic Syntheses 46: 72. doi:10.15227/orgsyn.046.0072.
- ↑ N-Heterocyclic carbene (NHC)–copper-catalysed transformations of carbon dioxide Liang Zhang and Zhaomin Hou Chem. Sci., 2013,4, 3395-3403 doi 10.1039/C3SC51070K
- ↑ K. Sekine; T. Yamada (2016). «Silver-catalyzed carboxylation». Chem. Soc. Rev. 45 (16): 4524-4532. doi:10.1039/C5CS00895F.
- ↑ Dhingra A, Portis AR, Daniell H (April 2004). «Enhanced translation of a chloroplast-expressed RbcS gene restores small subunit levels and photosynthesis in nuclear RbcS antisense plants». Proc. Natl. Acad. Sci. U.S.A. 101 (16): 6315-20. Bibcode:2004PNAS..101.6315D. PMC 395966. PMID 15067115. doi:10.1073/pnas.0400981101. «(Rubisco) is the most prevalent enzyme on this planet, accounting for 30–50% of total soluble protein in the chloroplast;».
- ↑ Feller U, Anders I, Mae T (2008). «Rubiscolytics: fate of Rubisco after its enzymatic function in a cell is terminated». J. Exp. Bot. 59 (7): 1615-24. PMID 17975207. doi:10.1093/jxb/erm242.