Diferencia entre revisiones de «Gen PKD-1»
Sin resumen de edición Etiqueta: posible pruebas |
|||
| Línea 67: | Línea 67: | ||
[[File:Polycystyn-1.jpg|thumb|La Policistina-1 contiene 11 dominios transmembranales (azul), 16 dominios extracelulares ""Ig-like" o "PKD"" (marrones), un sitio proteolítico extra celular de unión de porteína G así como otro sitios protelíticos (marcados con flechas amarillas) y un C-terminal enrrollado.<ref>{{Cita publicación|url=https://link.springer.com/article/10.1007%2Fs00467-013-2548-y|título=Polycystin-1 cleavage and the regulation of transcriptional pathways|apellidos=Merrick|nombre=David|apellidos2=Bertuccio|nombre2=Claudia A.|fecha=2013-07-04|publicación=Pediatric Nephrology|volumen=29|número=4|páginas=505–511|fechaacceso=2018-09-21|idioma=en|issn=0931-041X|doi=10.1007/s00467-013-2548-y|pmc=3844055|pmid=23824180|apellidos3=Chapin|nombre3=Hannah C.|apellidos4=Lal|nombre4=Mark|apellidos5=Chauvet|nombre5=Veronique|apellidos6=Caplan|nombre6=Michael J.}}</ref>|alt=]] |
[[File:Polycystyn-1.jpg|thumb|La Policistina-1 contiene 11 dominios transmembranales (azul), 16 dominios extracelulares ""Ig-like" o "PKD"" (marrones), un sitio proteolítico extra celular de unión de porteína G así como otro sitios protelíticos (marcados con flechas amarillas) y un C-terminal enrrollado.<ref>{{Cita publicación|url=https://link.springer.com/article/10.1007%2Fs00467-013-2548-y|título=Polycystin-1 cleavage and the regulation of transcriptional pathways|apellidos=Merrick|nombre=David|apellidos2=Bertuccio|nombre2=Claudia A.|fecha=2013-07-04|publicación=Pediatric Nephrology|volumen=29|número=4|páginas=505–511|fechaacceso=2018-09-21|idioma=en|issn=0931-041X|doi=10.1007/s00467-013-2548-y|pmc=3844055|pmid=23824180|apellidos3=Chapin|nombre3=Hannah C.|apellidos4=Lal|nombre4=Mark|apellidos5=Chauvet|nombre5=Veronique|apellidos6=Caplan|nombre6=Michael J.}}</ref>|alt=]] |
||
==Función== |
==Función== |
||
Policistina-1 (PC-1) que '''interactúa con varias proteínas''', entre ellas Policistina-2 (PC-2) que juntas actúan como un '''sensor mecánico''' que controla el flujo de calcio al interior de la célula, así como la cantidad de calcio que sale de la misma,<ref name=":2" /><ref>{{Cita publicación|url=http://www.rcsb.org/structure/6A70|título=Structure of the human PKD1/PKD2 complex|apellidos=Su|nombre=Q, et al|fecha=5 agosto 2018|publicación=RCSB PDB|fechaacceso=17/09/18|doi=10.2210/pdb6A70/pdb|pmid=}}</ref> se localizan en el primer cilio de las células renales.<ref>{{Cita publicación|url=https://www.ncbi.nlm.nih.gov/pubmed/12514735/|título=Polycystins 1 and 2 mediate mechanosensation in the primary cilium of kidney cells.|apellidos=Nauli|nombre=SM|apellidos2=Alenghat|nombre2=FJ, et al|fecha=Febrero 2003|publicación=Nat Genet|volumen=33|páginas=|fechaacceso=17/09/18|sinpp=129-137|doi=10.1038/ng1076|pmid=12514735}}</ref> Los dominios extracelulares '''sensan el flujo de los líquidos''', al igual que la presión en el riñón y la presión arterial en células musculares como el [[cardiomiocito]].<ref>{{Cita publicación|url=https://www.nature.com/articles/nrneph.2010.97|título=Polycystins and renovascular mechanosensory transduction|apellidos=Patel|nombre=Amanda|apellidos2=Honoré|nombre2=Eric|fecha=13 julio 2010|publicación=Nature Reviews Nephrology|volumen=6|páginas=530-538|fechaacceso=17/09/18|doi=|pmid=}}</ref> PC-1 contiene '''sitios de escisión''' en ambos N y C terminales, en el N-terminal el corte toma lugar una región de '''proteína G acoplada a un receptor proteolítico''' (GPS),<ref>{{Cita publicación|url=http://www.pnas.org/content/99/26/16981#ref-7|título=Cleavage of polycystin-1 requires the receptor for egg jelly domain and is disrupted by human autosomal-dominant polycystic kidney disease 1-associated mutations|apellidos=Qian|nombre=Feng|apellidos2=Boletta|nombre2=Alessandra|fecha=Diciembre 24 2009|publicación=PNAS|volumen=99|páginas=16981-16986|fechaacceso=17/09/18|doi=|pmid=|apellidos3=Anil K.|nombre3=Bhunis, et al}}</ref> mientras que en su extremo C-terminal cuenta con hasta tres sitios de corte, donde uno de ellos es una región putativa de ligado de proteína G y una de ellas libera un péptido, de unos ~35 kDa, que se '''acumula en el núcleo''' en respuesta a baja perfusión de líquidos en el riñón.<ref>{{Cita publicación|url=https://academic.oup.com/hmg/article/27/19/3313/5040778|título=A mutation affecting polycystin-1 mediated heterotrimeric G-protein signaling causes PKD|apellidos=C. Parnell|nombre=Stephen|apellidos2=S. Magenheimer|nombre2=Brenda|fecha=Octubre 1 2018|publicación=Human Molecular Genetics|volumen=27|páginas=3313-3324|fechaacceso=15/09/18|doi=|pmid=}}</ref> La región extracelular del N-terminal contiene repeticiones ricas en leucina y 4 dominios tipo III relacionados con [[fibronectina]] para la '''comunicación célula-célula/matriz'''.<ref>{{Cita publicación|url=https://www.ncbi.nlm.nih.gov/pubmed/7663510|título=The polycystic kidney disease 1 (PKD1) gene encodes a novel protein with multiple cell recognition domains.|apellidos=Hughes|nombre=J|apellidos2=Ward|nombre2=CJ, et al|fecha=Junio 1995|publicación=Nat Genet|fechaacceso=15/09/18|doi=10.1038/ng0695-151|pmid=7663510}}</ref> |
Policistina-1 (PC-1) que '''interactúa con varias proteínas''', entre ellas Policistina-2 (PC-2) que juntas actúan como un '''sensor mecánico''' que controla el flujo de calcio al interior de la célula, así como la cantidad de calcio que sale de la misma,<ref name=":2" /><ref>{{Cita publicación|url=http://www.rcsb.org/structure/6A70|título=Structure of the human PKD1/PKD2 complex|apellidos=Su|nombre=Q, et al|fecha=5 agosto 2018|publicación=RCSB PDB|fechaacceso=17/09/18|doi=10.2210/pdb6A70/pdb|pmid=}}</ref> se localizan en el primer cilio de las células renales que les sirve como mecano-sensor del fluído.<ref>{{Cita publicación|url=https://www.ncbi.nlm.nih.gov/pubmed/12514735/|título=Polycystins 1 and 2 mediate mechanosensation in the primary cilium of kidney cells.|apellidos=Nauli|nombre=SM|apellidos2=Alenghat|nombre2=FJ, et al|fecha=Febrero 2003|publicación=Nat Genet|volumen=33|páginas=|fechaacceso=17/09/18|sinpp=129-137|doi=10.1038/ng1076|pmid=12514735}}</ref> Los dominios extracelulares '''sensan el flujo de los líquidos''', al igual que la presión en el riñón y la presión arterial en células musculares como el [[cardiomiocito]].<ref>{{Cita publicación|url=https://www.nature.com/articles/nrneph.2010.97|título=Polycystins and renovascular mechanosensory transduction|apellidos=Patel|nombre=Amanda|apellidos2=Honoré|nombre2=Eric|fecha=13 julio 2010|publicación=Nature Reviews Nephrology|volumen=6|páginas=530-538|fechaacceso=17/09/18|doi=|pmid=}}</ref> PC-1 contiene '''sitios de escisión''' en ambos N y C terminales, en el N-terminal el corte toma lugar una región de '''proteína G acoplada a un receptor proteolítico''' (GPS),<ref>{{Cita publicación|url=http://www.pnas.org/content/99/26/16981#ref-7|título=Cleavage of polycystin-1 requires the receptor for egg jelly domain and is disrupted by human autosomal-dominant polycystic kidney disease 1-associated mutations|apellidos=Qian|nombre=Feng|apellidos2=Boletta|nombre2=Alessandra|fecha=Diciembre 24 2009|publicación=PNAS|volumen=99|páginas=16981-16986|fechaacceso=17/09/18|doi=|pmid=|apellidos3=Anil K.|nombre3=Bhunis, et al}}</ref> mientras que en su extremo C-terminal cuenta con hasta tres sitios de corte, donde uno de ellos es una región putativa de ligado de proteína G y una de ellas libera un péptido, de unos ~35 kDa, que se '''acumula en el núcleo''' en respuesta a baja perfusión de líquidos en el riñón.<ref>{{Cita publicación|url=https://academic.oup.com/hmg/article/27/19/3313/5040778|título=A mutation affecting polycystin-1 mediated heterotrimeric G-protein signaling causes PKD|apellidos=C. Parnell|nombre=Stephen|apellidos2=S. Magenheimer|nombre2=Brenda|fecha=Octubre 1 2018|publicación=Human Molecular Genetics|volumen=27|páginas=3313-3324|fechaacceso=15/09/18|doi=|pmid=}}</ref> La región extracelular del N-terminal contiene repeticiones ricas en leucina y 4 dominios tipo III relacionados con [[fibronectina]] para la '''comunicación célula-célula/matriz'''.<ref>{{Cita publicación|url=https://www.ncbi.nlm.nih.gov/pubmed/7663510|título=The polycystic kidney disease 1 (PKD1) gene encodes a novel protein with multiple cell recognition domains.|apellidos=Hughes|nombre=J|apellidos2=Ward|nombre2=CJ, et al|fecha=Junio 1995|publicación=Nat Genet|fechaacceso=15/09/18|doi=10.1038/ng0695-151|pmid=7663510}}</ref> |
||
==Consecuencias de la mutación== |
==Consecuencias de la mutación== |
||
| Línea 95: | Línea 95: | ||
* [[Vía MAPK]]/ERK |
* [[Vía MAPK]]/ERK |
||
*RAAS<ref name=":5" /> |
*RAAS<ref name=":5" /> |
||
*Hedgehog |
|||
== |
==Regulaciones Epigenéticas== |
||
[[File:PKD-1 epigenetics regulation.jpg|thumb|Relación entre regulaciones [[epigenética]] y la actividad sensora de Pc-1 mutada asociadas con vías de señalizacióm como TNF-α.<ref>{{Cita libro|apellidos=Li|nombre=Xiaogang|enlaceautor=|título=Polycystic Kidney Disease|url=http://codonpublications.com/index.php/codon/catalog/view/33/100/234-1|fechaacceso=2018-09-21|año=|fecha=2015-11|editorial=Codon Publications|isbn=9780994438102|doi=10.15586/codon.pkd.2015.ch12|editor=|ubicación=|página=|páginas=283–312|idioma=en|capítulo=Epigenetics in ADPKD: Understanding Mechanisms and Discovering Treatment}}</ref>]]Está reportado que la mutación del gen '''PKD-1''' incrementa la expresión de factores intermediarios en la '''regulación [[epigenética]]''', proteínas modificadoras de [[histonas]], como ADN metiltransferasa (DNMT´s) y [[histona deacetilasa]] (HDAC´s) , al igual [[histona metiltransferasa]] (HMT´s) y poretínas [[bromodominio]]. |
[[File:PKD-1 epigenetics regulation.jpg|thumb|Relación entre regulaciones [[epigenética]] y la actividad sensora de Pc-1 mutada asociadas con vías de señalizacióm como TNF-α.<ref>{{Cita libro|apellidos=Li|nombre=Xiaogang|enlaceautor=|título=Polycystic Kidney Disease|url=http://codonpublications.com/index.php/codon/catalog/view/33/100/234-1|fechaacceso=2018-09-21|año=|fecha=2015-11|editorial=Codon Publications|isbn=9780994438102|doi=10.15586/codon.pkd.2015.ch12|editor=|ubicación=|página=|páginas=283–312|idioma=en|capítulo=Epigenetics in ADPKD: Understanding Mechanisms and Discovering Treatment}}</ref>]]Está reportado que la mutación del gen '''PKD-1''' incrementa la expresión de factores intermediarios en la '''regulación [[epigenética]]''', proteínas modificadoras de [[histonas]], como ADN metiltransferasa (DNMT´s) y [[histona deacetilasa]] (HDAC´s) , al igual [[histona metiltransferasa]] (HMT´s) y poretínas [[bromodominio]].<ref name=":6" /> |
||
El [[promotor (genética)]] para PKD1 contiene un “binding-motif” híbrido entre [[p53]] y [[Sp1]], en el que se |
El [[promotor (genética)]] para PKD1 contiene un “binding-motif” híbrido entre [[p53]] y [[Sp1]], en el que se han encontrado interacciones [[In vivo|''in vivo'']] con [[p53]]. Se ha encontrado que la interacción con p53 decrementa la '''expresión''' de PKD1. Este proceso es, a su vez, regulado por un '''inhibidor''' para todas las HDACs, conocido como Tricostatina A (TSA), el cual puede '''atenuar la represión''' inducida por p53 en PKD1.<ref name=":6" /> |
||
Se han encontrado la expresión específica de dos proteínas importantes en la [[hipertrofia ventricular]], HDAC5 y el factor potenciador de miocito 2c ([[MEF2C]]), durante pruebas de detección de fluído por la PC-1 bajo condiciones de '''estrés'''. Así como altas susceptibilidades de las células renales al '''factor de crecimiento epidérmico''' ([[EGF]]) , lo que prolifera la generación de los quistes.<ref>{{Cita publicación|url=https://link.springer.com/article/10.1007%2Fs00441-006-0226-0|título=Molecular and cellular pathophysiology of autosomal recessive polycystic kidney disease (ARPKD)|apellidos=Sweeney|nombre=William E.|apellidos2=Avner|nombre2=Ellis D.|fecha=2006-06-10|publicación=Cell and Tissue Research|volumen=326|número=3|páginas=671–685|fechaacceso=2018-09-21|idioma=en|issn=0302-766X|doi=10.1007/s00441-006-0226-0}}</ref> |
|||
| ⚫ | En mutaciones embrionales y postnatales de |
||
| ⚫ | En '''mutaciones embrionales y postnatales''' de PKD-1 en ratones, [[SIRT1]] (miembro de la clase 3 de HDACs) la cual puede '''desacetilar histonas''' y otras proteínas se encuentra sobre expresada, parcialmente por c-Myc y el Factor de Necrosis Tumoral alfa (TNF-α). Lo cual demostró en unos estudios con ratones que deleciones en el gen SIRT1 postergar la '''formación de quistes'''. <ref name=":6">{{Cita libro|apellidos=Li|nombre=Xiogang|enlaceautor=|título=Polycystic Kidney Disease [Internet]|url=https://www.ncbi.nlm.nih.gov/books/NBK373385/#s153|fechaacceso=18/109/18|año=2015|editorial=Codon Publications|isbn=978-0-9944381-0-2|editor=|ubicación=6 Calanda Street |
||
Wishart |
Wishart |
||
QLD 4122 |
QLD 4122 |
||
Australia|página=|idioma=inglés|capítulo=Epigenetics in ADPKD: Understanding Mechanisms and Discovering Treatment}}</ref> |
Australia|página=|idioma=inglés|capítulo=Epigenetics in ADPKD: Understanding Mechanisms and Discovering Treatment}}</ref> |
||
== Tratamiento == |
== Tratamiento == |
||
| Línea 111: | Línea 114: | ||
La hipertensión que genera es de gran seriedad ya que empiezaa muy temprano en la enfermedad, a los 32 años en hombres y 34 años en mujeres con ADPKD y con casos de '''hipertensión infantil''' en un 30%. Para controlar esta afección se prescriben inibidores de RAAS ayudada a regular la presión sanguínea, preservar la función renal y así postergando la etapa final de la enfermedad.<ref name=":5" /> |
La hipertensión que genera es de gran seriedad ya que empiezaa muy temprano en la enfermedad, a los 32 años en hombres y 34 años en mujeres con ADPKD y con casos de '''hipertensión infantil''' en un 30%. Para controlar esta afección se prescriben inibidores de RAAS ayudada a regular la presión sanguínea, preservar la función renal y así postergando la etapa final de la enfermedad.<ref name=":5" /> |
||
Otro tratamiento posible es la inhibición de proteínas HDAC junto inhibidores de EGF los cuales pueden proveer de una manera efectiva la prevención de la formación de quistes, sin embargo, estudios sobre el uso de inhibidores de HDCA siguen sin ser publicados<ref>{{Cita publicación|url=https://linkinghub.elsevier.com/retrieve/pii/S092544391000236X|título=Epigenetics and autosomal dominant polycystic kidney disease|apellidos=Li|nombre=Xiaogang|fecha=2011-10|publicación=Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease|volumen=1812|número=10|páginas=1213–1218|fechaacceso=2018-09-21|issn=0925-4439|doi=10.1016/j.bbadis.2010.10.008|pmc=3413450|pmid=20970496}}</ref>, así como el uso de de una variante de la B3, '''niacinamida,''' la cual ha demostrado que puede '''alentar la formación''' de quistes en dosis altas.<ref>{{Cita publicación|url=https://clinicaltrials.gov/ct2/show/study/NCT02140814|título=Uncontrolled, Open Label, Pilot and Feasibility Study of Niacinamide in Polycystic Kidney Disease (NIAC-PKD1)|apellidos=S Yu|nombre=Alana, et al|fecha=Mayo 16 2014|publicación=Clinical Trials NIH|fechaacceso=18/09/18|doi=|pmid=}}</ref> |
|||
Otro tratamiento posible es la inhibición de proteínas |
|||
==Referencias== |
==Referencias== |
||
Revisión del 03:55 21 sep 2018
| Policistina | ||||
|---|---|---|---|---|
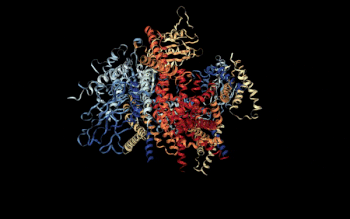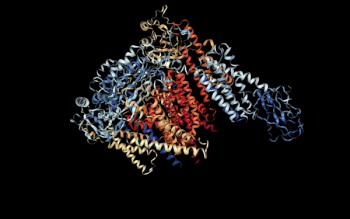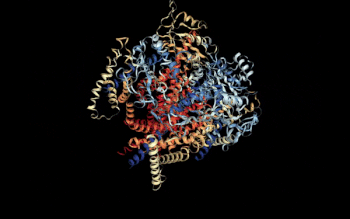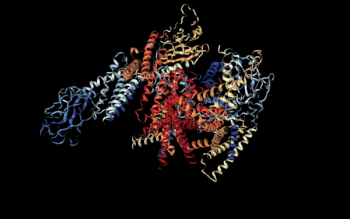 Vista 3D del complejo Policistina-1/Policistina-2 [1] | ||||
| Estructuras disponibles | ||||
| PDB |
Lista de códigos PDB 6A70
| |||
| Identificadores | ||||
| Nomenclatura |
Otros nombres Polycistina, PKD-1, PKD-2
| |||
| Símbolos | PKD1 (HGNC: 9008) PBC, Pc-1, TRPP1 | |||
| Identificadores externos | ||||
| Locus | Cr. 16 p13.3 | |||
| Taxón | Homo Sapiens | |||
| Estructura/Función proteica | ||||
| Tamaño | 4320 Amino ácidos (aminoácidos) | |||
| Peso molecular | 462 kD (Da) | |||
| Tipo de proteína | Canal | |||
| Funciones | Desarrollo renal, transporte de cationes y detección de estímulos mecánicos | |||
| Dominio proteico | 12 | |||
| Motivos | Múltiples motivos | |||
| Datos biotecnológicos/médicos | ||||
| Enfermedades | (ADPKD) Enfermedad Autosómica Dominante de Riñón Poliquístico | |||
| Información adicional | ||||
| Tipo de célula | Células epiteliales polarizadas | |||
| Localización subcelular | Membrana Celular, Cilio | |||
| Interacciones moleculares | Proteínas Wnt, mTOR, Stat3, Jack2/Stat1, Polycistina-2, cAMP, SGP, Vía MAPK/ERK | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| Ensembl |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
| RefSeq (proteína) NCBI |
| |||
| Ubicación (UCSC) |
| |||
| PubMed (Búsqueda) |
| |||
Es un gen que codifica para la proteína integral de membrana Policistina-1, de la familia de policistinas transportadoras de cationes, la cual tiene como función regular canales permeables de calcio, así como la regulación de la homeostasis intracelular del ion.[2] Esta proteína, con un grupo prostético de glucosa, se forma de alrededor de 16 dominios PKD,[3] también se le atribuyen papeles en las interacciones célula-matriz, al igual que la modulación de vías de señalización de proteína G (GPCR).[2] Se le atribuye un rol importante en la generación y desarrollo tubular en los riñones. Mutaciones de esta proteína causan una enfermedad de tipo autosómica dominante, Enfermedad Poliquísitca Renal tipo 1[4] (ADPKD1 en inglés) que se caracteriza por crecimiento de quistes de líquido, que sustituyen el tejido renal generando que, en etapas terminales, causa falla renal.[2]
Proteína
Policistina-1 es una proteína integral relativamente grande, de aproximadamente 460 kDa y 11 subunidades transmembranales,[5] se predice que contiene un N-terminal largo extracelular, circundante a 2,500 aminoácidos y un C-terminal citoplasmático que ronda los 200 aminoácidos.[6] La parte extracelular del N-terminal se caracteriza por poseer 16 copias de una secuencia “Inmunoglobuline-like” o dominios PKD,[6][7] conocidos como repeticiones de policistina, en la última parte de su C-terminal se encuentra enrrollado con el C-terminal de la Policsitina-2.[5]
Función
Policistina-1 (PC-1) que interactúa con varias proteínas, entre ellas Policistina-2 (PC-2) que juntas actúan como un sensor mecánico que controla el flujo de calcio al interior de la célula, así como la cantidad de calcio que sale de la misma,[6][9] se localizan en el primer cilio de las células renales que les sirve como mecano-sensor del fluído.[10] Los dominios extracelulares sensan el flujo de los líquidos, al igual que la presión en el riñón y la presión arterial en células musculares como el cardiomiocito.[11] PC-1 contiene sitios de escisión en ambos N y C terminales, en el N-terminal el corte toma lugar una región de proteína G acoplada a un receptor proteolítico (GPS),[12] mientras que en su extremo C-terminal cuenta con hasta tres sitios de corte, donde uno de ellos es una región putativa de ligado de proteína G y una de ellas libera un péptido, de unos ~35 kDa, que se acumula en el núcleo en respuesta a baja perfusión de líquidos en el riñón.[13] La región extracelular del N-terminal contiene repeticiones ricas en leucina y 4 dominios tipo III relacionados con fibronectina para la comunicación célula-célula/matriz.[14]
Consecuencias de la mutación
Las mutaciones en el gen PKD-1 causan el 85%, del total del fenotipo autosómico dominante de la Enfermedad poliquística renal,[6] que afecta a 1/1000 personas, y es la afección genética letal más común. Es la enfermedad extrarrenal más asociada con muerte prematura y discapacidad vascular, debido a la hipertensión arterial que se presenta gracias a la acativación contínua del sistema renina-angiotensina-aldosterona (RAAS), al igual que aneurisma intracraneal, así como hemorragia subaracnoidea(6%de la mortalidad de la enfermedad).[15] En casos menos comunes se le atribuye dolicoectasia intracraneal (8% de ellos asintomáticos), dilatación de la raiz aórtica, al igual que disecciones en la aorta torácica y arterias cervicocefálicas.[15] Se caracteriza principalmente por la abundancia de quistes grandes y llenos de fluidos. Estos se desarrollan a lo largo de décadas, y su expansión destruye la parénquima renal adyacente, y aproximadamente el 50% de los casos llegan a estados terminales.[16]
Varios estudios asocian la pérdida de heterocigosidad (Tener un gen “sano” y un gen “mutado”) al desarrollo de los quistes.[6]
Los quistes se originan como dilataciones en las paredes de túbulos internos del riñón, que se llenan por fluido filtrado del glomérulo renal. Se desconectan de la nefrona de origen debido al crecimiento excesivo.[17] Se cree que estas respuestas celulares se dan, al menos en parte, por la malformación de cilios y activación de adenosín monofosfato cíclico (cAMP). Sin embargo, se hipotetiza que el crecimiento de estos quistes se da por la secreción de fluidos al quiste y la división celular aumentada en el epitelio del mismo. ADPKD se puede considerar como una enfermedad en la que las células absorbentes del tubo renal adquieren un fenotipo altamente secretorio.[18]
Se observan quistes epiteliales en otros órganos, como páncreas, ovarios, bazo, tiroides, endometrio, vesícula seminal y epidídimo, al igual que en el hígado con prevalencia de 80% después de los 60 años.[19]
Interacciones[17]
- Proteínas Wnt
- mTOR
- Stat3
- Jack2/Stat1
- Polycistina-2
- cAMP
- SGP
- Vía MAPK/ERK
- RAAS[19]
- Hedgehog
Regulaciones Epigenéticas

Está reportado que la mutación del gen PKD-1 incrementa la expresión de factores intermediarios en la regulación epigenética, proteínas modificadoras de histonas, como ADN metiltransferasa (DNMT´s) y histona deacetilasa (HDAC´s) , al igual histona metiltransferasa (HMT´s) y poretínas bromodominio.[21]
El promotor (genética) para PKD1 contiene un “binding-motif” híbrido entre p53 y Sp1, en el que se han encontrado interacciones in vivo con p53. Se ha encontrado que la interacción con p53 decrementa la expresión de PKD1. Este proceso es, a su vez, regulado por un inhibidor para todas las HDACs, conocido como Tricostatina A (TSA), el cual puede atenuar la represión inducida por p53 en PKD1.[21]
Se han encontrado la expresión específica de dos proteínas importantes en la hipertrofia ventricular, HDAC5 y el factor potenciador de miocito 2c (MEF2C), durante pruebas de detección de fluído por la PC-1 bajo condiciones de estrés. Así como altas susceptibilidades de las células renales al factor de crecimiento epidérmico (EGF) , lo que prolifera la generación de los quistes.[22]
En mutaciones embrionales y postnatales de PKD-1 en ratones, SIRT1 (miembro de la clase 3 de HDACs) la cual puede desacetilar histonas y otras proteínas se encuentra sobre expresada, parcialmente por c-Myc y el Factor de Necrosis Tumoral alfa (TNF-α). Lo cual demostró en unos estudios con ratones que deleciones en el gen SIRT1 postergar la formación de quistes. [21]
Tratamiento
El tratamiento contra ADPKD se enfoca en la inhibición de estimulantes de la producción de cAMP, como la vasopresina V2, o la activación de receptores que reducen los niveles celulares de cAMP, como el receptor de somatostatina cuyos análogos han demostrado tener buenos resultados.[17]
La hipertensión que genera es de gran seriedad ya que empiezaa muy temprano en la enfermedad, a los 32 años en hombres y 34 años en mujeres con ADPKD y con casos de hipertensión infantil en un 30%. Para controlar esta afección se prescriben inibidores de RAAS ayudada a regular la presión sanguínea, preservar la función renal y así postergando la etapa final de la enfermedad.[19]
Otro tratamiento posible es la inhibición de proteínas HDAC junto inhibidores de EGF los cuales pueden proveer de una manera efectiva la prevención de la formación de quistes, sin embargo, estudios sobre el uso de inhibidores de HDCA siguen sin ser publicados[23], así como el uso de de una variante de la B3, niacinamida, la cual ha demostrado que puede alentar la formación de quistes en dosis altas.[24]
Referencias
- ↑ Su, Q, et al (5 de agosto de 2018). «Structure of the human PKD1/PKD2 complex». RCSB PDB. doi:10.2210/pdb6A70/pdb. Consultado el 17/09/18.
- ↑ a b c «PKD1 polycystin 1, transient receptor potential channel interacting [Homo sapiens (human)] - Gene - NCBI». www.ncbi.nlm.nih.gov (en inglés). Consultado el 17 de septiembre de 2018.
- ↑ Bycroft, M. et al (15 de enero de 1999). «The structure of a PKD domain from polycystin-1: implications for polycystic kidney disease.». PubMed. PMID 9889186. doi:10.1093/emboj/18.2.297. Consultado el 15 de septiembre de 2018.
- ↑ Calvet, JP; Grantham, JJ (21 de marzo de 2001). «The genetics and physiology of polycystic kidney disease.». PubMed (2): 107-123. PMID 11245774. Consultado el 17/09/18.
- ↑ a b Nims, Nancy; Vassmer, Dianne; Robin L. Maser, Robin (14 de octubre de 2003). «Transmembrane Domain Analysis of Polycystin-1, the Product of the Polycystic Kidney Disease-1 (PKD1) Gene: Evidence for 11 Membrane-Spanning Domains†». Biochemestry 42: 13035-13048. doi:10.1021/bi035074c. Consultado el 17/09/18.
- ↑ a b c d e Merrick, David; A. Bertuccio, Claudia, et al (4 de julio de 2013). «Polycystin-1 Cleavage and the Regulation of Transcriptional Pathways». PubMed. PMID 23824180. doi:10.1007/s00467-013-2548-y. Consultado el https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3844055/.
- ↑ Ibraghimov-Beskrovnaya, O; Bukanov, NO (1 de julio de 2000). «Strong homophilic interactions of the Ig-like domains of polycystin-1, the protein product of an autosomal dominant polycystic kidney disease gene, PKD1.». Hum Mol Genet: 1641-1649. PMID 10861291. Consultado el 17/09/18.
- ↑ Merrick, David; Bertuccio, Claudia A.; Chapin, Hannah C.; Lal, Mark; Chauvet, Veronique; Caplan, Michael J. (4 de julio de 2013). «Polycystin-1 cleavage and the regulation of transcriptional pathways». Pediatric Nephrology (en inglés) 29 (4): 505-511. ISSN 0931-041X. PMC 3844055. PMID 23824180. doi:10.1007/s00467-013-2548-y. Consultado el 21 de septiembre de 2018.
- ↑ Su, Q, et al (5 de agosto de 2018). «Structure of the human PKD1/PKD2 complex». RCSB PDB. doi:10.2210/pdb6A70/pdb. Consultado el 17/09/18.
- ↑ Nauli, SM; Alenghat, FJ, et al (Febrero 2003). «Polycystins 1 and 2 mediate mechanosensation in the primary cilium of kidney cells.». Nat Genet 33. PMID 12514735. doi:10.1038/ng1076. Consultado el 17/09/18.
- ↑ Patel, Amanda; Honoré, Eric (13 de julio de 2010). «Polycystins and renovascular mechanosensory transduction». Nature Reviews Nephrology 6: 530-538. Consultado el 17/09/18.
- ↑ Qian, Feng; Boletta, Alessandra; Anil K., Bhunis, et al (24 de diciembre de 2009). «Cleavage of polycystin-1 requires the receptor for egg jelly domain and is disrupted by human autosomal-dominant polycystic kidney disease 1-associated mutations». PNAS 99: 16981-16986. Consultado el 17/09/18.
- ↑ C. Parnell, Stephen; S. Magenheimer, Brenda (1 de octubre de 2018). «A mutation affecting polycystin-1 mediated heterotrimeric G-protein signaling causes PKD». Human Molecular Genetics 27: 3313-3324. Consultado el 15/09/18.
- ↑ Hughes, J; Ward, CJ, et al (Junio 1995). «The polycystic kidney disease 1 (PKD1) gene encodes a novel protein with multiple cell recognition domains.». Nat Genet. PMID 7663510. doi:10.1038/ng0695-151. Consultado el 15/09/18.
- ↑ a b Rossetti, Sandro; Chauveau, Dominique (28 de enero de 2003). «Association of mutation position in polycystic kidney disease 1 (PKD1) gene and development of a vascular phenotype». The Lancet 361: 2196-2201. doi:10.1016/S0140-6736(03)13773-7. Consultado el 17/09/18.
- ↑ Li, Xiaogang (2015). «1.Differential Diagnosis of Autosomal Dominant Polycystic Kidney Disease». Polycystic Kidey Disease [Internet] (en inglés). 6 Calanda Street Wishart QLD 4122 Australia: Codon Publications. ISBN 978-0-9944381-0-2. Consultado el 18/09/18.
- ↑ a b c Takiar, Vinita; J. Caplan, Michael (Octubre 2011). «Polycystic kidney disease: Pathogenesis and potential therapies». Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. doi:10.1016/j.bbadis.2010.11.014. Consultado el 18/09/18.
- ↑ A. Belibi, Franck; Reif, Gail, et al (Septiembre 2004). «Cyclic AMP promotes growth and secretion in human polycystic kidney epithelial cells». Kidney International. doi:10.1111/j.1523-1755.2004.00843.x. Consultado el 18/09/18.
- ↑ a b c Li, Xiaogang (2015). «Treatment and Management of Autosomal Dominant Polycystic Kidney Disease». Polycystic Kydney Disease [Internet] (en inglés). 6 Calanda Street Wishart QLD 4122 Australia: Codon Publicarions. ISBN 978-0-9944381-0-2. Consultado el 18/09/18.
- ↑ Li, Xiaogang (2015-11). «Epigenetics in ADPKD: Understanding Mechanisms and Discovering Treatment». Polycystic Kidney Disease (en inglés). Codon Publications. pp. 283-312. ISBN 9780994438102. doi:10.15586/codon.pkd.2015.ch12. Consultado el 21 de septiembre de 2018.
- ↑ a b c Li, Xiogang (2015). «Epigenetics in ADPKD: Understanding Mechanisms and Discovering Treatment». Polycystic Kidney Disease [Internet] (en inglés). 6 Calanda Street Wishart QLD 4122 Australia: Codon Publications. ISBN 978-0-9944381-0-2. Consultado el 18/109/18.
- ↑ Sweeney, William E.; Avner, Ellis D. (10 de junio de 2006). «Molecular and cellular pathophysiology of autosomal recessive polycystic kidney disease (ARPKD)». Cell and Tissue Research (en inglés) 326 (3): 671-685. ISSN 0302-766X. doi:10.1007/s00441-006-0226-0. Consultado el 21 de septiembre de 2018.
- ↑ Li, Xiaogang (2011-10). «Epigenetics and autosomal dominant polycystic kidney disease». Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease 1812 (10): 1213-1218. ISSN 0925-4439. PMC 3413450. PMID 20970496. doi:10.1016/j.bbadis.2010.10.008. Consultado el 21 de septiembre de 2018.
- ↑ S Yu, Alana, et al (16 de mayo de 2014). «Uncontrolled, Open Label, Pilot and Feasibility Study of Niacinamide in Polycystic Kidney Disease (NIAC-PKD1)». Clinical Trials NIH. Consultado el 18/09/18.
