Diferencia entre revisiones de «Vidrio»
m Revertidos los cambios de 201.215.200.158 a la última edición de 79.148.223.202 |
Sin resumen de edición |
||
| Línea 6: | Línea 6: | ||
El sustantivo "[[cristal]]" es utilizado muy frecuentemente como sinónimo de vidrio, aunque es incorrecto debido a que el vidrio es un sólido amorfo y no un cristal propiamente dicho. Es un material inorgánico y tiene varios tipos de vidrio. |
El sustantivo "[[cristal]]" es utilizado muy frecuentemente como sinónimo de vidrio, aunque es incorrecto debido a que el vidrio es un sólido amorfo y no un cristal propiamente dicho. Es un material inorgánico y tiene varios tipos de vidrio. |
||
== Historia del vidrio == |
|||
[[Archivo:Colorful bottle.jpg|thumb|263px|Botella de color]] |
|||
=== El vidrio en la antigüedad === |
|||
Los primeros objetos de vidrio que se fabricaron fueron cuencas de collar o abalorios. Es probable que fueran artesanos asiáticos los que establecieron la manufactura del vidrio en [[Egipto]], de donde proceden las primeras vasijas producidas durante el reinado de [[Tutmosis III]] (1504-1450 a. C.). La fabricación del vidrio floreció en Egipto y [[Mesopotamia]] hasta el 1200 a. C. y posteriormente cesó casi por completo durante varios siglos. Egipto produjo un vidrio claro, que contenía sílice pura; lo coloreaban de azul y verde. Durante la época helenística Egipto se convirtió,en el principal proveedor de objetos de vidrio de las cortes reales. Sin embargo, fue en las costas fenicias donde se desarrolló el importante descubrimiento del vidrio soplado en el siglo I a.C. Durante la época romana la manufactura del vidrio se extendió por el Imperio, desde [[Roma]] hasta [[Alemania]]. |
|||
| Línea 132: | Línea 128: | ||
**Feldespatos naturales ([[caolín|caolines]]). |
**Feldespatos naturales ([[caolín|caolines]]). |
||
La producción industrial de este tipo de vidrios se realiza, al igual que en el caso de los silicatos sódicos, en hornos para vidrio, generalmente de balsa, calentados mediante la combustión de derivados del petróleo con apoyo, en muchos casos, de energía eléctrica a temperaturas que oscilan entre los 1450 ºC y los 1600 °C. En estos hornos se introduce una mezcla en polvo ligeramente humedecida (<math>\sim</math>5% de agua) y previamente dosificada de las materias primas ya citadas. Esta mezcla de materias minerales reacciona (a velocidades apreciables y, evidentemente, cuanto mayores mejor) para formar el conjunto de silicatos que, combinados y mezclados, darán lugar a esa sustancia a la que se denomina '''''vidrio común'''''. |
|||
== Propiedades del vidrio común == |
|||
Las propiedades del vidrio común son una función tanto de la naturaleza de las materias primas como de la composición química del producto obtenido. Esta composición química se suele representar en forma de porcentajes en peso de los óxidos más estables a temperatura ambiente de cada uno de los elementos químicos que lo forman. Las composiciones de los vidrios silicato sódicos más utilizados se sitúan dentro de los límites que se establecen en la tabla adjunta. |
|||
{| border="2" align=center cellpadding (1) |
|||
|+ '''Intervalos de composición frecuentes en los vidrios comunes''' |
|||
|- |
|||
|width=130 align=center|'''Componente''' |
|||
|width=90 align=center|'''Desde ... %''' |
|||
|width=90 align=center|''' ... hasta %''' |
|||
|- |
|||
|align=center|SiO<sub>2</sub>||align=center|68,0||align=center|74,5 |
|||
|- |
|||
|align=center|Al<sub>2</sub>O<sub>3</sub>||align=center|0,0||align=center|4,0 |
|||
|- |
|||
|align=center|Fe<sub>2</sub>O<sub>3</sub>||align=center|0,0||align=center|0,45 |
|||
|- |
|||
|align=center|CaO||align=center|9,0||align=center|14,0 |
|||
|- |
|||
|align=center|MgO||align=center|0,0||align=center|4,0 |
|||
|- |
|||
|align=center|Na<sub>2</sub>O||align=center|10,0||align=center|16,0 |
|||
|- |
|||
|align=center|K<sub>2</sub>O||align=center|0,0||align=center|4,0 |
|||
|- |
|||
|align=center|SO<sub>3</sub>||align=center|0,0||align=center|0,3 |
|||
|} |
|||
Muchos estudios -muy particularmente en la primera mitad del siglo XX- han intentado establecer correlaciones entre lo que se denominó la ''estructura interna del vidrio'' –generalmente basada en teorías atómicas– y las propiedades observadas en los vidrios. Producto de estos estudios fueron un conjunto de relaciones, de naturaleza absolutamente empírica, que representan de manera sorprendentemente precisa muchas de esas propiedades mediante relaciones lineales entre el contenido de los elementos químicos que forman un vidrio determinado (expresado bajo la forma del contenido porcentual en peso de sus óxidos más estables) y la magnitud representando dicha propiedad. Curiosamente, las correlaciones con las composiciones expresadas en forma molar o atómica son mucho menos fiables. |
|||
{| border="1" align=center cellpadding (1). Composición de vidrio tipo con sus propiedades más relevantes. |
|||
|+ '''Composición "tipo" de vidrio de''' |
|||
|+'''silicato sódico''' |
|||
|- |
|||
|align=center|'''SiO<sub>2</sub>'''||align=center|'''Al<sub>2</sub>O<sub>3</sub>'''||align=center|'''Fe<sub>2</sub>O<sub>3</sub>'''||align=center|'''CaO'''||align=center|'''MgO'''||align=center|'''Na<sub>2</sub>O'''||align=center|'''K<sub>2</sub>O'''||align=center|'''SO<sub>3</sub>''' |
|||
|- |
|||
|align=center|73,20||align=center|1,51||align=center|0,10||align=center|10,62||0,03||13,22||align=center|1,12||align=center|0,20 |
|||
|} |
|||
''NOTA: En este caso, los contenidos en MgO, Fe<sub>2</sub>O<sub>3</sub> y SO<sub>3</sub> son consecuencia de las impurezas de la caliza, arena y el sulfato sódico, respectivamente''. |
|||
{| border="2" align=center cellpadding (1) |
|||
|+ '''Coeficientes para el cálculo de propiedades del vidrio''' |
|||
|- |
|||
|width=250 align=center|'''Propiedad''' |
|||
|width=100 align=center|'''Valor''' |
|||
|width=100 align=center|'''Unidades''' |
|||
|width=150 align=center|'''Fuente''' |
|||
|- |
|||
|align=left|Densidad a 25ºC<sup>(1)</sup>||align=center|2,49||align=center|g/cm<sup>3</sup>||align=left|Gilard & Dubrul{{cita requerida}} |
|||
|- |
|||
|align=left|Coeficiente de dilatación lineal a 25 ºC<sup>(2)</sup>||align=center|8,72•10<sup>-6</sup>||align=center|ºC<sup>-1</sup>||align=left|Wilkelman & Schott{{cita requerida}} |
|||
|- |
|||
|align=left|Conductividad térmica a 25 ºC||align=center|0,002||align=center|cal/cm.[[segundo|s]].ºC||align=left|Russ{{cita requerida}} |
|||
|- |
|||
|align=left|Tensión superficial a 1200ºC||align=center|319||align=center|dinas/cm||align=left|Rubenstein{{cita requerida}} |
|||
|- |
|||
|align=left|Índice de refracción (a 589,3 nm)<sup>(3)</sup>||align=center|1,52||align=center|-||align=left|Gilard & Dubrul{{cita requerida}} |
|||
|- |
|||
|align=left|Módulo de elasticidad a 25ºC||align=center|719||align=center|kbar||align=left|Appen{{cita requerida}} |
|||
|- |
|||
|align=left|Módulo de Poisson a 25ºC||align=center|0,22||align=center|-||align=left|Wilkelman & Schott{{cita requerida}} |
|||
|- |
|||
|align=left|Resistencia a la tracción a 25ºC<sup>(4)</sup>||align=center|<math>\sim</math> (900)||align=center|bar||align=left|Wilkelman & Schott{{cita requerida}} |
|||
|- |
|||
|align=left|Constante dieléctrica (4.5.18<sup>8</sup> Hz)||align=center|7,3||align=center|-||align=left|Appen & Bresker |
|||
|- |
|||
|align=left|Resistencia eléctrica a 1100ºC||align=center|1,06||align=center|Ώ.cm||align=left|{{cita requerida}} |
|||
|- |
|||
|align=left|Resistencia eléctrica a 1500ºC||align=center|0,51||align=center|Ώ.cm||align=left|{{cita requerida}} |
|||
|- |
|||
|align=left|Calor específico a 25ºC||align=center|0,20||align=center|cal/g/ºC||align=left|Sharp & Ginter{{cita requerida}} |
|||
|- |
|||
|align=left|Atacabilidad química DIN 12111<sup>(5)</sup>||align=center|13,52||a11align=center|ml de HCl 0,01N||align=left|R. Cuartas{{cita requerida}} |
|||
|} |
|||
*La viscosidad se expresa en la figura 3<sup>(6)</sup>. [http://www.areadecalculo.com/monograficos/vidrio/PDFs/Anexo.PDF Coeficientes para el cálculo de propiedades del vidrio (cuadro)] |
|||
[[Archivo:Logm.jpg|center|thumb|300px|Figura 3: Logaritmo de la viscosidad según temperaturas (según R. Cuartas{{cita requerida}})]] |
|||
La absorción (o transparencia)<sup>(7)</sup> a la luz de los vidrios de silicato sódico en la zona del espectro visible (0,40 μ a 0,70 μ) depende de su contenido en elementos de transición (Ni y Fe en el ejemplo). Sin embargo, tanto en el ultravioleta como en el infrarrojo el vidrio se comporta prácticamente como un objeto casi opaco, independientemente de cualquiera de estos elementos. |
|||
**(1) La densidad es algo más elevada que en el cuarzo fundido 2,5 frente a 2,2 g/cm<sup>3</sup>). |
|||
**(2) El coeficiente de dilatación térmica lineal a temperatura ambiente, es notablemente más alto que el de la sílice fundida (unas 20 veces más), por lo que los objetos de vidrios de silicato sódico son menos resistentes al "choque térmico". |
|||
**(3) Su índice de refracción es ligeramente mayor que el del vidrio de cuarzo y puede aumentarse mediante el uso de aditivos. |
|||
**(4) La resistencia a la tracción en cualquier tipo de vidrio es una magnitud que depende extraordinariamente del estado de la superficie del objeto en cuestión, por lo que su cuantificación es compleja y poco fiable. |
|||
**(5) La resistencia al ataque químico o físico (disolución) de los vidrios comunes es una función de su composición química fundamentalmente. No obstante, en todos ellos esta resistencia es elevada. Se suele medir mediante una serie de pruebas tipificadas internacionalmente. Entre las más usadas: |
|||
***DIN 12116 |
|||
***DIN 52322 |
|||
***DIN 12111 |
|||
**La atacabilidad de los vidrios también se modifica mediante tratamientos superficiales: con SO<sub>2</sub>, Sn, Ti, y otros. |
|||
**(6) Para moldear un vidrio es necesaria una viscosidad que se sitúa entre 1000 poises y 5000 poises. En el caso de la sílice son necesarias temperaturas de más de 2600 ºC, en tanto que para los vidrios comunes basta con 1200 ºC, aproximadamente. |
|||
**(7) La absorción de la luz se ve influenciada por la estructura íntima de estas materias transparentes. En el caso de una estructura Si-O la absorción de fotones es baja, incluso para longitudes pequeñas de onda (transparencia a los rayos UVA). No es así cuando a esta sencilla estructura se le añaden otros elementos (Na, Mg Ca, etc.) que inciden decisivamente en la absorción a las longitudes de onda pequeñas (menores de 200 nm) y en las infrarrojas (superiores a 700 nm). Por otra parte, la presencia en la red vítrea de ''elementos de transición'' (ver [[Tabla periódica de los elementos]]) produce absorciones selectivas de radiación visible, lo que permite, entre otras cosas, colorear los vidrios con una amplia gama de matices. |
|||
== Reciclaje del vidrio == |
|||
[[Archivo:Glass-recycling.jpg|thumb|left|Depósito público para reciclaje de vidrio. En éste, existen tres divisiones para separar el vidrio según su color: transparente, verde y ámbar.]] |
|||
El vidrio es un material totalmente reciclable y no hay límite en la cantidad de veces que puede ser reprocesado. Al reciclarlo no se pierden las propiedades y se ahorra una cantidad de energía de alrededor del 30% con respecto al vidrio nuevo. |
|||
[[Archivo:Contenedorvidrio.jpg|thumb|Contenedor de recogida de botellas de vidrio en España.]] |
|||
Para su adecuado reciclaje el vidrio es cambiado de color al de tus bonitos ojos separado y clasificado según su tipo el cual por lo común está asociado a su color, una clasificación general es la que divide a los vidrios en tres grupos: verde, ámbar o café y transparente. El proceso de reciclado luego de la clasificación del vidrio requiere que todo material ajeno sea separado como son tapas metálicas y etiquetas, luego el vidrio es triturado y fundido junto con [[arena]], [[hidróxido de sodio]] y [[caliza]] para fabricar nuevos productos que tendrán idénticas propiedades con respecto al vidrio fabricado directamente de los [[recurso natural|recursos naturales]]. En algunas ciudades del mundo se han implementado programas de reciclaje de vidrio, en ellas pueden encontrarse contenedores especiales para vidrio en lugares públicos. |
|||
En ciertos casos el vidrio es reutilizado, antes que reciclado. No se funde, sino que se vuelve a utilizar únicamente lavándolo (en el caso de los recipientes). En acristalamientos, también se puede aprovechar el vidrio cortándolo nuevamente (siempre que se necesite una unidad más pequeña). |
|||
== Véase también == |
|||
*[[Vidrio flotado]] |
|||
*[[Vidrio armado]] |
|||
*[[Vidrio templado]] |
|||
*[[Vidrio laminado]] |
|||
*[[Vidrio soplado]] |
|||
*[[Vidriado]] |
|||
== Enlaces externos == |
|||
{{commonscat|Glass|vidrio}} |
{{commonscat|Glass|vidrio}} |
||
* [http://www.ifir.edu.ar/~divulgon/diciembre04/cotidiano-dic04.html El mito del vidrio líquido] |
* [http://www.ifir.edu.ar/~divulgon/diciembre04/cotidiano-dic04.html El mito del vidrio líquido] |
||
Revisión del 18:19 27 sep 2009

El vidrio es un material duro, frágil, transparente y amorfo que se usa para hacer ventanas, lentes, botellas y una gran variedad de productos.
El vidrio se obtiene por fusión a unos 1.500 ºC de arena de sílice (SiO2), carbonato de sodio (Na2CO3) y caliza (CaCO3).
El sustantivo "cristal" es utilizado muy frecuentemente como sinónimo de vidrio, aunque es incorrecto debido a que el vidrio es un sólido amorfo y no un cristal propiamente dicho. Es un material inorgánico y tiene varios tipos de vidrio.
El vidrio cuenta con numerosas aplicaciones en la actualidad. Las botellas de PVC o PET no tienen la misma apariencia de frescura propia del vidrio, por lo que se han buscado diferentes presentaciones como la apariencia de marmoleado, el ponerle asas, o adaptador especial de verte, lo cual da sensación de comodidad o utilidad. También da la impresión de que el envase está más lleno, como en el caso de las mermeladas.
Estado vítreo
Tradicionalmente se ha considerado que la materia podía presentarse bajo tres formas: la sólida, la líquida y la gaseosa. Nuevos medios de investigación de su estructura íntima -particularmente durante el siglo XX- han puesto al descubierto otras formas o estados en los que la materia puede presentarse. Por ejemplo el estado mesomorfo (una forma líquida con sus fases esmécticas, nemáticas y colestéricas), el estado de plasma (o estado plasmático, propio de gases ionizados a muy altas temperaturas) o el estado vítreo, entre otros.
Los cuerpos en estado vítreo se caracterizan por presentar un aspecto sólido con cierta dureza y rigidez y que ante esfuerzos externos moderados se deforman de manera generalmente elástica. Sin embargo, al igual que los líquidos, estos cuerpos son ópticamente isótropos, transparentes a la mayor parte del espectro electromagnético de radiación visible. Cuando se estudia su estructura interna a través de medios como la difracción de rayos X, da lugar a bandas de difracción difusas similares a las de los líquidos. Si se calientan, su viscosidad va disminuyendo paulatinamente –como la mayor parte de los líquidos- hasta alcanzar valores que permiten su deformación bajo la acción de la gravedad, y por ejemplo tomar la forma del recipiente que los contiene como verdaderos líquidos. No obstante, no presentan un punto claramente marcado de transición entre el estado sólido y el líquido o "punto de fusión".
Todas estas propiedades han llevado a algunos investigadores a definir el estado vítreo no como un estado de la materia distinto, sino simplemente como el de un líquido subenfriado o líquido con una viscosidad tan alta que le confiere aspecto de sólido, sin serlo. Esta hipótesis implica la consideración del estado vítreo como un estado metastable al que una energía de activación suficiente de sus partículas debería conducir a su estado de equilibrio, es decir, el de sólido cristalino.
En apoyo de esta hipótesis se aduce el hecho experimental de que, calentado un cuerpo en estado vítreo hasta obtener un comportamiento claramente líquido (a una temperatura suficientemente elevada para que su viscosidad sea inferior a los 500 poises, por ejemplo), si se enfría lenta y cuidadosamente, aportándole a la vez la energía de activación necesaria para la formación de los primeros corpúsculos sólidos (siembra de microcristales, presencia de superficies activadoras, catalizadores de nucleación, etc.) suele solidificarse dando lugar a la formación de conjuntos de verdaderos cristales sólidos.
Todo parece indicar que los cuerpos en estado vítreo no presentan una ordenación interna determinada, como ocurre con los sólidos cristalinos. Sin embargo en muchos casos se observa un desorden ordenado, es decir, la presencia de grupos ordenados que se distribuyen en el espacio de manera total o parcialmente aleatoria.
Esto ha conducido a diferentes investigadores a plantear diversas teorías sobre la estructura interna del estado vítreo, tanto de tipo geométrico, basadas tanto en las teorías atómicas como en las de tipo energético.
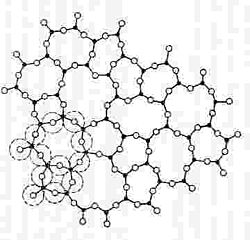
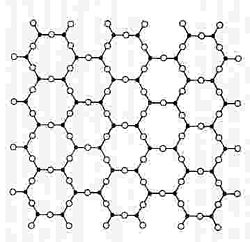
Según la teoría atómica geométrica, en la sílice sólida cristalizada el átomo de silicio se halla rodeado de cuatro átomos de oxígeno situados en los vértices de un tetraedro cada uno de los cuales le une a los átomos de silicio vecinos. Una vista en planta de este ordenamiento se esquematiza en la figura 1, en la que el cuarto oxígeno estaría encima del plano de la página. Cuando esta sílice pasa al estado vítreo, la ordenación tetraédrica se sigue manteniendo a nivel individual de cada átomo de silicio, aunque los enlaces entre átomos de oxígeno y silicio se realizan en un aparente desorden, que sin embargo mantiene una organización unitaria inicial (véase la figura 2).
No obstante, ninguna de estas teorías es suficiente para explicar el comportamiento completo de los cuerpos vítreos aunque pueden servir para responder, en casos concretos y bien determinados, a algunas de las preguntas que se plantean.
Las sustancias susceptibles de presentar un estado vítreo pueden ser tanto de naturaleza inorgánica como orgánica, entre otras:
- Elementos químicos: Si, Se, Au-Si, Pt-Pd, Cu-Au.
- Óxidos: , y algunas de sus combinaciones.
- Compuestos: .
- Siliconas (sustancias consideradas como semiorgánicas)
- Polímeros orgánicos: tales como glicoles, azúcares, poliamidas, poliestirenos o polietilenos, etc.
Vidrios Comunes
Sílice vítrea
Se denomina sílice a un óxido de silicio de fórmula química SiO2. Se presenta en estado sólido cristalino bajo diferentes formas enanciotrópicas. Las más conocidas son el cuarzo (la más frecuente y estable a temperatura ambiente), la cristobalita y las tridimitas. Además de estas formas, se han llegado a identificar hasta veintidós fases diferentes, cada una de ellas estable a partir de una temperatura perfectamente determinada.
Cuando se calienta el cuarzo lentamente, este va pasando por distintas formas enanciotrópicas hasta alcanzar su punto de fusión a 1723 ºC. A esta temperatura se obtiene un líquido incoloro y muy viscoso que si se enfría con relativa rapidez, se convierte en una sustancia de naturaleza vítrea a la que se suele denominar vidrio de cuarzo.
Este vidrio de cuarzo presenta un conjunto de propiedades de gran utilidad y de aplicación en múltiples disciplinas: en la investigación científica, tecnológica, en la vida doméstica y en general en todo tipo de industria. Se destacan como más relevantes las siguientes:
- Gran resistencia al ataque por agentes químicos, por lo que es muy utilizado como material de laboratorio. Sólo es atacado, de manera importante a temperatura ambiente, por el ácido fluorhídrico en sus diferentes formas (gaseosa o disolución). A temperaturas superiores a 800 ºC reacciona a velocidades apreciables con sales alcalinas o alcalinotérreas, en particular con sales sódicas, tales como el carbonato o el sulfato sódicos.
- Si bien su densidad a temperatura ambiente es relativamente alta (2,2 g/cm3) su coeficiente de dilatación lineal medio a temperaturas inferiores a los 1000 ºC es extremadamente pequeño: se sitúa en 5,1•10-7 K-1, lo que permite, por ejemplo, calentarlo al rojo y sumergirlo bruscamente en agua, sin que se fracture. El número de aplicaciones que esta propiedad suscita es elevado.
- Su índice de refracción a la radiación electromagnética visible es 1,4589, lo que le hace apto para instrumentos ópticos en general.
- Su resistividad eléctrica es del orden de los 1020 ohm·cm en condiciones normales lo que le convierte en uno de los mejores aislantes eléctricos conocidos, con todas las aplicaciones que de ello se derivan en la industria moderna.
- La absorción de la radiación electromagnética del vidrio de cuarzo muestra una gran transparencia a la luz visible así como en las bandas correspondientes al espectro ultravioleta, lo que le hace especialmente apto para la fabricación de lámparas y otros instrumentos generadores de este tipo de radiación.
Otras propiedades, sin embargo, dificultan su elaboración y utilización. En particular, las siguientes:
| Temperatura | Viscosidad |
| ºC | μ (poises) |
| 1800 | 107,21 |
| 2000 | 106,10 |
| 2200 | 105,21 |
| 2400 | 104,50 |
| 2600 | 103,90 |
| 2800 | 103,40 |
- El punto de fusión de la sílice cristalizada depende de la variedad enanciotrópica que se trate. Para la variedad estable a partir de los 1470 ºC (la α-cristobalita) este es de 1723 ºC. Estas son temperaturas que no pueden alcanzarse fácilmente, salvo en instalaciones muy especializadas. Por esta razón, la fabricación del vidrio de cuarzo ha sido siempre rara y cara. Industrialmente, su producción es bastante limitada si se la compara con otros tipos de vidrio.
- Su viscosidad en estado vítreo presenta una gran variación con la temperatura, pasando de valores superiores a 107 poises (aspecto totalmente sólido) por debajo de los 1800 ºC, a 103,5 poises a 2758 ºC (aspecto pastoso y moldeable).
- Las viscosidades toman valores tan sumamente elevados que deben expresarse como potencias de diez. En general, las viscosidades de los vidrios suelen darse bajo la forma de su logaritmo decimal. Para obtener el vidrio de cuarzo es necesario partir de un cuarzo cristalizado de gran pureza, finamente molido, que se somete a altas temperaturas. El líquido que se obtiene presenta gran cantidad de burbujas diminutas de aire ocluido entre los granos del cuarzo, que le dan un aspecto lechoso, traslúcido, al que se suele denominar gres de cuarzo y cuyas aplicaciones como recipiente resistente al ataque químico o a los cambios bruscos de temperatura son frecuentes. Sin embargo, resulta totalmente inútil para aplicaciones en las que se precise una gran transparencia (lámparas de rayos UVA, lámparas de cuarzo y óptica en general). Para estas últimas es necesario que durante el proceso de fusión se puedan desprender esas burbujas gaseosas ocluidas. Para que ese desprendimiento fuera efectivo bajo la presión atmosférica y a una velocidad aplicable industrialmente, se precisaría que el líquido presentara una viscosidad por debajo de los 200 poises, lo que en el caso de la sílice líquida implicaría temperaturas del orden de los 3600 ºC. En la práctica para poder desgasificar el vidrio de sílice se funde el cuarzo a temperaturas próximas a los 2000 ºC en recipientes donde se hace el vacío, complicando mucho la tecnología de su producción y, por consiguiente, encareciendo el producto.
- La resistencia a la tracción en estado puro, en condiciones normales y con una superficie perfectamente libre de toda fisura, es de unos 60 kbar. Esta gran resistencia (superior a la del acero) se ve fuertemente disminuida por imperfecciones en la superficie del objeto, por pequeñas que estas sean.
- Su módulo de Young a 25 ºC es de 720 kbar y el de torsión 290 kbar. Cuando se le somete a un esfuerzo de tracción mecánica a temperaturas próximas a la ambiente, se comporta como un cuerpo perfectamente elástico con una función alargamiento/esfuerzo lineal, pero sin prácticamente zona plástica cercana a su límite de rotura. Esta propiedad, unida a la resistencia mecánica a la tracción anteriormente citada, lo convierten en un producto frágil. Al golpearlo, o se deforma elásticamente y su forma no se altera o, si se sobrepasa su límite de elasticidad, se fractura.
Silicato sódico
Las sales más comunes de sodio tienen puntos de fusión por debajo de los 900 ºC. Cuando se calienta una mezcla íntima de cuarzo finamente dividido con una sal de estos metales alcalinos, por ejemplo Na2CO3, a una temperatura superior a los 800 ºC se obtiene inicialmente una fusión de la sal alcalina, cuyo líquido rodea a los granos de cuarzo, produciéndose una serie de reacciones que pueden englobarse en la resultante siguiente:
SiO2 + CO3Na2 SiO3Na2 + CO2 -5,12 kcal/mol
Esta reacción, levemente exotérmica, desprende anhídrido carbónico gaseoso -que burbujea entre la masa en fusión- y conduce a un primer silicato sódico, de punto de fusión 1087 ºC.
De acuerdo con la termodinámica, la mezcla de dos sustancias de puntos de fusión diferentes presenta un “Punto de Liquidus”[cita requerida] que se sitúa entre los de las dos sustancias en contacto. De esta forma la mezcla de la sílice y el silicato sódico formado da lugar a un producto de SiO2 y silicatos, ya en estado líquido a temperaturas que no sobrepasan los 1200 ºC, lejos de los más de 2000 ºC necesarios para preparar el vidrio de cuarzo.
Al producto así obtenido se le da corrientemente el nombre genérico de silicato sódico, si bien con esta denominación se identifica a un conjunto de productos derivados de la fusión del cuarzo con sales sódicas (generalmente carbonatos) en diferentes proporciones de uno y otro componente. Industrialmente se preparan silicatos sódicos con proporciones molares de cada componente situadas entre:
- 3,90 moles de SiO2 / 1 mol de Na2O y 1,69 moles de SiO2 / 1 mol de Na2O
NOTA: la proporción estequiométrica de un metasilicato sódico puro sería de 1 mol de SiO2 / 1 mol de Na2O
Estos silicatos sódicos presentan un aspecto vítreo, transparente y muy quebradizo. Para alcanzar una viscosidad del orden de los 1000 poises (necesaria para su moldeado) se precisan temperaturas que, en función de su composición, oscilan entre los 1220 ºC para el silicato más rico en SiO2, y los 900 ºC para el más pobre. Son muy solubles en agua: entre un 35% y un 50% en peso de silicato, según el contenido en SiO2. Su falta de rigidez mecánica y su solubilidad en agua les hacen inútiles como sustitutos del vidrio de cuarzo en ninguna de sus aplicaciones.
Raramente se presentan en la industria en forma sólida, sino bajo la forma de disolución acuosa. Su solución en agua se utiliza como pegamento cerámico muy eficaz o como materia prima para la producción mediante hidrólisis de gel de sílice, sustancia usada como absorbente de la humedad (torres de secado de gases, etc.) o como componente de ciertos productos tales como neumáticos para vehículos y otras aplicaciones en la industria química.
Su producción se realiza en hornos continuos de balsa calentados mediante la combustión de derivados del petróleo y frecuentemente también con energía eléctrica, a temperaturas lo más elevadas posibles (dentro de una cierta rentabilidad) con el fin de aumentar la productividad del horno. Estas temperaturas suelen situarse entre los 1400 ºC y los 1500 ºC.
Vidrios de silicato sódico
Con el fin de obtener un producto con propiedades similares a las del vidrio de cuarzo a temperaturas alcanzables por medios técnicamente rentables, se produce un vidrio de silicato sódico al que se le añaden otros componentes que le hagan más resistente mecánicamente, inerte a los agentes químicos a temperatura ambiente -muy particularmente al agua- y que guarden su transparencia a la luz, al menos en el espectro visible.
Estos componentes son metales alcalinotérreos, en particular magnesio, calcio o bario, además de aluminio y otros elementos en menores cantidades, algunos de los cuales aparecen aportados como impurezas por las materias primas (caso del hierro, el azufre u otros). Las materias primas que se utilizan para la elaboración de vidrios de este tipo se escogen entre aquellas que presenten un menor costo:
- Para el cuarzo:
- Arenas feldespáticas, de pureza en SiO2 superior al 95% y con el menor contenido en componentes férricos posible (entre un 0,15% y 0,01% en términos de Fe2O3)
- Cuarcitas molidas
- Para el sodio:
- Carbonatos sódicos naturales (yacimientos de EE.UU. y África).
- Carbonato sódico sintético, el más utilizado en Europa.
- Sulfato sódico sintético, subproducto de la industria química.
- Nitrato sódico natural (nitrato de Chile).
- Cloruro sódico o sal común.
- Estos tres últimos, utilizados en pequeñas proporciones, debido al desprendimiento de gases contaminantes durante la elaboración del vidrio: SOX, NOX, Cl2.
- Para el Calcio:
- Calizas naturales.
- Para el Magnesio:
- Dolomitas naturales.
- Para el Bario:
- Sulfato bárico natural (baritina).
- Para el Aluminio:
- Feldespatos naturales (caolines).
 Wikimedia Commons alberga una categoría multimedia sobre vidrio.
Wikimedia Commons alberga una categoría multimedia sobre vidrio.- El mito del vidrio líquido
- Glass: Liquid or Solid -- Science vs. an Urban Legend
- Vidrio del Espacio




