Topoisomerasas tipo I
| Topoisomerasas tipo I | ||
|---|---|---|
 | ||
| Identificadores | ||
| Símbolo | VirDNA-topo-I_N | |
| Pfam | PF09266 | |
| InterPro | IPR015346 | |
| SCOP | 1vcc | |
En biología molecular, las topoisomerasas tipo I son enzimas que cortan una de las dos cadenas de ADN bicatenario, relajan la cadena y vuelven a unir la cadena. Se subdividen en dos topoisomerasas estructural y mecánicamente distintas: tipo IA y tipo IB.
- Las topoisomerasas de tipo IA cambian el número de enlace de una cadena de ADN circular por unidades de estrictamente 1.
- Las topoisomerasas de tipo IB cambian el número de enlace por múltiplos de 1(n).
Históricamente, las topoisomerasas de tipo IA se denominan topo I procarióticas, mientras que las topoisomerasas de tipo IB se denominan topoisomerasas eucariotas. Sin embargo, esta distinción ya no se aplica ya que las topoisomerasas tipo IA y tipo IB existen en todos los dominios de la vida.
Funcionalmente, estas subclases realizan funciones muy especializadas. La topoisomerasa procariota I (topo IA) solo puede relajar el ADN superenrollado negativo, mientras que la topoisomerasa eucariota I (topo IB) puede introducir superenrollamientos positivos, separando el ADN de los cromosomas hijos después de la replicación del ADN, y relajando el ADN.
Función[editar]
Estas enzimas tienen varias funciones: eliminar las superenrollamientos de ADN durante la transcripción y la replicación del ADN; para la rotura de la cadena durante la recombinación; para la condensación cromosómica; y para desenredar el ADN entrelazado durante la mitosis.[1][2]
Estructura[editar]
Este dominio supone un pliegue beta (2) -alfa-beta-alfa-beta (2), con un cruce cruzado zurdo entre las cadenas beta2 y beta3. Tiene cuatro cadenas beta entrecruzadas rodeadas por cuatro hélices alfa que están dispuestas en un pliegue de Rossmann[3]
Mecanismos[editar]
Las topoisomerasas de tipo I son enzimas independientes de ATP (excepto la girosa inversa), y se pueden subdividir de acuerdo con su estructura y mecanismos de reacción: tipo IA (topoisomerasa bacteriana y arqueológica I, topoisomerasa III y girosa inversa) y tipo IB (topoisomerasa eucariota I y topoisomerasa V). Estas enzimas son las principales responsables de relajar el ADN superenrollado de forma positiva y / o negativa, a excepción de la girasa inversa, que puede introducir superenrollamientos positivos en el ADN.
Las topoisomerasas de ADN regulan el número de enlaces topológicos entre dos cadenas de ADN (es decir, cambian el número de vueltas superhelicales) catalizando roturas transitorias de cadena sencilla o doble, cruzando las cadenas entre sí y luego volviendo a cerrar las roturas.[4]
Clases[editar]
Las topoisomerasas de ADN se dividen en dos clases: las enzimas tipo I (EC ; topoisomerasas I, III y V) rompen el ADN de cadena sencilla y las enzimas tipo II (EC; las topoisomerasas II, IV y VI) rompen el ADN de cadena doble.[5]
Topoisomerasas tipo IA[editar]

Introducción[editar]
Las topoisomerasas de tipo IA, que históricamente se dice que se encuentran en procariotas, crean una sola ruptura en el ADN y pasan una segunda cadena o dúplex a través de la ruptura. Este mecanismo de paso de cadena comparte varias características con las topoisomerasas tipo IIA. Ambos forman un intermedio de fosfotirosina 5 'y requieren un ion metálico divalente para realizar su trabajo. A diferencia de las topoisomerasas de tipo II, las topoisomerasas de tipo IA no usan energía para hacer su trabajo (con la notable excepción de la girosa inversa).
Estructura[editar]
Las topoisomerasas tipo IA tienen varios dominios, a menudo numeran el dominio 1-4. El dominio I contiene un dominio de Toprim (un pliegue de Rossman conocido por coordinar iones de magnesio), el dominio IV y el dominio III consisten en un dominio de hélice-giro-hélice (HTH); la tirosina catalítica reside en la HTH del dominio III. El dominio II es un puente flexible entre los dominios III y IV. La estructura de la topoisomerasa tipo IA se asemeja a una cerradura, con los dominios I, III y IV en el fondo de la estructura.[6] La estructura de topo III (véase más abajo) unida al ADN monocatenario[7] (pdb id = 1I7D) muestra cómo se coordinan el dominio HTH y Toprim sobre el ADN.
Variantes de topoisomerasa tipo IA[editar]
Existen varias variantes de las topoisomerasas de tipo IA, que difieren según los apéndices unidos al núcleo principal (a veces denominado "pliegue topográfico"). Los miembros de esta subclase incluyen topo I, topo III (que contienen motivos adicionales de unión al zinc) y girosis inversa. La girasa inversa es particularmente interesante porque se une un dominio ATPasa, que se asemeja al dominio similar a la helicasa del factor de transcripción Rho (la estructura de la girasa inversa fue resuelta por Rodríguez y Stock, EMBO J 2002). La enzima utiliza la hidrólisis de ATP para introducir superenrollamientos positivos y sobreenrolla el ADN, una característica atractiva en los hipertermófilos, en los que se sabe que existe la girasa inversa. Rodríguez y Stock han realizado más trabajos para identificar un "bloqueo" que está involucrado en la comunicación de la hidrólisis de ATP a la introducción de superenrollamientos positivos.
La variante topo III también es muy interesante porque tiene motivos de unión a zinc que se cree que se unen al ADN monocatenario. Se ha identificado que Topo III está asociado con la helicasa BLM (para el síndrome de Bloom) durante la recombinación.
Mecanismo[editar]
Las topoisomerasas de tipo IA operan a través de un mecanismo de paso de cadena, utilizando una sola puerta (en contraste con las topoisomerasas de tipo II). Primero, el ADN monocatenario se une a los dominios III y I. La tirosina catalítica escinde el esqueleto del ADN, creando un intermediario transitorio de fosfotirosina 5'. Luego se separa la ruptura, usando el dominio II como una bisagra, y se pasa un segundo dúplex o cadena de ADN. El dominio III vuelve a unir los extremos del ADN.
Topoisomerasas tipo IB[editar]
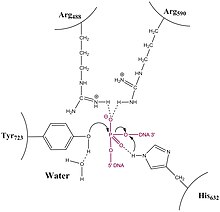

Introducción[editar]
A diferencia de las topoisomerasas de tipo IA, la topoisomerasa de tipo 1B resuelve el problema del ADN sobreenrollado y subenrollado (también denominado superenrollado positivo o negativo) a través de un mecanismo giratorio obstaculizado. Las estructuras cristalinas, la bioquímica y los experimentos con moléculas individuales han contribuido a un mecanismo general. La enzima primero se envuelve alrededor del ADN y crea un único intermedio de fosfotirosina 3'. El extremo 5' puede girar libremente, girándolo sobre la otra cadena, para relajar el ADN hasta que la topoisomerasa vuelva a unir las cadenas rotas.
Estructura[editar]
La estructura de topo IB unida al ADN se ha resuelto (pdb id = 1A36). Topo IB se compone de un NTD, un lóbulo de protección, un lóbulo catalítico y un dominio C-terminal. El lóbulo de protección y el lóbulo catalítico envuelven el ADN.
Mecanismo[editar]
La relajación no es un proceso activo y la energía (en forma de ATP) no se gasta durante los pasos de corte o ligadura; Esto se debe a que la reacción entre el residuo de tirosina en el sitio activo de la enzima con el esqueleto de ADN del fosfodiéster simplemente reemplaza un enlace de fosfomonoéster con otro. La topoisomerasa tampoco utiliza ATP durante el desenrollado del ADN; más bien, el torque presente en el ADN impulsa el desenrollamiento y continúa en promedio enérgicamente cuesta abajo. Experimentos recientes de una sola molécula han confirmado lo que los experimentos de relajación de plásmidos a granel han propuesto anteriormente, que es que el desenrollado del ADN está impulsado por el torque y continúa hasta que ocurre la religión. No hay datos que sugieran que Topo IB "controle" la rotación en la medida en que tenga un mecanismo establecido que desencadene la religión después de que se elimine un número específico de superenrollamientos. Por el contrario, los experimentos con una sola molécula sugieren que la religión es un proceso aleatorio y tiene alguna probabilidad de ocurrir cada vez que el extremo giratorio 5'-OH se acerca al sitio de unión del extremo 3 'ligado a la enzima.
Las topoisomerasas tipo IB se identificaron originalmente en eucariotas y en virus. La topografía viral I es única porque se une al ADN de una manera específica de secuencia.
Consulte el artículo TOP1 para obtener más detalles sobre esta topoisomerasa tipo 1B bien estudiada.
Topoisomerasas de tipo IC[editar]
Se identificó un tercer tipo de topoisomerasa I, topo V, en el arqueón Methanopyrus kandleri. Topo V es el miembro fundador, y hasta ahora el único miembro, del tipo IC topoisomerasa, aunque algunos autores sugieren que puede tener orígenes virales.[8] La estructura cristalina de topo V se resolvió.[9] Las topoisomerasas de tipo IC funcionan a través de un mecanismo rotativo controlado, muy similar a las topoisomerasas de tipo IB[10] (pdb ID = 2CSB y 2CSD), pero el pliegue es único.
Intermedios[editar]
Todas las topoisomerasas forman un intermediario de fosfotirosina entre la tirosina catalítica de la enzima y el fosforilo escindible del esqueleto del ADN.
- Las topoisomerasas de tipo IA forman un enlace covalente entre la tirosina catalítica y el 5'-fosforilo.
- Las enzimas tipo IB forman un intermedio covalente de 3'-fosfotirosina.
- Las topoisomerasas de tipo 1C forman un intermedio covalente de 3'-fosfotirosina.
Este intermedio es isoenergético, lo que significa que la reacción de escisión hacia adelante y la reacción de religión hacia atrás son energéticamente iguales. Como tal, no es necesaria una fuente de energía externa para llevar a cabo esta reacción.
Inhibición[editar]
A medida que las topoisomerasas generan rupturas en el ADN, son blanco de inhibidores de moléculas pequeñas que inhiben la enzima. La topoisomerasa tipo 1 es inhibida por irinotecán, topotecán y camptotecina.
La enzima topoisomerasa humana tipo IB forma un intermedio covalente de 3'-fosfotirosina, el complejo de escisión de topoisomerasa 1 (Top1cc). El metabolito activo de irinotecán, SN-38, actúa atrapando (formando un complejo ternario con) un subconjunto de Top1cc, aquellos con una guanina +1 en la secuencia de ADN.[11] Una molécula SN-38 derivada de irinotecán se acumula contra los pares de bases que flanquean el sitio de escisión inducido por topoisomerasa y envenena (inactiva) la enzima topoisomerasa 1.
Letalidad sintética[editar]
La letalidad sintética surge cuando una combinación de deficiencias en la expresión de dos o más genes conduce a la muerte celular, mientras que una deficiencia en uno solo de estos genes no lo hace. Las deficiencias pueden surgir por mutación, alteración epigenética o por inhibición de la expresión de un gen.
La inhibición de la topoisomerasa 1 es sintéticamente letal con deficiencia de expresión de ciertos genes de reparación de ADN. En pacientes humanos, los genes de reparación de ADN deficientes incluyen WRN[12] y MRE11.[13] En estudios preclínicos relacionados con el cáncer, los genes de reparación de ADN deficientes incluyen ATM[14] y NDRG1.[15][16]
Autoanticuerpos[editar]
Los autoanticuerpos dirigidos contra la topoisomerasa tipo I se denominan anticuerpos anti-Scl-70, nombrados por la asociación con scl eroderma y el fragmento inmunorreactivo extraíble de 70 kD que puede obtenerse del antígeno de topoisomerasa diana de otro modo más grande (100-105 kD) (llamado SCL -70 antígeno) de los anticuerpos.
Referencias[editar]
- ↑ Wang JC (June 2002). «Cellular roles of DNA topoisomerases: a molecular perspective». Nat. Rev. Mol. Cell Biol. 3 (6): 430-40. PMID 12042765. doi:10.1038/nrm831.
- ↑ Champoux JJ (2001). «DNA topoisomerases: structure, function, and mechanism». Annu. Rev. Biochem. 70: 369-413. PMID 11395412. doi:10.1146/annurev.biochem.70.1.369.
- ↑ Sharma A; Hanai R; Mondragón A (August 1994). «Crystal structure of the amino-terminal fragment of vaccinia virus DNA topoisomerase I at 1.6 A resolution». Structure 2 (8): 767-77. PMID 7994576. doi:10.1016/s0969-2126(94)00077-8.
- ↑ Roca J (April 1995). «The mechanisms of DNA topoisomerases». Trends Biochem. Sci. 20 (4): 156-60. PMID 7770916. doi:10.1016/s0968-0004(00)88993-8.
- ↑ Gadelle, Danièle; Filée, Jonathan; Buhler, Cyril; Forterre, Patrick (2003-03). «Phylogenomics of type II DNA topoisomerases: Review articles». BioEssays (en inglés) 25 (3): 232-242. doi:10.1002/bies.10245.
- ↑ Lima, C. D.; Wang, J. C.; Mondragón, A (1994). «Three-dimensional structure of the 67K N-terminal fragment of E. Coli DNA topoisomerase I». Nature 367 (6459): 138-46. PMID 8114910. doi:10.1038/367138a0.
- ↑ Changela, A; Digate, R. J.; Mondragón, A (2001). «Crystal structure of a complex of a type IA DNA topoisomerase with a single-stranded DNA molecule». Nature 411 (6841): 1077-81. PMID 11429611. doi:10.1038/35082615.
- ↑ Forterre, Patrick (2006-06). «DNA topoisomerase V: a new fold of mysterious origin». Trends in Biotechnology (en inglés) 24 (6): 245-247. doi:10.1016/j.tibtech.2006.04.006.
- ↑ Taneja, Bhupesh; Patel, Asmita; Slesarev, Alexei; Mondragón, Alfonso (25 de enero de 2006). «Structure of the N-terminal fragment of topoisomerase V reveals a new family of topoisomerases». The EMBO Journal 25 (2): 398-408. ISSN 0261-4189. doi:10.1038/sj.emboj.7600922.
- ↑ Taneja, B; Schnurr, B; Slesarev, A; Marko, J. F.; Mondragón, A (2007). «Topoisomerase V relaxes supercoiled DNA by a constrained swiveling mechanism». Proceedings of the National Academy of Sciences 104 (37): 14670-5. PMC 1976220. PMID 17804808. doi:10.1073/pnas.0701989104.
- ↑ «Drugging topoisomerases: lessons and challenges». ACS Chem. Biol. 8 (1): 82-95. 2013. PMC 3549721. PMID 23259582. doi:10.1021/cb300648v.
- ↑ «Epigenetic inactivation of the premature aging Werner syndrome gene in human cancer». Proc. Natl. Acad. Sci. U.S.A. 103 (23): 8822-7. 2006. PMC 1466544. PMID 16723399. doi:10.1073/pnas.0600645103.
- ↑ «MRE11-deficiency associated with improved long-term disease free survival and overall survival in a subset of stage III colon cancer patients in randomized CALGB 89803 trial». PLoS ONE 9 (10): e108483. 2014. PMC 4195600. PMID 25310185. doi:10.1371/journal.pone.0108483.
- ↑ «ATM expression predicts Veliparib and Irinotecan sensitivity in gastric cancer by mediating P53 independent regulation of cell cycle and apoptosis». Mol. Cancer Ther. 15 (12): 3087-3096. 2016. PMID 27638859. doi:10.1158/1535-7163.MCT-15-1002.
- ↑ «Identification of cetrimonium bromide and irinotecan as compounds with synthetic lethality against NDRG1 deficient prostate cancer cells». Cancer Biol. Ther. 14 (5): 401-10. 2013. PMC 3672184. PMID 23377825. doi:10.4161/cbt.23759.
- ↑ «mTOR regulates the expression of DNA damage response enzymes in long-lived Snell dwarf, GHRKO, and PAPPA-KO mice». Aging Cell 16 (1): 52-60. 2016. PMC 5242303. PMID 27618784. doi:10.1111/acel.12525.
Enlaces externos[editar]
- MeSH: DNA+Topoisomerases,+Type+I (en inglés)
