Tioéster

Los Tioésteres son compuestos que resultan de la unión de un sulfuro con un grupo acilo con la fórmula general R-S-CO-R'. Son un producto de la esterificación entre un ácido carboxílico y un tiol (en analogía a un grupo alcohol en los ésteres regulares).
En bioquímica un tioéster suele ser un derivado de la coenzima A y conecta, por ejemplo, los grupos acetilo del acetil-CoA y malonil-CoA.[1]
Síntesis[editar]
La ruta más típica para sintetizar tioésteres involucra la reacción de un cloruro de ácido con un tiolato (base conjugada de un tiol) de un metal alcalino:[1]
Otra ruta común implica el desplazamiento de haluros por la sal de metal alcalino de un ácido tiocarboxílico. Un ejemplo de esto es la preparación de ésteres de tioacetato mediante la alquilación de tioacetato de potasio.
Donde X puede ser cualquier halógeno.
La alquilación análoga de una sal de acetato raramente se realiza. La alquilación puede ser llevada a cabo mediante bases de Mannich y el ácido tiocarboxílico.
Otra opción más es la síntesis de tioésteres mediante la condensación de tioles y ácidos carboxílicos en presencia de agentes deshidratantes:[2][3]
Un agente desecante típico es el DCC[4] Los anhídridos de ácido y algunas lactonas también forman tioésteres al reaccionar con tioles en medio básico. Los tioésteres también pueden ser convenientemente preparados mediante alcoholes a través de la reacción de Misunobu usando ácido tioacético.[5]
También se puede lograr mediante carbonilación de alquinos y alquenos en presencia de tioles.[6]
Los tioésteres y el origen de la vida[editar]
Algunos bioquímicos piensan que los enlaces tioéster son críticos para el origen de la vida. Un científico belga y premio Nobel, Christian de Duve, propuso la existencia del "Mundo del tioéster", que precedió y dio lugar al mundo de ARN, que sería el precursor inmediato de la aparición de las entidades que conocemos como organismos.[7]
Tal y como explica de Duve:
- ...un tioéster se forma cuando un sulfhidrilo (cuya forma general se escribe con un grupo orgánico, R, unido con el azufre y el hidrógeno, es decir R-SH) se le añade un ácido carboxílico (R'-COOH). Una molécula de agua (H2O) se libera en el proceso y lo que queda es un tioéster: R-S-CO-R'. ...
- El enlace tioéster es lo que los bioquímicos llaman un enlace de alta energía, equivalente a los enlaces fosfatos en la adenosina trifosfato (ATP), que es el principal suministrador de energía en todos los organismos vivos ...
- Es revelador que los tioésteres sean intermediarios obligados en varios procesos claves en los que el ATP se usa o regenera. Los tioésteres están implicados en la síntesis de todos los ésteres, incluyendo los que se encuentran en los lípidos complejos. También participan en la síntesis de algunos componentes celulares más, incluyendo los péptidos, los ácidos grasos, esteroles, terpenos, porfirinas y otros. Además, los tioésteres se forman como intermediarios claves de algunos procesos particularmente antiguos que acaban en la producción de ATP. En cualquiera de estas instancias, los tioésteres están más cerca que el ATP del proceso que usa o produce energía. En otras palabras, los tioésteres pueden haber desempeñado realmente el papel del ATP en un mundo de tioésteres en el que el ATP estaba inicialmente ausente. Eventualmente, éstos pudieron haber servido de introductores del ATP gracias a su capacidad de promover la formación de enlaces entre grupos fosfato.
Tionoésteres[editar]

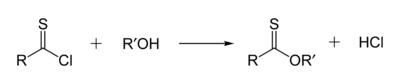
Los tionoésteres son isoméros de los tioésteres. En un tionoéster, el azufre reemplaza el oxígeno carbonilo de un éster. El metil tionobenzoato es C6H5C(S)OCH3. Estos compuestos se preparan típicamente en la reacción del cloruro de tioacilo con el alcohol, pero también se pueden producir por la reacción del reactivo de Lawesson con los ésteres.[8]
Referencias[editar]
- ↑ a b Janssen, Matthys J. (1969). Carboxylic Acids and Esters (1969) (en inglés). John Wiley & Sons, Ltd. pp. 705-764. ISBN 978-0-470-77109-9. doi:10.1002/9780470771099.ch15. Consultado el 1 de diciembre de 2020.
- ↑ Fujiwara, Shin-ichi; Kambe, Nobuaki (2005). Kato, Shinzi, ed. Chalcogenocarboxylic Acid Derivatives: -/-. Topics in Current Chemistry (en inglés). Springer. pp. 87-140. ISBN 978-3-540-31465-3. doi:10.1007/b101007. Consultado el 1 de diciembre de 2020.
- ↑ «Thioester and thioacid synthesis by acylation of thiols (thiolation)». www.organic-chemistry.org. Consultado el 1 de diciembre de 2020.
- ↑ «http://www.orgsyn.org/demo.aspx?prep=V84P0285». www.orgsyn.org (en inglés). Consultado el 1 de diciembre de 2020.
- ↑ Volante, R. P. (1 de enero de 1981). «A new, highly efficient method for the conversion of alcohols to thiolesters and thiols». Tetrahedron Letters (en inglés) 22 (33): 3119-3122. ISSN 0040-4039. doi:10.1016/S0040-4039(01)81842-6. Consultado el 1 de diciembre de 2020.
- ↑ Bertleff, Werner; Roeper, Michael; Sava, Xavier (2007). Ullmann's Encyclopedia of Industrial Chemistry (en inglés). American Cancer Society. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a05_217.pub2. Consultado el 1 de diciembre de 2020.
- ↑ de Duve, Christian (Sept./Oct. 1995), American Scientist
- ↑ R. J. Cremlyn “An Introduction to Organosulfur Chemistry” John Wiley and Sons: Chichester (1996). ISBN 0 471 95512 4.




