Simetría proteica
Simetría
[editar]Las subunidades idénticas de las proteínas multiméricas se ordenan generalmente en uno o en un número limitado de patrones de simetría. Los oligómeros pueden tener simetría rotatoria o simetría helicoidal; esto es, se pueden suponer (haciéndolas coincidir) unas subunidades individuales a las otras mediante la rotación a lo largo de uno más ejes de rotación o mediante una rotación helicoidal.
En proteínas con simetría rotatoria, las subunidades se empaquetan alrededor de los ejes de rotación para formar estructuras cerradas.
Las proteínas con simetría helicoidal tienden a formar estructuras que están más abiertas por los extremos, con las subunidades añadidas según una oredenación en espiral.[1]
Simetría rotatoria
[editar]Existen diferententes tipos de simetría rotatoria.
Simetría cíclica
[editar]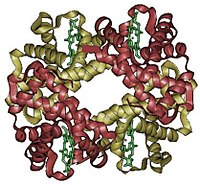
La más sencilla es la simetría cíclica, que implica la rotación alrededor de un eje único. Por convención, una proteína es simétrica Cn (C de cíclico y n por el número de subunidades relacionadas por el eje), si las subunidades se pueden superponer mediante rotación alrededor de un único eje. El eje se define como un eje rotacional de orden n. Los protómeros α y β de la hemoglobina están relacionados por un eje de simetría C2.[1]
Simetría diédrica
[editar]
Una simetría rotatoria un poco más complicada es la simetría diédrica, en la que un eje de rotación binario intersecciona en ángulo recto con un eje de orden n; esta simetría se define como Dn. Una proteína con simetría diédrica tiene 2n protómeros.[1][2]
Simetría icosaédrica
[editar]Son posibles simetrías rotatorias más complejas, pero solo unas pocas se encuentran con regularidad.
Un ejemplo es la simetría icosaedrica. Un icosaedro es un poliedro regular con 12 vértices y 20 caras triangulares equilaterales. Puede hacerse coincidir cada cara con otra mediante la rotación alrededor de uno o más de sus tres ejes rotacionales. Esta estructura es común en las cubiertas de los virus o cápsidas. Los polivirus humanos tienen una cápsida icosaédrica. Cada cara triangular está constituida por tres protómeros, y a su vez cada protómero contiene una única copia de cuatro cadenas polipeptídicas diferentes, tres de las cuales son accesibles a la superficie externa. Las 20 caras de la cubierta icosaédrica que encierra el material genético (RNA) están formada por 60 protómeros.
Las proteínas con simetría cíclica o diédrica son más abundantes que las que presentan simetría icosaédrica.[1]
Simetría helicoidal
[editar]La simetría helicoidal, que es la otra clase principal de simetría encontrada en oligómeros, también se da en las cápsidas.
Un ejemplo de estructura con simetría helicoidal es la cápside del virus del mosaico del tabaco está formado por un filamento helicoidal dextrógiro constituido por 2130 subunidades idénticas. Esta estructura cilíndrica encierra el RNA vírico.
Las proteínas con subunidades dispuestas en filamentos helicoidales también pueden formar largas estructuras fibrosas tales como los filamentos de actina del músculo.[1][2]
Bibliografía
[editar]- ↑ a b c d e David L. Nelson, Michael M. Cox, Claudi M.Cuchillo; Lehninger - Principios de Bioquímica; cuarta edición(2005); editorial Omega; ISBN 84-282-1410-7
- ↑ a b Christopher K. Mathews, K. E. van Holde,Kevin G. Ahern; Bioquímica, tercera edición (2002); editorial Addison Wesley; ISBN 84-7829-053-2
.
