Región locomotora mesencefálica
| Región locomotora mesencefálica | ||
|---|---|---|
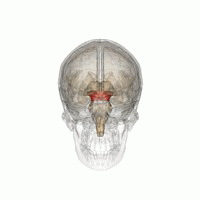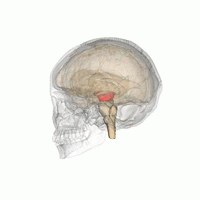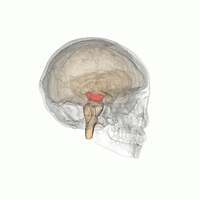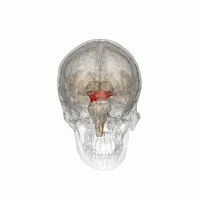 El mesencéfalo. | ||
|
| ||
La región locomotora mesencefálica (MLR por sus siglas en inglés, de Mesencephalic locomotor region ) es un área funcionalmente definida del mesencéfalo que está asociada con la iniciación y el control de los movimientos locomotores en especies vertebradas.[1][2]
Historia[editar]

La MLR (región locomotora mesencefálica) fue descrita por primera vez por Shik y sus colegas en 1966, cuando observaron que la estimulación eléctrica de una región del mesencéfalo en gatos descerebrados producía el comportamiento de caminar y correr en una cinta.[3] Veintiocho años después, Masdeu y sus colegas describieron la presencia de una MLR en humanos.[4] Ahora se reconoce ampliamente que, junto con otros centros de control motor del cerebro, la MLR desempeña un papel activo en la iniciación y modulación de los circuitos neuronales espinales para controlar la postura y la marcha.[5]
Organización neuroanatómica[editar]
Anatómicamente, como su nombre indica, la MLR se encuentra en el mesencéfalo, ventral al colículo inferior y cerca del núcleo cuneiforme.[6] Aunque la identificación de los sustratos anatómicos exactos de la MLR ha sido objeto de considerable debate, se cree que el núcleo pedunculopontino (PPN), el núcleo cuneiforme (CN) y el área extrapiramidal del mesencéfalo (MEP) forman la base neuroanatómica de la MLR.[7][8][9] Los núcleos de la MLR reciben información de la sustancia negra de los ganglios basales y de centros neuronales del sistema límbico.[9] Las proyecciones de la MLR descienden a través de los tractos reticuloespinales medular y pontino para actuar sobre las motoneuronas espinales que irrigan el tronco y los flexores y extensores proximales de las extremidades.[10]
El PPN dentro de la MLR está compuesto por una población diversa de neuronas que contienen los neurotransmisores ácido gamma-amino-butírico (GABA), glutamato y acetilcolina (ACh).[10] Los resultados de estudios animales y clínicos sugieren que las neuronas colinérgicas de la PPN desempeñan un papel crucial en la modulación tanto del ritmo de locomoción como del tono muscular postural.[11][12] Los aportes glutamatérgicos y colinérgicos de la MLR pueden ser responsables de regular la excitabilidad de las neuronas reticuloespinales que, a su vez, se proyectan a los generadores de patrones centrales espinales para iniciar el paso.[13]
Importancia clínica[editar]
La integración de la información motora y sensorial durante la marcha implica la comunicación entre los circuitos corticales, subcorticales y espinales. Los patrones motores de las extremidades inferiores similares a los pasos pueden inducirse únicamente mediante la activación de los circuitos espinales;[14] sin embargo, la entrada supraespinal es necesaria para la marcha bípeda funcional en humanos.[15][16] Las patologías de los núcleos de la MLR se han asociado con una combinación de características clínicas que son exclusivas de la disfunción del mesencéfalo y pueden diferenciarse de otras afecciones neurológicas subcorticales como las asociadas con el parkinsonismo y las lesiones cerebelosas.[17]
En una serie de casos clínicos, tres hombres adultos con lesiones aisladas de la MLR presentaron vacilación al andar y ataxia al andar caracterizada por pasos que carecían de dirección, amplitud y ritmicidad uniformes.[18] Aunque la vacilación y la ataxia de la marcha también son características clínicas de la enfermedad de Parkinson y de lesiones del cerebelo, respectivamente, los autores observaron que los pacientes no mostraban ningún otro signo o síntoma común asociado con estas afecciones neurológicas, lo que sugiere que las patologías del mesencéfalo pueden producir alteraciones de la marcha incluso cuando la función cerebelosa y de los ganglios basales están intactas. En un estudio en el que se investigaron los trastornos de alto nivel de la marcha y el equilibrio en adultos mayores que no presentaban indicios de enfermedad reumatológica, ortopédica o neurológica, los datos de las imágenes cerebrales revelaron una asociación entre la reducción de la densidad de materia gris del PPN y el núcleo cuneiforme y el deterioro de la iniciación de la marcha, la ejecución de los pasos y el control postural.[19] Además, entre dieciocho individuos con enfermedad de Parkinson que experimentaron o no congelamiento de la marcha, las imágenes de resonancia magnética funcional revelaron una actividad reducida en la MLR y el área motora suplementaria entre aquellos individuos que experimentaron vacilación episódica de la marcha.[20] El congelamiento de la marcha también se ha asociado con la reorganización funcional de las redes locomotoras supraespinales, en las que se observó una alteración de la conectividad y la comunicación entre el área motora suplementaria y la MLR.[21] Estos hallazgos sugieren que la MLR desempeña de hecho un papel único en la locomoción humana, especialmente con respecto a la iniciación del paso y la actividad motora.
Estimulación cerebral profunda[editar]
Dado el papel de la MLR en el inicio de la marcha y el control postural, los investigadores y los médicos han investigado los efectos de la estimulación cerebral profunda (ECP) dirigida sobre las alteraciones de la marcha en poblaciones clínicas.[22][23] Plaha y Gill informaron de mejoras significativas en la disfunción de la marcha y la inestabilidad postural en dos pacientes con enfermedad de Parkinson avanzada que fueron tratados con electrodos de ECP implantados en la región del PPN.[24] Asimismo, en un estudio más reciente, seis pacientes con enfermedad de Parkinson demostraron mejoras en la postura, la marcha y la estabilidad postural tras 6 meses de ECP en el PPN y el núcleo subtalámico.[25] Bachmann y sus colegas aplicaron ECP en el MLR en ratas con lesión medular crónica e incompleta e informaron de una mejora de la función de las extremidades posteriores y una restauración casi normal de la función locomotora tras el tratamiento.[26]
Véase también[editar]
Referencias[editar]
- ↑ Le Ray, D; Juvin, L; Ryczko, D; Dubuc, R (2011). «Chapter 4 - Supraspinal control of locomotion: the mesencephalic locomotor region.». Progress in Brain Research 188: 51-70. PMID 21333802. doi:10.1016/B978-0-444-53825-3.00009-7.
- ↑ Pahapill, P; Lozano, A (2000). «The pedunculopontine nucleus and Parkinson's disease.». Brain 123 (9): 1767-1783. PMID 10960043. doi:10.1093/brain/123.9.1767.
- ↑ Shik, ML.; Severin, FV.; Orlofsky, GN. (1966). «Control of walking and running by means of electrical stimulation of the midbrain.». Biophysics (Oxf) 11: 756-765.
- ↑ Masdeu, JC.; Alampur, U.; Cavaliere, R.; Tavoulareas, G. (1994). «Astasia and gait failure with damage of the pontomesencephalic locomotor region.». Annals of Neurology 35 (5): 619-621. PMID 8179307. S2CID 2193366. doi:10.1002/ana.410350517.
- ↑ Takakusaki, K. (2017). «Functional neuroanatomy for posture and gait control.». Journal of Movement Disorders 10 (1): 1-17. PMC 5288669. PMID 28122432. doi:10.14802/jmd.16062.
- ↑ Pearson, KG.; Gordon, JE. (2013). Principles of Neural Science: Locomotion. (5th edición). New York: The McGraw-Hill.
- ↑ Skinner, RD.; Garcia-Rill, E. (1984). «The mesencephalic locomotor region (MLR) in the rat.». Brain Research 323 (2): 385-389. PMID 6525525. S2CID 46258649. doi:10.1016/0006-8993(84)90319-6.
- ↑ Chang, Stephano J.; Cajigas, Iahn; Opris, Ioan; Guest, James D.; Noga, Brian R. (21 de agosto de 2020). «Dissecting Brainstem Locomotor Circuits: Converging Evidence for Cuneiform Nucleus Stimulation». Frontiers in Systems Neuroscience 14: 64. ISSN 1662-5137. PMC 7473103. PMID 32973468. doi:10.3389/fnsys.2020.00064.
- ↑ a b Sherman, D.; Fuller, PM.; Marcus, J.; Yu, J.; Zhang, P.; Chamberlin, NL.; Saper, CB.; Lu, J. (2015). «Anatomical location of the mesencephalic locomotor region and its possible role in locomotion, posture, cataplexy, and Parkinsonism.». Frontiers in Neurology 6 (140): 140. PMC 4478394. PMID 26157418. doi:10.3389/fneur.2015.00140.
- ↑ a b Takakusaki, K.; Tomita, N.; Yano, M. (2008). «Substrates for normal gait and pathophysiology of gait disturbances with respect to the basal ganglia dysfunction.». Journal of Neurology 255 (Suppl 4): 19-29. PMID 18821082. S2CID 22009992. doi:10.1007/s00415-008-4004-7.
- ↑ Bohnen, NI; Albin, RL (2011). «The cholinergic system and Parkinson disease.». Behavioural Brain Research 221 (2): 564-573. PMC 2888997. PMID 20060022. doi:10.1016/j.bbr.2009.12.048.
- ↑ Takakusaki, K; Obara, K; Nozu, T; Okumura, T (2011). «Modulatory effects of the GABAergic basal ganglia neurons on the PPN and the muscle tone inhibitory system in cats.». Archives Italiennes de Biologie 149 (4): 385-405. PMID 22205597. doi:10.4449/aib.v149i4.1383.
- ↑ Skinner, RD; Kinjo, N; Henderson, V; Garcia-Rill, E (1990). «Locomotor projections from the pedunculopontine nucleus to the spinal cord.». Neurological Reports 1 (3): 183-186. PMID 2129877. doi:10.1097/00001756-199011000-00001.
- ↑ Whelan, PJ (2003). «Developmental aspects of spinal locomotor function: insights from using the in vitro mouse spinal cord preparation.». Journal of Physiology 553 (Pt 3): 695-706. PMC 2343637. PMID 14528025. doi:10.1113/jphysiol.2003.046219.
- ↑ Nielsen, Jens Bo (2003). «How we walk: central control of muscle activity during human walking.». Neuroscientist 9 (3): 195-204. PMID 15065815. S2CID 34448912. doi:10.1177/1073858403009003012.
- ↑ Capaday, Charles (2002). «The special nature of human walking and its neural control.». Trends in Neurosciences 25 (7): 370-376. PMID 12079766. S2CID 19997715. doi:10.1016/s0166-2236(02)02173-2.
- ↑ Ruchalski, K; Hathout, GM (2012). «A medley of midbrain maladies: a brief review of midbrain anatomy and syndromology for radiologists.». Radiology Research and Practice 2012: 258524. PMC 3366251. PMID 22693668. doi:10.1155/2012/258524.
- ↑ Hathout, GM; Bhidayasiri, R (2005). «Midbrain ataxia: an introduction to the mesencephalic locomotor region and the pedunculopontine nucleus.». American Journal of Roentgenology 184 (3): 953-956. PMID 15728623. doi:10.2214/ajr.184.3.01840953.
- ↑ Demain, A; Westby, M; Fernandez-Vidal, S; Karachi, C; Bonneville, F; Do, MC; Delmaire, C; Dormont, D; Bardinet, E; Agid, Y; Chastan, N; Welter, ML (2014). «High-level gait and balance disorders in the elderly: a midbrain disease?». Journal of Neurology 261 (1): 196-206. PMC 3895186. PMID 24202784. doi:10.1007/s00415-013-7174-x.
- ↑ Peterson, DS; Pickett, KA; Duncan, R; Perlmutter, J; Earhart, GM (2014). «Gait-related brain activity in people with Parkinson disease with freezing of gait.». PLOS ONE 9 (3): e90634. Bibcode:2014PLoSO...990634P. PMC 3940915. PMID 24595265. doi:10.1371/journal.pone.0090634.
- ↑ Fling, BW; Cohen, RG; Mancini, M; Carpenter, SD; Fair, DA; Nutt, JG; Horak, FB (2014). «Functional reorganization of the locomotor network in Parkinson patients with freezing gait.». PLOS ONE 9 (6): e100291. Bibcode:2014PLoSO...9j0291F. PMC 4061081. PMID 24937008. doi:10.1371/journal.pone.0100291.
- ↑ Hamani, C; Scellig, S; Laxton, A; Lozano, AM (2007). «The pedunculopontine nucleus and movement disorders: anatomy and the role for deep brain stimulation.». Parkinsonism and Related Disorders 13: S276-80. PMID 18267250. doi:10.1016/s1353-8020(08)70016-6.
- ↑ Richardson, M (2014). «Deep brain stimulation for locomotor recovery following spinal cord injury.». Neurosurgery 74 (2): N18-9. PMID 24435148. doi:10.1227/01.neu.0000442979.07078.ac.
- ↑ Plaha, P; Gill, S (2005). «Bilateral deep brain stimulation of the pedunculopontine nucleus for Parkinson's disease.». NeuroReport 16 (17): 1883-1887. PMID 16272872. S2CID 20912030. doi:10.1097/01.wnr.0000187637.20771.a0.
- ↑ Stefani, A; Lozano, AM; Peppe, A; Stanzione, P; Galati, S; Tropepi, D (2007). «Bilateral deep brain stimulation of the pedunculopontine and subthalamic nuclei in severe Parkinson's disease.». Brain 130 (6): 1596-1607. PMID 17251240. doi:10.1093/brain/awl346.
- ↑ Bachmann, LC; Matis, A; Lindau, NT; Felder, P; Gullo, M; Schwab, ME (2013). «Deep brain stimulation of the midbrain locomotor region improves paretic hindlimb function after spinal cord injury in rats.». Science Translational Medicine 5 (208): 208. PMID 24154600. S2CID 39733797. doi:10.1126/scitranslmed.3005972.
Enlaces externos[editar]
- Decerebrate cat walks
- Multi-Layered Multi-Pattern Central Pattern Generator for Adaptive Locomotion of Humanoid Robots
- Esta obra contiene una traducción derivada de «Mesencephalic locomotor region» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
