Monóxido de cloro
| Monóxido de cloro | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Monóxido de cloro | ||
| General | ||
| Otros nombres | Clorooxidanilo, Óxido de cloro(II) | |
| Fórmula estructural |
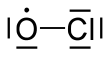 | |
| Fórmula molecular | ClO• | |
| Identificadores | ||
| Número CAS | 14989-30-1[1] | |
| ChEBI | 29314 | |
| ChemSpider | 145843 | |
| PubChem | 166686 | |
| UNII | 0EQ5I4TK19 | |
| Propiedades físicas | ||
| Masa molar | 50,963767 g/mol | |
| Termoquímica | ||
| ΔfH0gas | 101,8[2] kJ/mol | |
El monóxido de cloro es un compuesto químico radical cuya fórmula es ClO•. Desempeña un papel importante en la reducción de la capa de ozono (agujero). En la estratosfera, los átomos de cloro reaccionan con las moléculas de ozono para formar monóxido de cloro y oxígeno.
Cl• + O3 → ClO• + O2
Esta reacción reduce la capa de ozono.[3] Los radicales ClO• que se forman pueden seguir reaccionando:
ClO• + O• → Cl• + O2
Y regeneran el radical cloro. De esta forma, la reacción global para la destrucción del ozono se cataliza por medio del cloro, ya que finalmente el cloro no sufre ningún cambio. La reacción global es:
O• + O3 → 2 O2
El uso de CFC ha tenido un impacto significativo en la parte superior de la estratosfera, aunque muchos países han acordado prohibir su uso. La no reactividad de los CFC les permite pasar a la estratosfera, donde se someten a una fotodisociación para formar radicales de Cl. A continuación, estos radicales forman el monóxido de cloro, y este proceso puede continuar hasta que dos radicales reaccionan y forman el monóxido de dicloro, con lo que finaliza la reacción radical. Como la concentración de CFC en la atmósfera es muy baja, la probabilidad de que se produzca una reacción final es extremadamente baja, lo que significa que cada radical es capaz de destruir miles de moléculas de ozono.
Aunque el uso de CFC se ha prohibido en muchos países, los CFC se pueden mantener en la atmósfera durante un período de 50 a 500 años. Esto hace que se produzcan muchos radicales de cloro y, por tanto, que se desintegren una cantidad importante de moléculas de ozono antes de que los radicales de cloro puedan reaccionar con el monóxido de cloro y formar monóxido de dicloro.
Referencias[editar]
- ↑ Número CAS
- ↑ Holleman, A. F.; Wiberg, Egon; Wiberg, Nils (2001). Inorganic Chemistry (en inglés). Academic Press. ISBN 978-0-12-352651-9. Consultado el 5 de abril de 2023.
- ↑ Holleman, A. F.; Wiberg, Egon; Wiberg, Nils (2001). Inorganic Chemistry (en inglés). Academic Press. p. 462. ISBN 978-0-12-352651-9. Consultado el 5 de abril de 2023.
Enlaces externos[editar]
- Esta obra contiene una traducción total derivada de «Chlorine monoxide» de Wikipedia en inglés, concretamente de esta versión del 24 de marzo de 2023, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
