Diferencia entre revisiones de «Hielo»
| Línea 8: | Línea 8: | ||
== Disminución en la densidad al solidificarse == |
== Disminución en la densidad al solidificarse == |
||
El agua tiene un comportamiento diferente a la mayoría de [[líquido]]s: cuando pasa a estado [[sólido]] no aumenta de volumen. Esto es así porque la densidad del hielo es menor que la del agua. Como consecuencia de este fenómeno, el hielo flota en el agua. |
El agua tiene un comportamiento diferente a la mayoría de [[líquido]]s: cuando pasa a estado [[sólido]] no aumenta de volumen. Ana creo que te gane jajajaja Esto es así porque la densidad del hielo es menor que la del agua. Como consecuencia de este fenómeno, el hielo flota en el agua. |
||
Si se llena completamente de agua un recipiente y se lo cierra herméticamente para luego congelarlo, al solidificarse el agua generará una enorme presión que si no es soportada por el recipiente, éste se deformaría o estallaría. |
Si se llena completamente de agua un recipiente y se lo cierra herméticamente para luego congelarlo, al solidificarse el agua generará una enorme presión que si no es soportada por el recipiente, éste se deformaría o estallaría. |
||
Revisión del 01:10 11 ago 2009

El hielo es agua sólida cristalizada, congelada. Es uno de los tres estados naturales del agua.
El agua pura se congela a la altitud del nivel del mar a 0°C . El agua, junto con el galio, bismuto, ácido acético, antimonio y el silicio, es una de las pocas sustancias que al congelarse aumentan de volumen (es decir, que disminuye su densidad); la mayoría de las otras sustancias se contraen al congelarse. Esta propiedad evita que los océanos de las regiones polares de la Tierra se congelen en todo su volumen, puesto que el hielo flota en el agua y es lo que queda expuesto a los cambios de temperatura de la atmósfera. La densidad típica del hielo a 0 °C suele tomarse como 916,8 kg/m3 o como 0,9168 g/cm3.
Disminución en la densidad al solidificarse
El agua tiene un comportamiento diferente a la mayoría de líquidos: cuando pasa a estado sólido no aumenta de volumen. Ana creo que te gane jajajaja Esto es así porque la densidad del hielo es menor que la del agua. Como consecuencia de este fenómeno, el hielo flota en el agua.
Si se llena completamente de agua un recipiente y se lo cierra herméticamente para luego congelarlo, al solidificarse el agua generará una enorme presión que si no es soportada por el recipiente, éste se deformaría o estallaría.
Cuando el agua líquida baja de temperatura y llega a 0 °C, su densidad es de 999,9 kg/m3 (permaneciendo en estado líquido). Si se retira del líquido un poco más de calor, pasa al estado sólido y sufre una intempestiva disminución de densidad (y un consiguiente aumento de volumen), pasando a tener una densidad de 916,8 kg/m3 (a la misma temperatura, vale decir 0 °C)
Una consecuencia de todo ello es que el agua se congela de arriba hacia abajo. En lugares donde la temperatura es menor de 0 °C el agua del mar y de los lagos se enfría. Cuando empieza a congelarse, el agua en lugar de precipitarse al fondo queda en la superficie y flota. Todo esto permite que el agua y los seres vivos del fondo queden resguardados de las temperaturas exteriores muy bajas.
Estructura cristalina

A presión atmosférica, las moléculas de agua se estructuran de manera tetraédrica, en virtud del enlace de hidrógeno. Por esto, las moléculas de agua se amontonan de manera compacta; por lo tanto, la densidad del hielo es menor que la del agua (916,8 kg/m3). El cristal de hielo tiene una estructura hexagonal espaciada; dependiendo de la presión atmosférica el hielo se compacta de diferentes formas, dando lugar a los diferentes tipos de hielo que hoy conocemos.
Tipos de hielo
En el hielo, como en la mayoría de los sólidos, las moléculas se acomodan en una formación ordenada. Sin embargo, dependiendo de las condiciones de presión y temperatura, es posible que adopten diferentes formas de ordenarse. A partir de 1900, Gustavo Tamman y posteriormente en 1912 Percy Bridgman hicieron experimentos sobre el hielo aplicándole diferentes presiones y temperaturas, y obtuvieron hielos diferentes con mayores densidades a la normal (posteriormente se encontraron muchos más tipos de hielo). Todas estas formas de hielo tienen estructuras más compactas (diferentes formas de un elemento existentes en el mismo estado físico), o sea que se forman varias modificaciones alotrópicas o alótropos.
En forma natural, en la Tierra (dadas sus condiciones de presión y temperatura), solamente puede existir un tipo de hielo (hielo I). Sin embargo, en otros planetas o en satélites, en los que las condiciones de presión y de temperatura son diferentes, el hielo puede presentarse en otras clases.
Los tipos de hielo conocidos son los siguientes:
- Hielo lc (baja temperatura, cúbica centrada en las caras, densidad aproximadamente 900 kg/m3).
- Hielo II (baja temperatura, ortorrómbica centrado, densidad aproximadamente 1.200 kg/m3).
- Hielo III ó Iii (baja temperatura, tetragonal, densidad aproximadamente 1.100 kg/m3).
- Hielo V (alta presión, baja temperatura, monoclínica de base centrada, densidad aproximadamente 1.200 kg/m3).
- Hielo VI (alta presión, baja temperatura, tetragonal, densidad aproximadamente 1.300 kg/m3).
- Hielo VII (alta temperatura, alta presión, cúbico sencilla, densidad aproximadamente 1.700 kg/m3).
- Hielo VIII (alta presión, tetragonal centrada, densidad aproximadamente 1.600 kg/m3).
- Hielo IX (alta presión, tetragonal, densidad aproximadamente 1.200 kg/m3).
- Hielo XII (alta presión, baja temperatura, tetragonal, densidad aproximadamente 1.300 kg/m3).
Fusión eutéctica
En las condiciones terrestres y durante el invierno es frecuente agregar sal al hielo para que se funda. De hecho, lo que se funde no es el hielo, sino un compuesto de hielo y sal llamado "eutéctico". Cuando la sal NaCl (Na+, Cl–) entra en contacto con el hielo, los iones se arreglan alrededor de las moléculas de agua, que son polares (H2δ+, Oδ–) y viene a formar un compuesto (H2O).(NaCl) . Para este rearreglo hacen falta solamente unos pequeños movimientos de átomos, y se hace por lo tanto en fase sólida. Cuando se respetan las proporciones exactas (alrededor del 23 % de sal en masa), se tiene un producto que se comporta como producto puro (particularmente, hay una temperatura de fusión constante) y que se califica de "eutéctica". La temperatura de fusión de esta eutéctica es de alrededor de –21 °C. Si la proporción de sal es inferior a esta relación, se da una mezcla agua-eutéctica, que se funde a una temperatura superior (entre –21 °C y 0 °C). Si la proporción de sal es superior, se tiene una mezcla sal-eutéctica que también se funde a una temperatura superior. Se puede trazar un diagrama, llamado diagrama de fase, que representa la temperatura de fusión en función de las proporciones agua-sal.
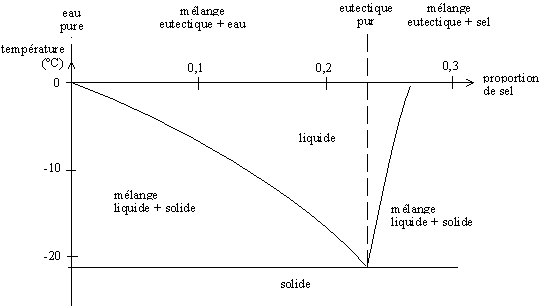
Diagrama de fase agua-sal a presión atmosférica ; la eutéctica se forma en una proporción de agua de 0,2331 en masa (23,31 % de sal y 76,69 % de agua en masa)
El rearreglo agua + sal → eutéctica no puede darse sino en los puntos de contacto entre los cristales de hielo y de sal, o sea en la superficie del hielo. Se forma así una capa superficial de eutéctica que se funde (si la temperatura es superior a –21 °C). Como la sal está en sobresaturación, se disuelve en la eutéctica fundida y puede reaccionar con el hielo que se encuentra sobre la película líquida. El fenómeno se propaga entonces hasta que falta agua o sal para formar una nueva eutéctica.
Así, en teoría, sería posible impedir la formación de hielo hasta los –21 °C. En la práctica, es imposible dosificar la cantidad de sal que debe usarse.
Descenso crioscópico
El descenso crioscópico es la reducción del punto de fusión de un disolvente puro por la presencia de solutos. Es directamente proporcional a la molalidad, lo que hace que sea más importante para solutos iónicos, como los que predominan en el agua de mar, que para los no iónicos. El fenómeno tiene importantes consecuencias en el caso del agua de mar, porque la respuesta al enfriamiento intenso del agua del océano, como ocurre en el invierno de las regiones polares, es la separación de una fase sólida flotante de agua pura en forma de hielo. Es así como se forma la banquisa en torno a la Antártida o al océano Ártico, como un agregado compacto de hielo puro de agua, con salmuera llenando los intersticios, y flotando sobre una masa de agua líquida a menos de 0 °C (hasta un límite de –1,9 °C para una salinidad del 3,5%).
El color del hielo
En ciertas ocasiones el hielo se ve de color azul. ¿Por qué el hielo es azul en contraste con el color blanco de la nieve?

La luz blanca del Sol está realmente formada por una mezcla de colores, desde el rojo al violeta, como se comprueba cuando se hace pasar un rayo de luz a través de un prisma de vidrio, o en el arcoiris. Las ondas de luz más azuladas tienen más energía que las amarillas o las rojas. La nieve es blanca porque toda la luz que le llega es reflejada en una capa muy delgada que se encuentra en su superficie. Las pequeñas burbujas de aire que están atrapadas en el hielo refleja la luz, múltiples veces y todos los colores, desde el rojo al violeta, escapan, de modo que la luz que recibimos es luz blanca. El hielo aparece azul cuando tiene una consistencia muy alta y las burbujas de aire no impiden el paso de la luz a través de él. Sin el efecto "dispersivo" de las burbujas, la luz puede penetrar en el hielo siendo absorbida paulatinamente en su camino hacia las partes más profundas. Los fotones rojos, que tienen menor energía que los azules, penetran menos distancia y son absorbidos antes. En promedio, la absorción de luz roja en el hielo es seis veces más eficiente que la absorción de luz azul; por tanto, cuanta más distancia viaje un haz de luz blanca, en su camino va perdiendo más y más fotones rojos, amarillos, verdes... y son los azules los que "sobreviven". Esta es la razón del color azul del hielo puro, y de un glaciar o de un iceberg.
Otras acepciones
Por extensión se usa el nombre hielo para otro tipo de compuestos químicos. Así, por ejemplo, se habla de hielo seco para referirse al estado sólido del anhídrido carbónico (dióxido de carbono o CO2).
Acción erosiva
La expansión del agua al solidificarse tiene efectos geológicos importantes. El agua que se introduce en las grietas diminutas de las rocas de la superficie terrestre crea una enorme cantidad de presión al solidificarse, y parte o rompe las rocas. Esta acción del hielo desempeña un papel importante en la erosión. Además los glaciares mediante fricción pulen el terreno por donde circulan.
Véase también
- Glaciología
- Aguanieve
- Banquisa
- Circo glaciar
- Cometa
- Difluencia glaciar
- Dióxido de carbono
- Hidrato de gas
- Escarcha
- Glaciar
- Glaciar de valle
- Granizo
- Hielo azul
- Iceberg
- Nieve
- Permafrost
- Rimaya
- Serac
- Valle glaciar
- Escultura de hielo
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre Hielo.
Wikimedia Commons alberga una categoría multimedia sobre Hielo.
