Hemozoína
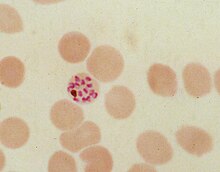
La hemozoína es un producto de desecho formado a partir de la digestión de la sangre por parte de algunos parásitos hematófagos. Estos organismos hematófagos como el parásito de la malaria (Plasmodium spp.), Rhodnius y Schistosoma digieren la hemoglobina y liberan altas cantidades de hemo libre, que es el componente no proteico de la hemoglobina. El hemo libre es tóxico, por lo que los parásitos lo convierten en una forma cristalina insoluble llamada hemozoína
La formación de hemozoína es esencial para la supervivencia de estos parásitos, por lo que es objetivo atractivo para el desarrollo de fármacos. Se cree que varios medicamentos antimaláricos utilizados actualmente, como la cloroquina y la mefloquina, matan a los parásitos de la malaria al inhibir la biocristalización de la hemozoína.
Descubrimiento[editar]
Un pigmento marrón oscuro fue observado por Johann Friedrich Meckel en 1847 en la sangre y el bazo de un afectado de locura.[1][2] Recién en 1849 la presencia de este pigmento se relacionó con la infección por malaria.[3] Inicialmente, se pensaba que este pigmento era producido por el cuerpo en respuesta a la infección, pero Charles Louis Alphonse Laveran se percató en 1880 de que los "parásitos" producen el "pigmento de la malaria" cuando se multiplican dentro de la un eritrocito.[4] Ronald Ross utilizó el vínculo entre el pigmento y los parásitos de la malaria para identificar las etapas en el Plasmodium que se produce dentro del mosquito, ya que, aunque estas formas del parásito se ven diferentes todavía contienen rastros de pigmento.
Más tarde, en 1891, T. Carbone y WH Brown (1911) publicaron artículos que relacionan la degradación de la hemoglobina con la producción de pigmento, describiendo el pigmento de la malaria como una forma de hematina y refutando la idea generalizada de que estaba relacionada con la melanina. Para hacer tal afirmación, Brown contrastó la acción del permanganato de potasio en las melaninas y en el pigmento de malaria. Las melaninas se blanqueaban pero no el pigmento de malaria.[5][6]
El nombre "hemozoína" fue propuesto por Louis Westenra Sambon.[7] En la década de 1930, varios autores identificaron la hemozoína como una forma cristalina pura de α-hematina y demostraron que la sustancia no contenía proteínas dentro de los cristales.[4] Cabe recalcar que la solubilidad de los cristales de hemozoína y α-hematina es diferente.
Formación[editar]
Durante fase esquizogónica eritrocitaria (Ocurre dentro del humano, se caracteriza por ser una reproducción asexual, ocurre después de la fase intrahepática), el Plasmodium falciparum consume hasta el 80% de la hemoglobina de la célula huésped.[8][9] La digestión de la hemoglobina libera α-hematina monomérica (ferriprotoporfirina IX). Este compuesto es tóxico, ya que es un pro-oxidante y cataliza la producción de especies reactivas de oxígeno. Se cree que el estrés oxidativo se genera durante la conversión de hemo (ferroprotoporfirina) en hematina (ferriprotoporfirina IX). La hematina libre también puede unirse y romper las membranas celulares, dañando las estructuras celulares y causando la lisis del eritrocito.[10][11]

El parásito de la malaria desintoxica la hematina por medio de la biocristalización, convirtiéndola en cristales de β-hematina insolubles y químicamente inertes (la llamada hemozoína).[13][14][15] En Plasmodium, la vacuola alimenticia se llena con cristales de hemozoína, que tienen aproximadamente 100-200 nanómetros de largo y cada uno contiene aproximadamente 80 000 moléculas de hemo.[4] Cabe recalcar que la desintoxicación a través de la biocristalización es distinta del proceso de desintoxicación en los mamíferos, donde la enzima hemo oxigenasa cataliza la conversión del grupo hemo en biliverdina, Fe2+ y monóxido de carbono.[16]
Se han propuesto varios mecanismos para la producción de hemozoína en el Plasmodium. Se han propuesto como catalizadores para la formación de hemozoínas los lípidos de membrana,[17][18] proteínas ricas en histidina,[19] o incluso una combinación de las dos.[20]
Otros autores han descrito una proteína a la que llamaron Proteína de Desintoxicación de Hemo (Heme Detoxification Protein, HDP) y afirman que su acción es más potente que las de los lípidos o las proteínas ricas en histidina.[12] Múltiples mecanismos contribuyen a la formación de hemozoína.[21]
La investigación sobre la formación de hemozoína es principalmente estudiada en Plasmodium.[22] Otros parásito que produce hemozoína es el Schistosoma mansoni que produce grandes cantidades de hemozoína durante su crecimiento que ocurre mientras esta en el torrente sanguíneo humano. Aunque las formas de los cristales son diferentes de las que producen los parásitos de la malaria,[23] análisis químico del pigmento mostró que estaban compuestos de hemozoína.[24][25]
De manera similar, los cristales formados en el intestino del, insecto vector de la enfermedad de Chagas, Rhodnius prolixus durante la digestión de la sangre genera un cristal de hemozoína con una forma diferente a la del Plasmodium.[26] La formación de hemozoína en el intestino medio del R. prolixus ocurre en condiciones fisicoquímicas fisiológicamente relevantes a la vez que los lípidos llevan a cabo la biocristalización de los grupos hemo. Se ha demostrado que la cristalización autocatalítica de grupos hemo es un proceso ineficiente y que esta conversión disminuye a medida que la concentración de hemozoína aumenta.[27]
Se han desarrollado varios otros mecanismos para proteger una gran variedad de organismos hematófagos contra los efectos tóxicos del hemo libre. Los mosquitos digieren la sangre extracelularmente y no producen hemozoína. El hemo se retiene en la matriz peritrófica, una capa de proteínas y polisacáridos que cubre el intestino medio de los insectos (mesenterón) separando las células intestinales del bolo sanguíneo.[28]

Aunque la β-hematina se puede producir espontáneamente en ensayos enzimáticos a pH bajo, el desarrollo de un método simple y confiable para medir la producción de hemozoína ha sido difícil. Esto se debe a la dificultad para medir la diferencia entre el hemo agregado o precipitado y la hemozoína.[29]
Estructura[editar]


Los cristales de β-hematina están formados por dímeros de moléculas de hematina que, a su vez, están unidos por enlaces de hidrógeno que forman estructuras más grandes. En estos dímeros, un enlace coordinado de hierro - oxígeno une el hierro central de la una hematina con el oxígeno de la cadena lateral de carboxilato de la hematina adyacente. Estos enlaces recíprocos de hierro-oxígeno son inusuales y no se han observado en ningún otro dímero de porfirina. La β-hematina puede ser un dímero cíclico o un polímero lineal,[30] nunca se ha encontrado una forma polimérica en la hemozoína, lo que descarta que la enzima hemo-polimerasa produce hemozoína.[31]
Los cristales de hemozoina tienen una estructura triclínica distinta y son débilmente magnéticos. La diferencia entre la oxihemoglobina diamagnética de bajo spin y la hemozoína paramagnética nos puede ayudar a aislarlo.[32][33]
También presentan dicroísmo óptico (Absorbe la luz con mayor fuerza a lo largo de su longitud que a lo ancho), lo que permite la detección de malaria usando un celular automático.[34] La hemozoina se produce en una forma que, bajo la acción de un campo magnético aplicado, da lugar a un dicroísmo óptico inducido característico de la concentración de hemozoina; y la medición precisa de este dicroísmo inducido puede usarse para determinar el nivel de infección por malaria.[35]
Inhibidores[editar]
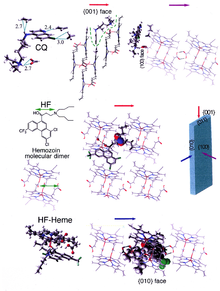
La formación de hemozoína es un excelente objetivo farmacológico, ya que es esencial para la supervivencia del parásito de la malaria, ya que el hospedero no la produce. Se cree que muchos fármacos utilizados clínicamente actúan inhibiendo la formación de hemozoína en la vacuola alimentaria.[36] Esto evita la neutralización del hemo liberado en este compartimento y mata al parásito.[37]
Los ejemplos mejor entendidos de tales inhibidores de la biocristalización de hematina son los medicamentos de quinoleína como la cloroquina y la mefloquina. Estas drogas se unen a los cristales de hemozoina y hemo libre[38] y, por lo tanto, bloquean la adición de nuevas unidades de hemo en los cristales en crecimiento. La cara pequeña y de crecimiento más rápido es la cara a la que se cree que se unen los inhibidores.[39][40]
Papel en fisiopatología[editar]
Durante la infección, la hemozoína se libera en la circulación y se fagocita in vivo e in vitro por los fagocitos del huésped y altera funciones en esas células. La mayoría de las alteraciones funcionales fueron efectos posfagocíticos a largo plazo,[41][42] incluyendo la inhibición de la eritropoyesis in vitro.[43][44][45] Por el contrario, durante la fagocitosis de hemozoína se observó una potente estimulación a corto plazo de la estallido oxidativo por parte de los monocitos humanos.[46]
Véase también[editar]
Referencias[editar]
- ↑ Meckel H (1847). «Ueber schwarzes Pigment in der Milz und dem Blute einer Geisteskranken». Zeitschrift für Psychiatrie IV: 198-226.
- ↑ «The legacy of Johann Friedrich Meckel the Elder (1724-1774): a 4-generation dynasty of anatomists». Neurosurgery 66 (4): 758-770. 2010. PMID 20305497. doi:10.1227/01.NEU.0000367997.45720.A6.
- ↑ Virchow R (1849). «Zur pathologischen Physiologie des Bluts». Arch pathol Anatomie Physiol Klin Med 2 (3): 587-598. doi:10.1007/BF02114475.
- ↑ a b c Sullivan DJ (December 2002). «Theories on malarial pigment formation and quinoline action». Int J Parasitol 32 (13): 1645-53. PMID 12435449. doi:10.1016/S0020-7519(02)00193-5.
- ↑ Carbone T (1891). «Sulla natura chimica del pigmento malarico». G R Accad Med Torino 39: 901-906.
- ↑ Brown WH (1911). «MALARIAL PIGMENT (SO-CALLED MELANIN): ITS NATURE AND MODE OF PRODUCTION». J Exp Med 13 (2): 290-299. PMC 2124860. PMID 19867409. doi:10.1084/jem.13.2.290.
- ↑ «Studies of malarial pigment (haemozoin). Part I. Investigation of the action of solvents on haemozoin and the spectroscopical appearances observed in the solutions». Records of the malaria survey of India 4: 15-42. 1934.
- ↑ «Hemoglobin catabolism and iron utilization by malaria parasites». Mol Biochem Parasitol 83 (2): 131-139. December 1996. PMID 9027746. doi:10.1016/S0166-6851(96)02763-6.
- ↑ Schnur, Joel M., ed. (2008). «FRET Imaging of Hemoglobin Concentration in Plasmodium falciparum-Infected Red Cells». PLoS ONE 3 (11): e3780. PMC 2582953. PMID 19023444. doi:10.1371/journal.pone.0003780.
- ↑ «Intracellular ferriprotoporphyrin IX is a lytic agent». Blood 62 (6): 1165-1168. 1983. PMID 6640106.
- ↑ «Pathobiology of heme interaction with the erythrocyte membrane». Semin Hematol 26 (2): 136-149. April 1989. PMID 2658089.
- ↑ a b Kim, Kami, ed. (April 2008). «HDP—A Novel Heme Detoxification Protein from the Malaria Parasite». PLoS Pathog 4 (4): e1000053. PMC 2291572. PMID 18437218. doi:10.1371/journal.ppat.1000053.
- ↑ «The state of ferriprotoporphyrin IX in malaria pigment». J Biol Chem 262 (32): 15552-1555. November 1987. PMID 3119578.
- ↑ «The structure of malaria pigment beta-haematin». Nature 404 (6775): 307-310. March 2000. PMID 10749217. doi:10.1038/35005132.
- ↑ Hempelmann E (2007). «Hemozoin biocrystallization in Plasmodium falciparum and the antimalarial activity of crystallization inhibitors». Parasitol Research 100 (4): 671-676. PMID 17111179. doi:10.1007/s00436-006-0313-x. Archivado desde el original el 10 de junio de 2011.
- ↑ «Heme oxygenase and heme degradation». Biochem Biophys Res Commun 338 (1): 558-567. December 2005. PMID 16115609. doi:10.1016/j.bbrc.2005.08.020.
- ↑ «Hemozoin: Oil Versus Water». Parasitol Int 57 (2): 89-96. June 2008. PMC 2442017. PMID 18373972. doi:10.1016/j.parint.2007.09.009.
- ↑ «Phospholipid Membrane-Mediated Hemozoin Formation: The Effects of Physical Properties and Evidence of Membrane Surrounding Hemozoin». PLoS ONE 8 (7): e70025. 2013. PMC 3720957. PMID 23894579. doi:10.1371/journal.pone.0070025.
- ↑ «Plasmodium hemozoin formation mediated by histidine-rich proteins». Science 271 (5246): 219-222. January 1996. PMID 8539625. doi:10.1126/science.271.5246.219.
- ↑ «Hemozoin formation in malaria: a two-step process involving histidine-rich proteins and lipids». Biochem Biophys Res Commun 308 (4): 736-743. September 2003. PMID 12927780. doi:10.1016/S0006-291X(03)01465-7.
- ↑ «Protein complex directs hemoglobin-to-hemozoin formation in Plasmodium falciparum». Proc Natl Acad Sci U S A 110 (14): 5392-7. April 2013. PMC 3619337. PMID 23471987. doi:10.1073/pnas.1218412110.
- ↑ Egan TJ (February 2008). «Haemozoin formation». Mol Biochem Parasitol 157 (2): 127-136. PMID 18083247. doi:10.1016/j.molbiopara.2007.11.005.
- ↑ «A comparison of pigment from Schistosoma mansoni and Plasmodium berghei». Ann Trop Med Parasitol 69 (3): 373-374. September 1975. PMID 1098591.
- ↑ «Haemozoin in Schistosoma mansoni». Mol Biochem Parasitol 111 (1): 217-221. November 2000. PMID 11087932. doi:10.1016/S0166-6851(00)00299-1.
- ↑ Jones, Malcolm K., ed. (2009). «Interference with Hemozoin Formation Represents an Important Mechanism of Schistosomicidal Action of Antimalarial Quinoline Methanols». PLoS Negl Trop Dis 3 (7): e477. PMC 2703804. PMID 19597543. doi:10.1371/journal.pntd.0000477.
- ↑ «Structural and morphological characterization of hemozoin produced by Schistosoma mansoni and Rhodnius prolixus». FEBS Lett 579 (27): 6010-6016. 2005. PMID 16229843. doi:10.1016/j.febslet.2005.09.035.
- ↑ «On the physico-chemical and physiological requirements of hemozoin formation promoted by perimicrovillar membranes in Rhodnius prolixus midgut». Insect Biochem Mol Biol 40 (3): 284-292. 2010. PMID 20060043. doi:10.1016/j.ibmb.2009.12.013.
- ↑ «Aedes aegypti peritrophic matrix and its interaction with heme during blood digestion». Insect Biochem Mol Biol 32 (5): 517-523. May 2002. PMID 11891128. doi:10.1016/S0965-1748(01)00130-8.
- ↑ «A comparison and analysis of several ways to promote haematin (haem) polymerisation and an assessment of its initiation in vitro». Biochem Pharmacol 55 (6): 737-747. March 1998. PMID 9586945. doi:10.1016/S0006-2952(97)00509-1.
- ↑ «Hematin compounds and bile pigments». Interscience, New York. 1949.
- ↑ «Analysis of malaria pigment from Plasmodium falciparum». J Pharmacol Toxicol Methods 32 (1): 25-30. September 1994. PMID 7833503. doi:10.1016/1056-8719(94)90013-2.
- ↑ «Separation of malaria-infected erythrocytes from whole blood: use of a selective high-gradient magnetic separation technique». Lancet 2 (8237): 70-71. 1981. PMID 6113443. doi:10.1016/S0140-6736(81)90414-1.
- ↑ «Improved methods for magnetic purification of malaria parasites and haemozoin». Malar J 9 (1): 17. 2010. PMC 2817699. PMID 20074366. doi:10.1186/1475-2875-9-17.
- ↑ «Automated malaria detection by depolarization of laser light». Br J Haematol 104 (3): 499-503. 1999. PMID 10086786. doi:10.1046/j.1365-2141.1999.01199.x.Uso incorrecto de la plantilla enlace roto (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ «A Magneto-Optic Route toward the In Vivo Diagnosis of Malaria: Preliminary Results and Preclinical Trial Data». Biophys J 95 (2): 994-1000. 2008. PMC 2440472. PMID 18390603. doi:10.1529/biophysj.107.128140. Archivado desde el original el 27 de julio de 2011. Consultado el 19 de diciembre de 2009.
- ↑ «Heme Aggregation inhibitors: antimalarial drugs targeting an essential biomineralization process». Curr Med Chem 8 (2): 171-89. February 2001. PMID 11172673. doi:10.2174/0929867013373840.
- ↑ «Malarial hemozoin: From target to tool». Biochim Biophys Acta 1840 (6): 2032-2041. 2014. PMC 4049529. PMID 24556123. doi:10.1016/j.bbagen.2014.02.009.
- ↑ «On the molecular mechanism of chloroquine's antimalarial action». Proc Natl Acad Sci USA 93 (21): 11865-70. October 1996. PMC 38150. PMID 8876229. doi:10.1073/pnas.93.21.11865.
- ↑ «The crystal structure of halofantrine-ferriprotoporphyrin IX and the mechanism of action of arylmethanol antimalarials». J Inorg Biochem 102 (8): 1660-1667. August 2008. PMID 18508124. doi:10.1016/j.jinorgbio.2008.04.001.
- ↑ «Interplay between malaria, crystalline hemozoin formation, and antimalarial drug action and design». Chem Rev 108 (11): 4899-4914. 2008. PMID 19006402. doi:10.1021/cr078274t.
- ↑ «Malarial pigment (haemozoin): a very active 'inert' substance». Ann Trop Med Parasitol 91 (5): 501-516. 1997. PMID 9329987. doi:10.1080/00034989760879.
- ↑ «Hemozoin (malarial pigment) inhibits differentiation and maturation of human monocyte-derived dendritic cells: a peroxisome proliferator-activated receptor-gamma-mediated effect». J Immunol 173 (6): 4066-74. 2004. PMID 15356156. doi:10.4049/jimmunol.173.6.4066.
- ↑ «Hemozoin- and 4-hydroxynonenal-mediated inhibition of erythropoiesis. Possible role in malarial dyserythropoiesis and anemia». Haematologica 89 (4): 492-493. 2004. PMID 15075084.
- ↑ «Suppression of erythropoiesis in malarial anemia is associated with hemozoin in vitro and in vivo». Blood 108 (8): 2569-77. 2006. PMID 16804108. doi:10.1182/blood-2006-05-018697.
- ↑ «Inhibition of erythropoiesis in malaria anemia: role of hemozoin and hemozoin-generated 4-hydroxynonenal.». Blood 116 (20): 4328-37. 2010. PMID 20686121. doi:10.1182/blood-2010-03-272781. Archivado desde el original el 19 de junio de 2013. Consultado el 15 de mayo de 2020.
- ↑ «Host fibrinogen stably bound to hemozoin rapidly activates monocytes via TLR-4 and CD11b/CD18-integrin: a new paradigm of hemozoin action». Blood 117 (21): 5674-82. 2011. PMID 21460246. doi:10.1182/blood-2010-10-312413. Archivado desde el original el 9 de julio de 2013.
