Diferencia entre revisiones de «Éster»
Sin resumen de edición |
m Revertidos los cambios de 189.242.180.162 a la última edición de 187.131.212.231 |
||
| Línea 3: | Línea 3: | ||
En la [[química]], los '''ésteres''' son compuestos orgánicos en los cuales un grupo orgánico (simbolizado por R' en este artículo) reemplaza a un átomo de [[hidrógeno]] (o más de uno) en un [[ácido oxigenado]]. Un [[oxoácido]] es un ácido inorgánico cuyas moléculas poseen un grupo [[hidroxilo]] (–OH) desde el cual el [[hidrógeno]] (H) puede disociarse como un ión hidrógeno, [[hidrón]] o comúnmente [[protón]], (H<sup>+</sup>). Etimológicamente, la palabra "éster" proviene del [[idioma alemán|alemán]] '''Es'''sig-Ä'''ther''' (''éter de vinagre''), como se llamaba antiguamente al [[acetato de etilo]]. |
En la [[química]], los '''ésteres''' son compuestos orgánicos en los cuales un grupo orgánico (simbolizado por R' en este artículo) reemplaza a un átomo de [[hidrógeno]] (o más de uno) en un [[ácido oxigenado]]. Un [[oxoácido]] es un ácido inorgánico cuyas moléculas poseen un grupo [[hidroxilo]] (–OH) desde el cual el [[hidrógeno]] (H) puede disociarse como un ión hidrógeno, [[hidrón]] o comúnmente [[protón]], (H<sup>+</sup>). Etimológicamente, la palabra "éster" proviene del [[idioma alemán|alemán]] '''Es'''sig-Ä'''ther''' (''éter de vinagre''), como se llamaba antiguamente al [[acetato de etilo]]. |
||
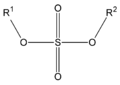
En los ésteres más comunes el ácido en cuestión es un [[ácido carboxílico]]. Por ejemplo, si el ácido es el [[ácido acético]], el éster es denominado como [[acetato]]. Los ésteres también se pueden formar con ácidos inorgánicos, como el ácido carbónico (origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el [[ácido sulfúrico]]. Por ejemplo, el sulfato de dimetilo es |
En los ésteres más comunes el ácido en cuestión es un [[ácido carboxílico]]. Por ejemplo, si el ácido es el [[ácido acético]], el éster es denominado como [[acetato]]. Los ésteres también se pueden formar con ácidos inorgánicos, como el ácido carbónico (origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el [[ácido sulfúrico]]. Por ejemplo, el sulfato de dimetilo es un éster, a veces llamado "éster dimetílico del [[ácido sulfúrico]]". |
||
{| class="wikitable" border="1" |
|||
|- |
|||
! [[Éster]]<br /> |
|||
(éster de ácido carboxílico) |
|||
! [[Éster carbónico]]<br /> |
|||
(éster de ácido carbónico) |
|||
! [[Éster fosfórico]]<br /> |
|||
(triéster de ácido fosfórico) |
|||
! [[Éster sulfúrico]]<br /> |
|||
(diéster de ácido sulfúrico) |
|||
|- |
|||
| [[Archivo:Ester.svg|120px]] |
|||
| [[Archivo:Organocarbonate-2D-general.png|120px]] |
|||
| [[Archivo:Phosphate ester.PNG|120px]] |
|||
| [[Archivo:Organosulfate.png|120px]] |
|||
|} |
|||
Un ensayo recomendable para detectar ésteres es la formación de hidroxamatos férricos, fáciles de reconocer ya que son muy coloreados: |
Un ensayo recomendable para detectar ésteres es la formación de hidroxamatos férricos, fáciles de reconocer ya que son muy coloreados: |
||
Revisión del 01:00 30 abr 2010

En la química, los ésteres son compuestos orgánicos en los cuales un grupo orgánico (simbolizado por R' en este artículo) reemplaza a un átomo de hidrógeno (o más de uno) en un ácido oxigenado. Un oxoácido es un ácido inorgánico cuyas moléculas poseen un grupo hidroxilo (–OH) desde el cual el hidrógeno (H) puede disociarse como un ión hidrógeno, hidrón o comúnmente protón, (H+). Etimológicamente, la palabra "éster" proviene del alemán Essig-Äther (éter de vinagre), como se llamaba antiguamente al acetato de etilo.
En los ésteres más comunes el ácido en cuestión es un ácido carboxílico. Por ejemplo, si el ácido es el ácido acético, el éster es denominado como acetato. Los ésteres también se pueden formar con ácidos inorgánicos, como el ácido carbónico (origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el ácido sulfúrico. Por ejemplo, el sulfato de dimetilo es un éster, a veces llamado "éster dimetílico del ácido sulfúrico".
| Éster (éster de ácido carboxílico) |
Éster carbónico (éster de ácido carbónico) |
Éster fosfórico (triéster de ácido fosfórico) |
Éster sulfúrico (diéster de ácido sulfúrico) |
|---|---|---|---|

|

|

|
|
Un ensayo recomendable para detectar ésteres es la formación de hidroxamatos férricos, fáciles de reconocer ya que son muy coloreados:
Ensayo del ácido hidroxámico: la primera etapa de la reacción es la conversión del éster en un ácido hidroxámico (catalizado por base). En el siguiente paso éste reacciona con cloruro férrico produciendo un hidroxamato de intenso color rojo-violeta.
En bioquímica son el producto de la reacción entre los ácidos grasos y los alcoholes.
En la formación de ésteres, cada radical OH (grupo hidroxilo) del radical del alcohol se sustituye por la cadena -COO del ácido graso. El H sobrante del grupo carboxilo, se combina con el OH sustituido, formando agua.
En química orgánica y bioquímica los ésteres son un grupo funcional compuesto de un radical orgánico unido al residuo de cualquier ácido oxigenado, orgánico o inorgánico.
Los ésteres más comúnmente encontrados en la naturaleza son las grasas, que son ésteres de glicerina y ácidos grasos (ácido oleico, ácido esteárico, etc.)
Principalmente resultante de la condensación de un ácido carboxílico y un alcohol. El proceso se denomina esterificación:
Un éster cíclico es una lactona.
Nomenclatura
La nomenclatura de los ésteres deriva del ácido carboxílico y el alcohol de los que procede. Así, en el etanoato (acetato) de metilo encontramos dos partes en su nombre:
- La primera parte del nombre, etanoato (acetato), proviene del ácido etanoico (acético)
- La otra mitad, de metilo, proviene del alcohol metílico (metanol).
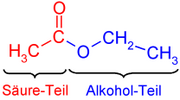
En el dibujo de la derecha se observa la parte que procede del ácido (en rojo; etanoato) y la parte que procede del alcohol (en azul, de etilo).
Luego el nombre general de un éster de ácido carboxílico será "alcanoato de alquilo" donde:
- alcan-= raíz de la cadena carbonada principal (si es un alcano), que se nombra a partir del número de átomos de carbono. Ej.:Propan- significa cadena de 3 átomos de carbono unidos por enlaces sencillos.
- oato = sufijo que indica que es derivado de un ácido carboxílico. Ej: propanoato: CH3-CH2-CO- significa "derivado del ácido propanoico".
- de alquilo: Indica el alcohol de procedencia. Por ejemplo: -O-CH2-CH3 es "de etilo"
En conjunto CH3-CH2-CO-O-CH2-CH3 se nombra propanoato de etilo.
Propiedades físicas
Los ésteres pueden participar en los enlaces de hidrógeno como aceptadores, pero no pueden participar como dadores en este tipo de enlaces, a diferencia de los alcoholes de los que derivan. Esta capacidad de participar en los enlaces de hidrógeno les convierte en más hidrosolubles que los hidrocarburos de los que derivan. Pero las ilimitaciones de sus enlaces de hidrógeno los hace más hidrofóbicos que los alcoholes o ácidos de los que derivan. Esta falta de capacidad de actuar como dador de enlace de hidrógeno ocasiona el que no pueda formar enlaces de hidrógeno entre moléculas de ésteres, lo que los hace más volátiles que un ácido o alcohol de similar peso molecular.
Muchos ésteres tienen un aroma característico, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales. Por ejemplo:
- butanoato de metilo: olor a Piña
- salicilato de metilo (aceite de siempreverde o menta): olor de las pomadas Germolene™ y Ralgex™ (Reino Unido)
- octanoato de heptilo: olor a frambuesa
- etanoato de pentilo: olor a plátano
- pentanoato de pentilo: olor a manzana
- butanoato de pentilo: olor a pera o a albaricoque
- etanoato de octilo: olor a naranja.
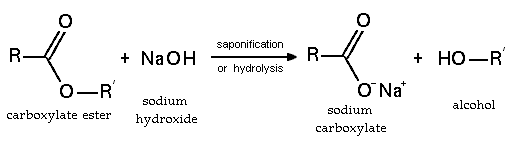
Los ésteres también participan en la hidrólisis esterárica: la ruptura de un éster por agua. Los ésteres también pueden ser descompuestos por ácidos o bases fuertes. Como resultado, se descomponen en un alcohol y un ácido carboxílico, o una sal de un ácido carboxílico:
Propiedades químicas
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados. La saponificación de los ésteres, llamada así por su analogía con la formación de jabones, es la reacción inversa a la esterificación: Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol, y se condensan entre sí en presencia de sodio y con las cetonas
