Columna gris
| Columna gris | ||
|---|---|---|
 Sección transversal de la médula espinal. Las tres columnas grises forman la región sombreada en forma de mariposa. | ||
| Nombre y clasificación | ||
| Latín | columnae griseae | |
| TA | A14.1.02.101 | |
|
| ||
La columna gris se refiere a una masa de materia gris en forma de cresta en la médula espinal.[1] Se presenta en tres columnas: la columna gris anterior, la columna gris posterior y la columna gris lateral, todas ellas visibles en cortes transversales de la médula espinal.
La columna gris anterior está formada por motoneuronas alfa, motoneuronas gamma y pequeñas neuronas que se cree que son interneuronas.[2] La columna gris posterior está dividida en varias láminas de Rexed.[3] La columna gris lateral sólo está presente en la región torácica y en los segmentos lumbares superiores (T1-L2). La columna gris lateral contiene cuerpos celulares preganglionares del sistema nervioso autónomo y neuronas sensoriales de relevo.
Estructura[editar]
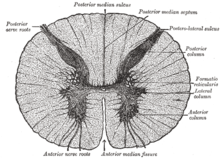

Columna gris anterior[editar]
La columna gris anterior, también conocida como asta anterior de la médula espinal, comprende tres tipos diferentes de neuronas: motoneuronas alfa grandes, motoneuronas gamma medianas y neuronas pequeñas que se cree que son interneuronas.[2] Estas neuronas difieren tanto en su morfología como en sus patrones de conectividad.[4] Están organizadas de la misma manera que los músculos que inervan.[5]
Neuronas motoras alfa[editar]
Las neuronas motoras alfa inervan fibras musculares extrafusales que generan fuerza en las uniones neuromusculares al comienzo de la contracción muscular. Tienen cuerpos celulares grandes y reciben información propioceptiva.[4] Se ha demostrado que reducen su población, pero no su tamaño con la edad.[2] El daño a estos cuerpos celulares puede provocar debilidad muscular severa y pérdida de reflejos.[6]
Neuronas motoras gamma[editar]
Las neuronas motoras gamma inervan las fibras musculares intrafusales que controlan la sensibilidad de los husos musculares para estirarse. Tienen cuerpos celulares más pequeños que las neuronas motoras alfa y no reciben información propioceptiva.[4] Se ha demostrado que se reducen en número pero no en tamaño con la edad.[2]
Pequeñas neuronas[editar]
La fisiología de las pequeñas neuronas de la columna anterior no se conoce bien. Sus efectos pueden ser tanto excitatorios como inhibitorios. Se sospecha que son interneuronas y se ha demostrado que reducen su tamaño pero no su número con la edad.[2]
Columna gris posterior[editar]
La columna gris posterior, también conocida como el asta posterior (o dorsal) de la médula espinal, se divide en varias láminas, según el tipo de información sensorial enviada a cada sección.[3] Las láminas I y II reciben información de las neuronas aferentes que detectan la nocicepción, la temperatura y el picor, las láminas III y IV reciben información de las neuronas que detectan la presión mecánica, y las láminas V y VI reciben información de los propioceptores.[7] Se sabe que es el principal punto de retransmisión de mensajes hápticos y nociceptivos.[8] El asta posterior también se conoce como una estructura parcialmente estratificada porque solo las láminas I y II están bien definidas.
La columna también puede separarse por sentidos nociceptivos y no nociceptivos. Las láminas I y II son importantes en la nocicepción, las láminas III y IV no están implicadas en la nocicepción, y la lámina V está implicada tanto en la nocicepción como en la no nocicepción.[9]

Lámina I[editar]
La lámina I también se conoce como núcleo marginal de la médula espinal. La mayoría de las neuronas de proyección de la columna posterior se localizan en la lámina I, aunque la mayoría de las neuronas de esta capa son interneuronas.[10] Las áreas principales que estas neuronas inervan son la médula ventrolateral caudal (MVLC), el núcleo del tracto solitario (NTS), el área parabraquial lateral, la sustancia gris periacueductal y ciertas regiones en el tálamo.[8] La MVLC recibe respuestas nociceptivas y cardiovasculares.[11] El NTS recibe entradas cardiorrespiratorias y afecta a la taquicardia refleja de la estimulación nociva.[12] El área parabraquial lateral se proyecta a la amígdala y el hipotálamo y está involucrada en la respuesta emocional al dolor.[13] La sustancia gris periacueductal desarrolla formas de afrontar el dolor y es uno de los principales objetivos de los analgésicos. Se proyecta a otras partes del tronco encefálico.[14] Los núcleos del tálamo afectan a los aspectos sensoriales y motivacionales del dolor.[15] Las neuronas de esta lámina pueden distinguirse por su morfología como piramidales, fusiformes o multipolares[16]
Lámina II[editar]
Esta capa también se conoce como la sustancia gelatinosa de Rolando y tiene la mayor densidad de neuronas.[17] Estas neuronas median la actividad de las fibras aferentes nociceptivas y de temperatura.[5] Está compuesto casi en su totalidad por interneuronas que se pueden dividir por su morfología. Las cuatro clases morfológicas principales, basadas en la forma de su estructura dendrítica, son células islote, centrales, verticales y radiales. Las interneuronas también se pueden dividir según su función: excitadoras o inhibidoras. Las interneuronas excitatorias liberan glutamato como principal neurotransmisor y las interneuronas inhibitorias utilizan GABA y/o glicina como principal neurotransmisor. Las neuronas de esta capa son solo fibras C y casi no contienen mielina.[18]
Láminas III y IV[editar]
Estas láminas también se conocen como núcleo propio y contienen una densidad de neuronas mucho menor que la lámina II.[17] Hay neuronas de proyección dispersas a lo largo de estas capas.[10] Las fibras mecanosensibles A beta terminan en estas capas.[9] Las capas reciben información de la lámina II y también controlan el dolor, la temperatura y el tacto crudo.[5] Las fibras C que controlan la nocicepción y la temperatura y la información sensorial de los mecanorreceptores se transmiten aquí.[19]
Lámina V[editar]
Esta lámina también se conoce como cuello de la columna posterior y recibe información de los mecanorreceptores e información de peligro de los nociceptores.[19] Tiene neuronas diferentes en las distintas regiones. En la región medial contiene neuronas triangulares de tamaño medio y en la región lateral neuronas multipolares de tamaño medio.[17]
Lámina VI[editar]
Esta lámina solo se encuentra en las regiones cervical y lumbar de la médula espinal. Recibe impulsos aferentes de las fibras musculares y las articulaciones.[5]
Columna gris lateral[editar]
La columna gris lateral, o el asta lateral de la médula espinal, forma parte del sistema nervioso simpático y recibe información del tronco encefálico, los órganos y el hipotálamo. La columna lateral solo está presente en la región torácica y los segmentos lumbares superiores. La columna gris lateral contiene cuerpos celulares preganglionares del sistema nervioso autónomo y neuronas de relevo sensorial.
Importancia clínica[editar]
Se ha demostrado que las neuronas de la columna anterior están afectadas en la esclerosis lateral amiotrófica (ELA). El número de motoneuronas alfa grandes y motoneuronas gamma medianas se reduce mucho y el número de neuronas pequeñas se reduce poco o mucho dependiendo del tipo de ELA[20]
También se ha demostrado que la atrofia muscular tiene un efecto sobre las neuronas de la columna anterior. Se ha registrado una gran pérdida de motoneuronas alfa grandes, motoneuronas gamma medianas y neuronas pequeñas en casos de atrofia muscular.[21]
Los daños en la columna lateral pueden provocar el síndrome de Horner.
La atrofia multisistémica (AMS) también se ha relacionado con la columna gris lateral. Se ha demostrado que la AMS reduce el número de células de la columna lateral en más del 50%.
La columna posterior tiene un papel destacado en el sistema del dolor, es el primer transmisor central en la vía nociceptiva. La neurona aferente de primer orden lleva información sensorial a la neurona de segundo orden en el asta dorsal. El axón de la neurona de segundo orden, si es una neurona de proyección y no una interneurona, entonces va a la neurona de tercer orden en el tálamo. El tálamo se conoce como la "puerta de entrada a la corteza". La neurona de tercer orden pasa luego a la corteza cerebral Las neuronas aferentes son fibras A o fibras C. Las fibras A están mielinizadas, lo que permite una conducción de señales más rápida. Entre estas hay fibras A beta que son más rápidas y transmiten información sobre el tacto no doloroso y fibras A delta que son más lentas y delgadas que las fibras A beta. Las fibras C no están mielinizadas y por lo tanto son más lentas.[10] Las fibras C que transportan señales nociceptivas se pueden dividir en dos tipos: fibras que contienen neuropéptidos, como la sustancia P, y fibras que no contienen neuropéptidos.[22] Los dos tipos terminan en áreas muy diferentes. Las fibras C no peptidérgicas están unidas a la piel, donde inervan la epidermis, mientras que las fibras C peptidérgicas inervan otros tejidos y partes más profundas de la piel.[10]
Hay dos tipos principales de señales nociceptivas: sensoriales y afectivas.
Sensoriales[editar]
Las señales nociceptivas sensoriales brindan información sobre qué tipo de estímulo (calor, mecánico, etc.) está afectando el cuerpo y también indica en qué parte del cuerpo se encuentra el estímulo. Las neuronas nociceptivas sensoriales tienen un pequeño campo receptivo para ayudar a identificar la ubicación exacta de un estímulo.[23]
Afectivas[editar]
Las señales nociceptivas afectivas afectan a las emociones. Estas señales van al sistema límbico e indican al cuerpo que reaccione ante el estímulo de peligro (por ejemplo, retirar la mano de una estufa caliente). Estas neuronas tienen campos receptivos más amplios porque la reacción emocional a la mayoría de los estímulos dolorosos es similar.[23]
Referencias[editar]
- ↑ Henry Gray; Susan Standring; Harold Ellis; B. K. B. Berkovitz (2005), Gray's anatomy, p. 255.
- ↑ a b c d e Terao S, Sobue G, Hashizume Y, Li M, Inagaki T, Mitsuma T (Aug 1996). «Age-related changes in human spinal ventral horn cells with special reference to the loss of small neurons in the intermediate zone: a quantitative analysis». Acta Neuropathologica 92 (2): 109-14. PMID 8841655. doi:10.1007/s004010050497.
- ↑ a b Cagle, MC; Honig, MG (July 2013). «Parcellation of Cblns 1, 2, and 4 among different subpopulations of dorsal horn neurons in mouse spinal cord.». Journal of Comparative Neurology 522 (2): 479-97. PMC 3855892. PMID 23853053. doi:10.1002/cne.23422.
- ↑ a b c Friese A, Kaltschmidt JA, Ladle DR, Sigrist M, Jessell TM, Arber S (Aug 11, 2009). «Gamma and alpha motor neurons distinguished by expression of transcription factor Err3». Proceedings of the National Academy of Sciences of the United States of America 106 (32): 13588-13593. Bibcode:2009PNAS..10613588F. PMC 2716387. PMID 19651609. doi:10.1073/pnas.0906809106.
- ↑ a b c d Siegel, Allan (2010). Essential Neuroscience. Lippincott Williams & Wilkins. ISBN 978-0781783835.
- ↑ Haines, Duane (2012). Fundamental Neuroscience for Basic and Clinical Applications. Saunders. ISBN 978-1437702941.
- ↑ Brown, AG (1981). Organization in the Spinal Cord: The Anatomy and Physiology of Identified Neurones. Berlin: Springer-Verlag.
- ↑ a b Gauriau, Caroline; Bernard, Jean-François (2004). «A comparative reappraisal of projections from the superficial laminae of the dorsal horn in the rat: The forebrain». The Journal of Comparative Neurology 468 (1): 24-56. PMID 14648689. doi:10.1002/cne.10873.
- ↑ a b Kato G, Kawasaki Y, Koga K, Uta D, Kosugi M, Yasaka T, Yoshimura M, Ji RR, Strassman AM (April 2009). «Organization of intralaminar and translaminar neuronal connectivity in the superficial spinal dorsal horn». The Journal of Neuroscience 29 (16): 5088-5099. PMC 2777732. PMID 19386904. doi:10.1523/JNEUROSCI.6175-08.2009.
- ↑ a b c d Todd, Andrew (Dec 2010). «Neuronal circuitry for pain processing in the dorsal horn». Nature Reviews Neuroscience 11 (12): 823-836. PMC 3277941. PMID 21068766. doi:10.1038/nrn2947.
- ↑ Lima D, Albino-Teixeira A, Tavares I (Mar 2002). «The caudal medullary ventrolateral reticular formation in nociceptive-cardiovascular integration. An experimental study in the rat». Experimental Physiology 87 (2): 267-74. PMID 11856973. doi:10.1113/eph8702354.
- ↑ Boscan P, Pickering AE, Paton JF (Mar 2002). «The nucleus of the solitary tract: an integrating station for nociceptive and cardiorespiratory afferents». Experimental Physiology 87 (2): 259-66. PMID 11856972. doi:10.1113/eph8702353.
- ↑ Gauriau, C; Bernard, J. F. (Mar 2002). «Pain pathways and parabrachial circuits in the rat». Experimental Physiology 87 (2): 251-8. PMID 11856971. doi:10.1113/eph8702357.
- ↑ Heinricher MM, Tavares I, Leith JL, Lumb BM (Apr 2009). «Descending control of nociception: Specificity, recruitment and plasticity». Brain Research Reviews 60 (1): 214-225. PMC 2894733. PMID 19146877. doi:10.1016/j.brainresrev.2008.12.009.
- ↑ Gauriau, C.; Bernard, J. F. (Jan 2004). «Posterior triangular thalamic neurons convey nociceptive messages to the secondary somatosensory and insular cortices in the rat». Journal of Neuroscience 24 (3): 752-61. PMC 6729251. PMID 14736861. doi:10.1523/JNEUROSCI.3272-03.2004.
- ↑ Han ZS, Zhang ET, Craig AD (Jul 1998). «Nociceptive and thermoreceptive lamina I neurons are anatomically distinct». Nature Neuroscience 1 (3): 218-25. PMID 10195146. doi:10.1038/665.
- ↑ a b c Paxinos, George (2004). The Human Nervous System. Academic Press. ISBN 978-0125476263.
- ↑ Grudt, T. J.; Perl, E. R. (Apr 1, 2002). «Correlations between neuronal morphology and electrophysiological features in the rodent superficial dorsal horn». The Journal of Physiology 540 (Pt 1): 189-207. PMC 2290200. PMID 11927679. doi:10.1113/jphysiol.2001.012890.
- ↑ a b Muthayya, NM (2002). Human Physiology. New Delhi: Jaypee Brothers Medical Publishers.
- ↑ Terao S, Sobue G, Hashizume Y, Mitsuma T, Takahashi A (Feb 1994). «Disease-specific patterns of neuronal loss in the spinal ventral horn in amyotrophic lateral sclerosis, multiple system atrophy and X-linked recessive bulbospinal neuronopathy, with special reference to the loss of small neurons in the intermediate zone». Journal of Neurology 241 (4): 196-203. PMID 8195817. doi:10.1007/bf00863768.
- ↑ Terao S, Sobue G, Li M, Hashizume Y, Tanaka F, Mitsuma T (Jan 1997). «The lateral corticospinal tract and spinal ventral horn in X-linked recessive spinal and bulbar muscular atrophy: a quantitative study». Acta Neuropathologica 93 (1): 1-6. PMID 9006650. doi:10.1007/s004010050575.
- ↑ Snider, W. D.; McMahon, S. B. (Apr 1998). «Tackling pain at the source: new ideas about nociceptors». Neuron 20 (4): 629-32. PMID 9581756. doi:10.1016/s0896-6273(00)81003-x.
- ↑ a b Price, Donald (Oct 2002). «Central neural mechanisms that interrelate sensory and affective dimensions of pain». Molecular Interventions 2 (6): 392-403, 339. PMID 14993415. doi:10.1124/mi.2.6.392.
